Уравнение ван дер ваальса внутренняя энергия
| Внутренняя энергия газа Ван–дер–Ваальса |   |
Энергия одного моля газа Ван–дер–Ваальса слагается из внутренней энергии молекул, составляющих газ: кинетической энергии теплового движения центра масс молекул Потенциальная энергия притяжения молекул равна работе, необходимой для разведения молекул на бесконечное расстояние друг от друга. В этом конечном состоянии молекулы не взаимодействуют друг с другом, а потенциальную энергию можно считать равной нулю. Дополнительное давление газа Ван-дер-Ваальса за счет взаимного притяжения молекул равно a/Vm 2 и, следовательно, потенциальная энергия взаимодействия равна: Полная энергия одного моля газа Ван-дер-Ваальса определяется соотношением Причиной недостаточной точности уравнения Ван–дер–Ваальс считал ассоциацию молекул в газовой фазе, которую не удается описать, учитывая зависимость параметров a и b от объема и температуры, без использования дополнительных постоянных. После 1873 г. сам Ван–дер–Ваальс предложил еще шесть вариантов своего уравнения, последнее из которых относится к 1911 г. и содержит пять эмпирических постоянных. Две модификации уравнения предложил Клаузиус, и обе они связаны с усложнением вида постоянной b. Больцман получил три уравнения этого типа, изменяя выражения для постоянной a. Всего известно более сотни подобных уравнений, отличающихся числом эмпирических постоянных, степенью точности и областью применимости. Выяснилось, что ни одно из уравнений состояния, содержащих менее 5 индивидуальных постоянных, не оказалось достаточно точным для описания реальных газов в широком диапазоне Р, V, T, и все эти уравнения оказались непригодными в области конденсации газов. Из простых уравнений с двумя индивидуальными параметрами неплохие результаты дают уравнения Дитеричи и Бертло. Принципиальное значение уравнения Ван–дер–Ваальса определяется следующими обстоятельствами:
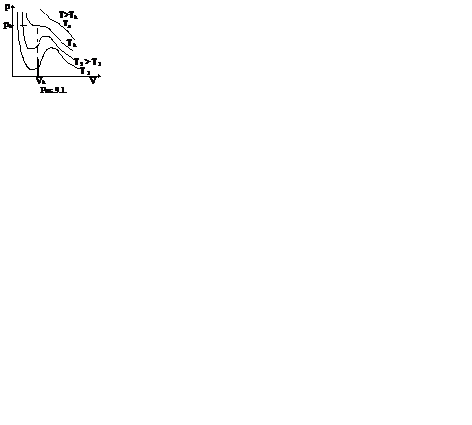
Уравнение ван дер ваальса внутренняя энергияПоскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня (рис. 3.7.4). Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 3.7.4, 3.7.5). Полученные из уравнения Ван-дер-Ваальса значения параметров состояния в критической точке: Рис. 3.7.4. Изотермы Ван-дер-Ваальса Рис. 3.7.5. Фазовые переходы Критические параметры некоторых газов приведены в приложении. При Т > Ткр вещество находится только в одном, газообразном, состоянии (рис. 3.7.4). При температуре газа ниже критической такая однозначность исчезает, т. е. имеется возможность перехода вещества из газообразного состояния в жидкое и наоборот. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD (жидкость) через двухфазное состояние (газ — жидкость) GL вдоль горизонтальной изотермы GCL. На рис. 3.7.5 показаны области равновесных состояний вещества: «Ж — Г» — область двухфазных состояний: жидкость — газ. «Ж» — области жидких состояний, «Г» — газообразное состояние. 3.7.4. Внутренняя энергия газа Ван-дер-Ваальса Энергия одного моля газа Ван-дер-Ваальса слагается из внутренней энергии молекул, составляющих газ: кинетической энергии теплового Реальные газы. Уравнение Ван-дер-Ваальса. Критическое состояние.Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания. Для получения уравнения состояния реального газа необходимо учесть собственный объем молекул и энергию взаимодействия молекул на расстоянии. Наличие собственного объема молекул приводит к уменьшению объема, предоставленного молекулам, на некоторую величину. Силы притяжения между молекулами газа вызывают уменьшение давления молекул газа на стенки сосуда на некоторую величину рi. Это уравнение может получено путем соответствующего изменения уравнения Менделеева-Клапейрона путем внесения в него поправок. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля имеет вид: где р — давление, оказываемое на стенки сосуда, VМ – объем одного моля газа, а и b — постоянные Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. Поправка b= Уравнение Ван-дер-Ваальса для произвольной массы газа имеет вид: Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа. Уравнение Ван-дер-Ваальса после нескольких преобразований можно записать в виде: Это уравнение третьей степени относительно V. Кубическое уравнение может иметь либо три вещественных корня, либо один вещественный и два мнимых. Первому случаю соответствуют изотермы при низких температурах – кривые для Т1 и Т2 (рис.9.1.) Второму случаю изотермы при высоких температурах (одно значение объема V отвечает одному значению давления р), то есть любая изотерма начиная от изотермы для Тк. Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах (так как при этих условиях газ можно считать идеальным). Для семейства изотерм Ван-дер-Ваальса характерно так называемой критической изотермы (при температуре Тк) имеющий точку перегиба при некотором давлении рк и объеме Vк; при Т>Тк все изотермы идут монотонно, при Т Уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях. Дата добавления: 2015-04-01 ; просмотров: 18443 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ источники: http://www.chem-astu.ru/chair/study/physics-part1/?p=202 http://helpiks.org/3-368.html |

 , равной , и потенциальной энергии взаимного притяжения молекул.
, равной , и потенциальной энергии взаимного притяжения молекул.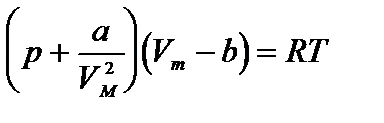 ,
,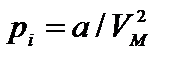 – внутреннее давление, обусловленное силами взаимного притяжения между молекулами. Поправка b характеризует ту часть объем, которая недоступна для движения молекул. Она равна учетверенному собственному объему молекул, содержащихся в моле газа:
– внутреннее давление, обусловленное силами взаимного притяжения между молекулами. Поправка b характеризует ту часть объем, которая недоступна для движения молекул. Она равна учетверенному собственному объему молекул, содержащихся в моле газа: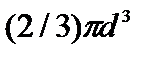 NA.
NA.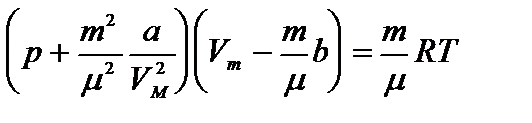
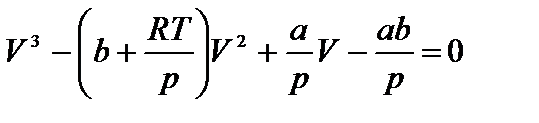 .
.