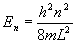Электронная библиотека
9.1. В сосуде вместимостью V = 0,3 л находится углекислый газ, содержащий количества вещества ν = 1 моль при температуре Т = 300 К. Определить давление газа если: 1) газ реальный; 2) газ идеальный.
1) Газ реальный. Уравнение состояния реального газа уравнение Ван-дер-Ваальса для одного моля газа уравнение имеет вид:
Здесь R = 8,31 Дж/моль К ; а и b – поправки Ван-дер-Ваальса. Их значение определяется из справочных таблиц: а = 0,361 Н·м 4 / моль 2 ; b = 4,28·10 -5 м 3 / моль.
Из формулы (1) получим:
Проверка единиц измерения:
2). Газ идеальный. Применим уравнение Клаперона-Менделеева для одного моля газа: , откуда .
Проверка единиц измерения:
9.2. В сосуде вместимостью V1 = 1л содержится m =10 г азота. Определить изменение (ΔТ) температуры азота, если он расширяется в пустоту до объема V2 = 10л.
Решение: Процесс расширения газа в пустоту является адиабатическим, то есть происходит без теплообмена с окружающей средой: ΔQ = 0.
При расширении в пустоту работа не совершается: А = 0 .
Из первого начала термодинамики следует, что ΔU = 0, или U = const.
Внутренняя энергия газа остается постоянной.
Для реального газа внутренняя энергия определяется по формуле:
Здесь ν = – количество вещества, Cv – молярная теплоемкость газа, а – поправка Ван-дер-Ваальса, Vμ – объем одного моля газа.
Объём одного моля газа вычисляем по формуле:
Применим формулы (1) и (2) к решению задачи. До расширения
Выполним расчеты. Значение а возьмем из справочных таблиц: а = 0,135(Н м 4 )/моль 2 . Азот – двухатомный газ, поэтому его теплоемкость равна:
Проверка единиц измерения:
Срочно?
Закажи у профессионала, через форму заявки
8 (800) 100-77-13 с 7.00 до 22.00
Уравнение ван дер ваальса задачи
Задачи 1-5
Задача 1. Вода
Задача 2. Газы Ван-дер-Ваальса
Задача 3. Скорости и механизмы реакций
Задача 4. Ферментативный катализ
Задача 5. Уравнение Шредингера
Задача 1. Вода
Вода — самое распространенное вещество в окружающей среде — прекрасная система для демонстрации многих понятий термодинамики. Она может существует в трех фазах: твердой (лед), жидкой и газообразной. [При высоких давлениях существует несколько различных модификаций льда, но это выходит за рамки задачи]. Фазовая диаграмма воды, которая описывает зависимость равновесного давления от температуры для различных фаз, имеет вид:
А. Фазовая диаграмма
Фазовая диаграмма воды (без масштаба)
а. При каких температуре и давлении все три фазы воды находятся в равновесии?
б. По диаграмме определите, как влияет понижение давления на температуру кипения воды и температуру плавления льда.
в. Кривая равновесия «жидкость-пар» заканчивается в точке Pc = 223 бар и Tc = 374 о С. Что означает эта точка?
г. Какая фаза воды устойчива при T = 300 K, P = 12.0 бар; T = 270 K, P = 1.00 бар?
д. Ниже какого давления лед при изобарном нагревании будет сублимироваться в пар?
е. При некоторых температуре и давлении на кривой «жидкость-пар» молярные объемы воды в двух фазах равны:м 3
м 3 .
Рассчитайте объемные доли воды жидкости и пара в сосуде объемом 0.100 л, содержащем 1.00 моль воды.
Б. Уравнение Клаузиуса-Клапейрона
а. Объясните ответ на вопрос А, б с помощью уравнения Клапейрона.
б. В автоклавах, используемых в медицине для стерилизации, вода должна кипеть при температуре 120 о С для того, чтобы убить большую часть бактерий. Оцените необходимое для этого давление. Мольная энтальпия испарения воды равна 40.66 кДж . моль -1 в нормальной точке кипения. Укажите, какие допущения вы использовали при оценке.
в. Мольная энтальпия плавления воды в нормальной точке замерзания (273.15 K) равна 6008 кДж . моль -1 . Оцените давление, при котором вода и лед находятся в равновесии при температуре -0.200 о С. Плотность льда = 917 кг . м -3 , плотность воды = 1000 кг . . м -3 . Укажите, какие допущения вы использовали при оценке.В. Необратимая конденсация
а. Возьмем 28.5 г переохлажденной (жидкой) воды при -12 о С и 1.00 бар. Находится ли это состояние в плоскости P — T на фазовой диаграмме?
б. Это метастабильное состояние внезапно переходит в лед при этих же температуре и давлении. Считая метастабильное состояние равновесным, рассчитайте, сколько теплоты выделится при этом. Мольные теплоемкости, которые можно считать постоянными, равны:
Дж . моль -1 . К -1
Дж . моль -1 . К -1
Дж . г -1
в. Определите общее изменение энтропии Вселенной в результате этого процесса и покажите, что этот результат подтверждает Второй Закон термодинамики. Температуру окружающей среды примите равной -12 о С.
Задача 2. Газы Ван-дер-Ваальса
Из уравнения состояния идеального газа PV = nRT следует, что фактор сжимаемости равен 1:
Однако, для реальных газов фактор сжимаемости отклоняется от 1. Для того, чтобы описать поведение реальных газов, Ван-дер-Ваальс предложил следующее уравнение состояния:
,
где a и b — индивидуальные постоянные для газа. Постоянная a служит мерой межмолекулярного взаимодействия, а постоянная b связана с собственным размером молекул.
а. Используя уравнение Ван-дер-Ваальса, покажите, что:
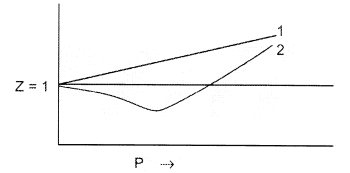
1. При достаточно высоких температурах Z больше единицы при всех давлениях. При высоких температурах и низких давлениях Z стремится к значению идеального газа.
2. При низких температурах Z может быть меньше единицы.
3. При a = 0, Z линейно растет с ростом давления.б. На рисунке приведена зависимость Z от P при некоторой температуре для He и N2.
Для He, a = 3.46 10 -2 бар . л 2 . моль -2 , b = 2.38 10 -2 л . моль -1 .
Для N2, a = 1.37 бар . л 2 . моль -2 , b = 3.87 10 -2 л . моль -1 .
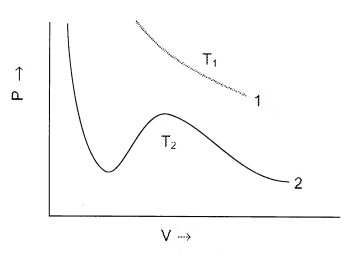
Укажите, какой график соответствует He, а какой — N2.в. На рисунке приведены две P—V изотермы газа Ван-дер-Ваальса. Укажите, какая из них соответствует температуре ниже критической (Tc) для данного газа.
г. Для заданного P, три корня уравнения Ван-дер-Ваальса сливаются при некоторой температуре T = Tc. Выразите Tc через a и b и, используя этот результат, покажите, что N2 сжижается легче, чем He.
д. Определите работу, совершаемую одним молем газообразного N2 при обратимом изотермическом расширении от 1.00 л до 10.0 л. Примите, что N2 описывается уравнением Ван-дер-Ваальса.Задача 3. Скорости и механизмы реакций
Одно и то же кинетическое уравнение для химической реакции может соответствовать нескольким разным механизмам. Для реакции
H2 + I2 2HI
экспериментальное кинетическое уравнение имеет вид:
В течение долгого времени полагали, что реакция протекает так, как написано в уравнении, т.е., что она представляется собой элементарную бимолекулярную реакцию. В настоящее время считают, что реакция может протекать по нескольким механизмам. Ниже определенной температуры предложены два альтернативных механизма:
(1) I2 2I (константа равновесия K)k1
I + I + H2 2HI (2) I2 (I2)d (константа равновесия K‘)
k2
(I2)d + H2 2HI где (I2)d представляет распадное (несвязанное) состояние I2. В каждом механизме первая стадия — быстрая, а вторая — медленная.
а. Покажите, что оба механизма соответствуют экспериментальному кинетическому уравнению.
б. В таблице приведены значения константы скорости реакции k при двух температурах:k (л . моль -1 . с -1 )
373.15
8.74 10 -15
473.15
9.53 10 -10
1. Определите энергию активации Ea.
2. Энергия связи в молекуле I2 равна 151 кДж . моль -1 . Объясните, почему вторая стадия в каждом механизме является лимитирующей.
в. Изменение внутренней энергии ( U) в суммарной реакции равно -8.2 кДж . моль -1 . Определите энергию активации обратной реакции.
г. Энергия активации реакции бывает отрицательной. Пример — рекомбинация атомов иода в газовой фазе в присутствии аргона: I + I + Ar I2 + Ar, для которой энергия активации примерно равна -6 кДж . моль -1 .
Один из возможных механизмов этой реакции: I + Ar + Ar IAr + Ar (константа равновесия K»)
k3
где IAr — очень слабо связанная молекула.
1. Предполагая, что вторая стадия — лимитирующая, выведите кинетическое уравнение для этой реакции.
2.Объясните, почему энергия активации для рекомбинации иода — отрицательная.
Задача 4. Ферментативный катализ
Ферменты играют ключевую роль во многих химических реакциях в живых организмах. Некоторые ферментативные реакции можно описать простым механизмом Михаэлиса-Ментен:
где E обозначает фермент, S — субстрат, на который действует фермент, а P — конечный продукт реакции.
Предположим, что вторая стадия необратима, а равновесие на первой стадии устанавливается очень быстро.
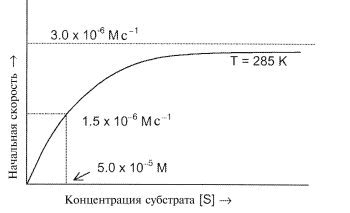
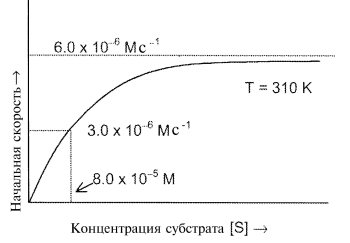
а.В эксперименте начальную скорость (образования P) определяли при различных концентрациях субстрата, поддерживая общую концентрацию фермента постоянной и равной 1.5 10 -9 М. При этом получили следующую зависимость:
1. При малых [S] зависимость — линейная, а при больших [S] она стремится к постоянному значению. Покажите, что эти свойства соответствуют механизму Михаэлиса-Ментен. (Используйте приближение стационарных концентраций для промежуточного комплекса).
2. Определите константу скорости k2 для второй стадии.
3. На базе механизма Михаэлиса-Ментен предскажите начальную скорость реакции при концентрации субстрата [S] = 1.0 10 -4 М.
4. Определите константу равновесия образования фермент-субстратного комплекса ES.
б. Описанный эксперимент, который был проведен при 285 К, повторили при другой температуре (310 К) с той же самой общей концентрацией фермента, и получили аналогичную кривую:
Определите энергию активации превращения ES в E и P
в. Интересное приложение ферментативного катализа состоит в том, что ферменты инактивируют антибиотики. Так, антибиотик пенициллин инактивируется ферментом пенициллиназой, выделяемым некоторыми бактериями. Этот фермент имеет один активный центр. Предположим для простоты, что данная реакция описывается константами скорости, определенными выше в п. а. Допустим также, что доза 3 мкмоль антибиотика вызывает выделение 2.0 10 -6 мкмоль фермента в 1.00 мл бактериальной суспензии.
1. Определите долю фермента, которая связывается с субстратом (пенициллином) на начальной стадии реакции.
2. Определите время, необходимое для инактивации 50% дозы антибиотика.
г. Предположим, что для управления инактивацией пенициллина введено вещество, которое имеет похожую на пенициллин структуру и может занимать активный центр фермента, однако не обладает биологической активностью. Это приводит к ингибированию ферментативной реакции. Степень ингибирования определяется следующим образом: 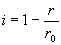
Рассмотрим следующий механизм ингибирования:
1. Покажите, что степень ингибирования понижается с увеличением концентрации субстрата (при постоянной концентрации ингибитора), и ингибитор становится неэффективным при больших концентрациях субстрата. (Такая механизм ингибирования называется конкурентным).
2. При низкой концентрации субстрата пенициллина определите, какая концентрация ингибитора вызовет понижение скорости инактивации пенициллина в 4 раза. Константа диссоциации комплекса «фермент-ингибитор» равна 5.0 10 -5 .
Задача 5. Уравнение Шредингера
Простейшее уравнение Шредингера, описывающее частицу, которая свободно движется в одномерном «жестком» ящике, имеет фундаментальное свойство: граничные условия для волновой функции приводят к квантованию некоторых величин.
а. Электрон массой m движется по оси x и заперт между точками с координатами x = 0 и x = L. Во всей этой области движение электрона — свободное, на него не действуют никакие силы.
1. Напишите стационарное уравнение Шредингера для волновой функции электрона y .
2. Какие из перечисленных функций могут быть волновой функцией электрона в одномерном жестком ящике:
1)
2)
3)
4),где k — любое действительное число, а n — натуральное число?
3.Покажите, что волновым функциям из вопроса а.2 соответствует энергия
4. Изобразите графики волновых функций электрона в основном и в первых двух возбужденных состояниях. Какое число узлов (в области между x = 0 и x = L) имеет волновая функция с энергией En?
5.Нормируйте волновую функцию основного состояния электрона. (Интеграл от квадрата модуля нормированной волновой функции по всему пространству должен быть равен единице.)
б. Интересным примером использования этой одномерной модели в химии служит описание движения электрона по сопряженной системе одинарных и двойных связей. Молекула бутадиена-1,3 имеет 4 -электрона, которые, согласно этой модели, свободно двигаются по линии, включающей три углерод-углеродные связи примерно одинаковой длины (1.4 10 -10 м) с добавлением отрезка 1.4 10 -10 м на каждом краю. Используя принцип наименьшей энергии, изобразите схему заполнения электронами энергетических уровней. Рассчитайте наименьшую энергию возбуждения системы.
в. Граничные условия для волновой функции приводят к квантованию не только энергии, но и других физических величин, таких как момент импульса. Волновая функция, соответствующая значению z-компоненты момента импульса Lz = h /2 , имеет вид: 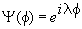
где f — (азимутальный) угол, описывающий положение в плоскости x—y относительно оси x. Покажите, что условие однозначности этой функции в каждой точке пространства приводит к квантованию . Определите квантованные значения проекции момента импульса на ось z.
Примеры решения задач по физике
Основные понятия и формулы.
Поведение реальных газов описывается уравнением состояния Ван-дер-Ваальса: для одного моля:

для ν молей газа:

где a, b – константы, зависящие от природы газа, которые приводятся в справочниках и приложениях к сборникам задач.
Внутренняя энергия ν молей реального газа:

Критические параметры вещества удовлетворительно описываются уравнением Ван-дер-Ваальса и выражаются через его параметры a и b:
Pкр = a/27b2, Vкр. = 3b, Tкр. = 8a/27bR (6.4)
Эффект Джоуля-Томпсона описывается соотношением:
где H1 и H2 – энтальпия газа до и после его расширения, соответственно.
Задачи на эту тему можно разделить на следующие группы:
а) задачи, которые учат работать с уравнением Ван-дер-Ваальса и позволяют получить ряд полезных соотношений;
б) задачи по описанию критического состояния вещества;
в) задачи на эффект Джоуля-Томпсона.
6.2. Примеры решения задач.
Один моль кислорода расширили до объема V1 = 1 л до V2 = 5 л при постоянной температуре T = 280 K. Вычислить количество поглощенного газом тепла, газ считать ван-дер-ваальсовым.
Дано: V1 = 1 л = 10-3 м3, V2 =5 л =5 10-3 м3, T = 280 К.
Решение. Для ответа на вопрос задачи запишем первое начало, в которое входит искомая величина Q. Элементарное тепло 

Согласно (6.3), внутренняя энергия реального газа:

а давление p из (6.1):

Подставим полученные выражения в (1), тогда:

Первый интеграл равен нулю, так как процесс идет при постоянной T. Из второго и третьего интегралов получим:

http://www.chem.msu.su/rus/olimpiad/olimp01/zadacha1-5.html
http://arthis.ru/rubeg_XIX-XX/index1.htm
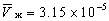 м 3
м 3 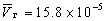 м 3 .
м 3 . 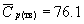 Дж . моль -1 . К -1
Дж . моль -1 . К -1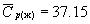 Дж . моль -1 . К -1
Дж . моль -1 . К -1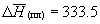 Дж . г -1
Дж . г -1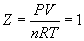
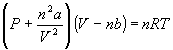 ,
,
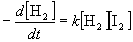
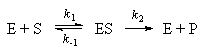
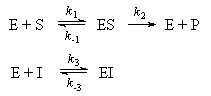
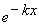
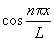
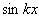
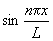 ,где k — любое действительное число, а n — натуральное число?
,где k — любое действительное число, а n — натуральное число?