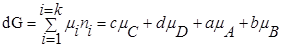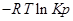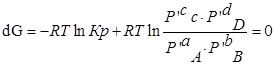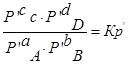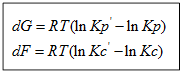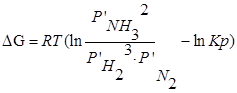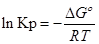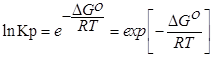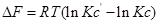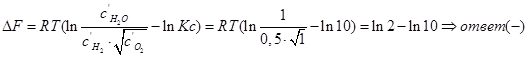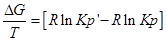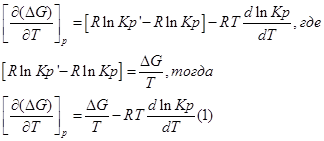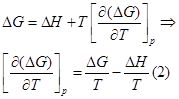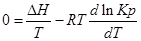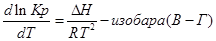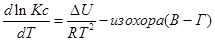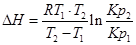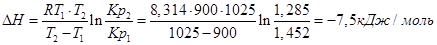ИЗОТЕРМА ВАНТ — ГОФФА, ВЫВОД И АНАЛИЗ
Константа равновесия определяют условия равновесия, когда концентрация (парциальные давления) является равновесными. В каком направлении пойдёт химическая реакция, если парциальное давление исходных веществ и продуктов реакции отличаются от равновесных? Ответить на этот вопрос поможет уравнение изотермы химической реакции.
Рассмотрим уравнение реакции: aA + bB ↔ cC + dD
Для изобарно-изотермического процесса изменение Гиббса равно:
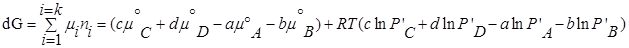
где 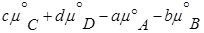
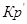
( 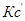
АНАЛИЗ ИЗОТЕРМЫ ВАНТ-ГОФФА
1. Главное значение изотермы реакции состоит в том, что она позволяет рассчитать ∆Gили ∆Fобратимый реакции для заданного состава реакционной смеси и определить, в каком направлении, и до какого предела протекает реакция при известных условиях.
а) Если Кр˃Кр’, то lnКр˃lnКр’; ∆G˂0- реакция идет самопроизвольно в прямом направлении.
б) Если Кр˂Кр’, то lnКр˂lnКр’; ∆G˃0- реакция протекает самопроизвольно в обратном направлении, в сторону образования продуктов.
в) Если Кр=Кр’, то lnКр=lnКр’; ∆G=0- равновесие.
Если парциальное давление всех участников реакции в данный момент времени равны атмосферному давлению
Пусть PA’=PB’=PC’=PD’=1( 1,013*10 5 Па), тоKp’=1; Тогда логарифм этого выражения будет равен нулю (lnKp’=0), а уравнение изотермы Вант – Гоффа примет вид:
∆G⁰=RTlnKp-стандартная энергия Гиббса
Выразм константу равновесия из последнего уравнения и получим:

В объеме 10л, взяли: 320(г) О2 , 10(г) Н2 и 180(г) паров воды . Определите, в какую направлении пойдёт химическая реакция: 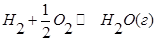
(Кс=10). Процесс изохорный.
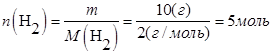
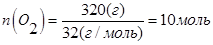
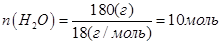
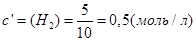
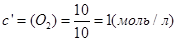
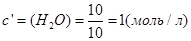
ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА КОНСТАНТУ
РАВНОВЕСИЯ. УРАВНЕНИЕ ИЗОБАРЫ И ИЗОХОРЫ ВАНТ-ГОФФА (В-Г)
Константы равновесия — это величины постоянные при данной температуре. При изменении температуры константа равновесия изменяется, и довольно существенно.
Изменение константы равновесия и направления химической реакции в зависимости от температуры количественно характеризует уравнение изобары изохоры химической реакции.
ВЫВОД УРАВНЕНИЯ ИЗОБАРЫ И ИЗОХОРЫ
Разделим уравнение изотермы Вант- Гоффа на температуру:
Продифференцируем его по Т и перепишем:
Представим уравнение Гиббса – Гельмгольца в виде:
Из уравнения (1) вычтем уравнение (2):
Эти уравнения показывают влияния температуры на константу равновесия, где определяющим фактором является тепловой эффект химической реакции.
Влияние температуры на константу равновесия определяется типом реакци.
1. Если тепловой эффект реакци ∆H(∆U)˃0(эндотермическая, поглощение), то 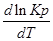
В обратном — Т↓,Кр↓.
2. Если ∆H(∆U)˂0 (экзотермическая, выделение), то 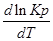
В обратном — Т↑,Кр↓.
3. Если ∆H(∆U)=0 , тов этом случае константа равновесия не зависит от температуры Кp ≠ f(T).
ИНТЕГРИРОВАНИЕ ИЗОБАРЫ В-Г
1. Приближенное интегрирование ∆Н ≠ f(Т),
тогда 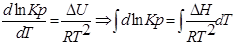
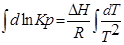
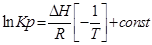
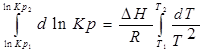
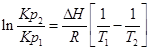
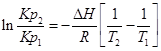
С помощью этого уравнения можно найти:
1. ∆Н (тепловой эффект реакции), если известны равновесия при двух различных температурах (Кр1(Т1) и Кр2(Т2))
2. Кр2(Т2) – константу равновесия при температуре Т2, если известна константа равновесия при другой температуре и тепловой эффект реакции (Кр1(Т1) и ∆Н).
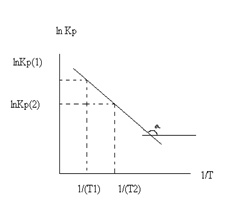
Так как после интегрирования мы получили уравнение прямой, то эта зависимость может быть представлена на графике: lnKp(1) lnKp(2)
Тангенс угла наклона прямой реакции, исходя из уравнения прямой:
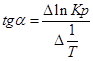
Зависимость теплового эффекта от температуры выражается уравнением:
Подставим это уравнение в уравнение изобары Вант- Гоффа:
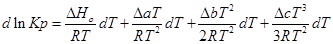
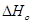
Проинтегрируем это уравнение и получим:
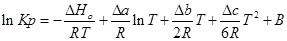
где В — постоянная интегрирования, для нахождения необходимо знать значения константы равновесия Кр при любой фиксированной температуре.
Однако проводить расчеты с использованием данного уравнения довольно сложно и используется довольно редко.
Пример. Определим изменение эффекта реакции Fe+H2O+FeO+H2, если для Т1=900К, Кр1=1,452, а для Т2=1025К Кр2=1,285.
Используем уравнение:
При повышении температуры от 900 до 1025К выделится дополнительно 7,5 кДж/моль теплоты.
| | | следующая лекция ==> | |
| Метод статистического моделирования нагрузки на ЭВМ | | | Строение и характеристика макроэргических соединений на примереАТФ |
Дата добавления: 2016-02-02 ; просмотров: 9809 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение вант гоффа для газов
Состояние системы, которое характеризуется равенством скоростей прямой и обратной реакции и постоянством концентрации всех веществ называется химическим равновесием.
Константа равновесия зависит от природы веществ и температуры и не зависит от исходных концентраций. В небольших количествах (1 – 2 атм) давление на константу равновесия не влияет.
Изменение константы равновесия с температурой определяется изменения энтальпии. Если D Н D Н > 0, то с увеличением температуры константа равновесия увеличивается.
Смещение равновесия – переход системы из одного равновесного состояния в другое при изменении внешних условий.
Если изменить одно из условий, при которых система находится в равновесии, то в системе усилится та реакция которая противодействует производственному изменению. На конденсированные системы давление существенного влияния не оказывает.
Будем рассматривать гетерогенные системы, много-компонентные, в которых протекают химические процессы.
С термодинамической точки зрения существуют системы изометрий закрытые. В изомерных массообменах термическая и барическая связь отсутствует. Критерием самопроизвольно протекающих процессов изомерных систем может служить изменение энтропии, как было показано, этот критерий для закрытых систем не годится, так как в закрытых системах массообмена нет, но существует термическая и барическая связь. В таких системах V , Р, С являются контролируемыми величинами, и в качестве критерия самопроизвольности процесса обычно пользуются термодинамическим потенциалом F , G .

В случае протекания химического процесса изучение системы начинают с его фазового состояния – правило фаз Гиббса. По этому правилу определяют число степеней свободы – число параметров, которые можно изменить, чтобы число фаз не изменялось. Это число свободы не контролируется в ходе процесса.
В связи с тем, что в ходе химического процесса фазовое равновесие и фазовое состояние не нарушается, такие понятия как активность и летучесть можно использовать и при рассмотрении химического равновесия.
Обычно для грубой оценки возможности простого химического процесса используются величины теплового эффекта. Однако такая оценка является в большинстве случаев не совсем точной, так как известно много реакций идущих с поглощением тепла, поэтому наиболее правильно следует в качестве критерия считать 



Самопроизвольный процесс возможен, если 








Это может иметь место в том случае, если 
Вывод: в общем случае не могут величины тепла процессов являться критериями самопроизвольности процессов.
Чтобы ответить на вопрос, при каких условиях энтропийным членом м o жно пренебречь, надо рассмотреть уравнение (1). 
Раскроем смысл всех величин уравнения (1):


Т.о., для нахождения 

Существуют три способа нахождения 
1. Исходим из сотоношения (1) и третьего начала термодинамики.
2. Основан на уравнениях изотермы, изобары и изохоры Вант-Гоффа.
3. Базируется на определении ЭДС гальванических элементов.
Она состоит из теоремы Нерста и постулатов Планка.
Теорема: согласно теореме, при 


Постулаты: при 


Постулаты Планка не распространяются на все твердые вещества.
Неправильно построенные и аморфные тела не дают нулевой энтропии, однако энтропия их при абсолютном нуле не невелика, т.о. абсолютное значение величины 



Чтобы использовать соотношение (1) 

абсолютное значение энтропии было найдено следующим образом:



но, в соответствии с третьем началом термодинамики, последнее уравнение можно преобразовать для идеально твердого тела, если принять 
Это уравнение дает возможность рассчитать абсолютное значение энтропии.
Зная энтропию для твердого тела, можно найти энтропию для жидких и газообразных веществ. Это практически делается так:
1 – обозначат энтропию твердого вещества, далее, при переходе веществ в жидкое состояние, энтропия возрастает на величину приведенной теплоты, появляется 2 член.
В подинтегральную величину входит теплоемкость – С ; затем идет испарение жидкости при Р = const .
Делается это следующим образом :
такие зависимости строятся для каждого вещества, участвующего в реакции.


ВАНТ-ГОФФА ПРАВИЛО
ВАНТ-ГОФФА ПРАВИЛО. Почти все химические реакции при повышении температуры идут быстрее. Зависимость скорости реакции от температуры описывается уравнением Аррениуса:
k = Ae –E a/RT, где k – константа скорости реакции, А – не зависящая от температуры константа (ее называют предэкспоненциальным множителем), Еа– энергия активации, R – газовая постоянная, Т – абсолютная температура. В школьных учебниках зависимость скорости реакции от температуры определяют в соответствии с так называемым «правилом Вант-Гоффа», которое в 19 в. сформулировал голландский химик Якоб Вант-Гофф. Это чисто эмпирическое правило, т.е. правило, основанное не на теории, а выведенное из опытных данных. В соответствии с этим правилом, повышение температуры на 10° приводит к увеличению скорости в 2–4 раза. Математически эту зависимость можно выразить уравнением v2v1 = g (T2 – T 1 )/10 , где v1 и v2– скорости реакции при температурах Т1 и Т2; величина g называется температурным коэффициентом реакции. Например, если g = 2, то при Т2– Т1 = 50 о v2/v1 = 2 5 = 32, т.е. реакция ускорилась в 32 раза, причем это ускорение никак не зависит от абсолютных величин Т1 и Т2, а только от их разности.
Однако из уравнения Аррениуса следует, что температурный коэффициент реакции зависит как от энергии активации, так и от абсолютной температуры. Для данной реакции с определенным значением Еа ускорение при повышении температуры на 10° будет тем больше, чем ниже температура. Это почти очевидно и без расчетов: повышение температуры от 0 до 10° С должно сказаться на скорости реакции значительно сильнее, чем такое же повышение температуры, например, от 500 до 510° С.
С другой стороны, для данного температурного интервала ускорение реакции будет тем сильнее, чем больше ее энергия активации. Так, если энергия активации реакции мала, то такая реакция идет очень быстро, и при повышении температуры на 10° С ее скорость почти не изменяется. Для таких реакций температурный коэффициент намного меньше 2. Для реакций же с большой энергией активации, которые при невысоких температурах идут медленно, ускорение при повышении температуры на 10° С может значительно превысить 4-кратное.
Например, реакция диоксида углерода со щелочным раствором с образованием гидрокарбонат-иона (СО2 + ОН® НСО3 – ) имеет энергию активации 38,2 кДж/моль, поэтому при повышении температуры, например, от 50 до 60° С эта реакция ускорится всего в 1,5 раза. В то же время реакция распада этилбромида на этилен и бромоводород (С2Н5Вr ® С2Н4 + НВr) с энергией активации 218 кДж/моль ускорится при повышении температуры от 100 до 110 o С в 6,3 раза (правда, в этом интервале температур реакция идет очень медленно). Кинетика реакции атомов водорода с этаном H + C2H6 ® H2 + C2H5 была изучены в широком температурном интервале – от 300 до 1100 К (27–827° С). Для этой реакции Eа = 40,6 кДж/моль. Следовательно, повышение температуры на 10° вызовет увеличение скорости реакции в 1,7 раза в интервале 300–310 K и только в 1,04 раза в интервале 1090–1100 K. Так что при высоких температурах скорость этой реакции практически не зависит от температуры. А для реакции присоединения атома водорода к двойной связи H + C2H4 ® C2H5 энергия активации мала (Eа = 3,4 кДж/моль, так что ее скорость слабо зависит от температуры в широком температурном интервале. И только при температурах намного ниже 0° С начинает сказываться наличие активационного барьера.
Подобных примеров можно привести множество. Очевидно, что правило Вант-Гоффа противоречит не только уравнению Аррениуса, но и многим экспериментальным данным. Откуда же оно взялось и почему нередко выполняется?
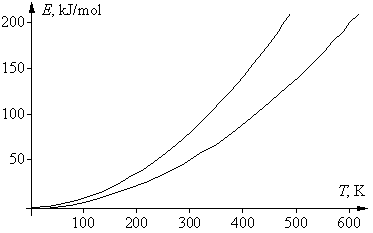
Если в приведенном выше математическом выражении для правила Вант-Гоффа подставить вместо скоростей v1 и v2 для данной реакции их зависимости от температуры, в соответствии с уравнением Аррениуса, то после сокращения предэкспоненциальных множителей получим следующее выражение: g = vT +10/vT = е –Е а/R(Т+10)/е –Е а/RТ = е (Еа/R)[1/Т – 1/(T+10)] . Логарифмироване этого уравнения дает: lng = (Eа/R)[1/T – 1/(T + 10)], откуда Еа = Rlng T(T + 10)/10 = 0,83lngT(T + 10). Энергия активации не является функцией температуры, эта зависимость нужна лишь для удобства последующего анализа. Последнее уравнение – это уравнение параболы, в котором физический смысл имеют только положительные значения. Соответствующая диаграмма ограничена двумя ветвями параболы: при g = 2 получаем Еа = 0,58Т(Т + 10), при g = 4 получаем Еа = 1,16Т(Т + 10). К тем же формулам приходим и при использовании десятичных логарифмов. Соответствующие графики двух парабол, для значений g 2 и 4, приведены на рисунке. Их физический смысл заключается в том, что области выполнения правила Вант-Гоффа соответствует только область между параболами. Таким образом, существуют только определенные соотношения между энергией активации реакции и температурой ее проведения, при которых правило Вант-Гоффа выполняется. Ниже нижней ветви температурный коэффициент g 4.
Если посмотреть, какие реакции «укладываются» в указанную довольно узкую область, то окажется, что все эти реакции идут не слишком быстро и не слишком медленно, а с удобной для измерения (при данной температуре) скоростью. Скорость только таких реакций и могли изучать химики во времена Вант-Гоффа. Например, если энергия активации была невелика (меньше 50 кДж/моль), то такая реакция при комнатной температуре заканчивалась за 1–2 секунды; поэтому для изучения ее кинетики следовало значительно понизить температуру, чтобы реакция проходила не быстрее, чем за 10–20 минут. Только в этом случае химики 19 в. успевали отбирать пробы по ходу реакции и анализировать изменение в них концентрации реагентов. Других способов изучения скорости реакции в то время не было. Если это не удавалось (например, водный раствор замерзал), то скорость такой реакции не изучали. Если же энергия активации реакции была велика и при комнатной температуре она шла слишком медленно (многие сутки, или даже недели), то температуру повышали, чтобы реакция шла с удобной для измерения скоростью. И здесь были свои ограничения – например, раствор мог закипеть, т.е. в любом случае исследователи фактически «подстраивали» изучаемую реакцию под область между двумя параболами.
Сейчас химики имеют возможность с помощью различных приборов экспериментально изучать и очень быстрые (идущие в микросекундной области), и очень медленные реакции, для которых температурный коэффициент может быть значительно меньше 2 или значительно больше 4. Поэтому правило Вант-Гоффа, которое, в отличие от уравнения Аррениуса, не имеет четкого физического смысла, представляет лишь чисто исторический интерес и в современной науке не используется. В подавляющем большинстве учебников и монографий по химической кинетике, а также в 5-томной Химической Энциклопедии это правило даже не упоминается. И, тем не менее, если изучаемая реакция идет с удобной для измерения скоростью, например, заканчивается за 30–40 мин, а энергия активации ее еще не измерена, то для предварительной грубой оценки зависимости скорости такой реакции от температуры можно использовать правило Вант-Гоффа. Поэтому это правило приводится во всех школьных учебниках химии.
http://www.trotted.narod.ru/physchem/23.htm
http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/VANT-GOFFA_PRAVILO.html