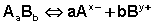Изотонический коэффициент в растворах электролитов и неэлектролитов
В данной статье будет рассмотрено понятие изотонического коэффициента Вант-Гоффа, его значение в неорганичекой химии. Будет названа его формула и перечислены различные составные данной величины, определяющей принципы действий каких-либо веществ при смешивании друг с другом и добавлении в растворы. А также упомянуты будут значение физического характера и воздействия факторов внешних условий на значение этой коэффициента.
Знакомство с понятием
Изотонический коэффициент, иногда называемый фактором Вант-Гоффа, является параметром безразмерной величины, который дает исчерпывающую характеристику поведения любых веществ в растворе. В численном выражении он равен значению некоторой составной свойства коллигативного раствора конкретного исследуемого соединения к явлению такой же коллигативной характеристики неэлектролитического раствора, имеющего ту же концентрацию и неизменные системные или иные параметры.
Такое понятие, как изотонический коэффициент, ввел в XIX веке Якоб Вант-Гофф, за что позже был удостоен Нобелевской премии по химии. Также этим ученым было введено в науку правило, названное его именем.
Суть коэффициента
Оба коллигативных параметра дают четкую характеристику данного параметра и четко определяют его смысл и суть. Зависят же эти характеристики от концентрации частичек вещества, которое было растворено, в самом растворе. Молекулы неэлектролитов, все по отдельности, образуют только по одной частичке в созданном растворе, а объясняется это тем, что процесс диссоциации неэлектролитов в растворе не происходит.
В тоже время влияние сольватации принуждает электролиты в р-ре целиком или частично распадаться на катионы и анионы, создавая в ходе этого процесса несколько частичек на единичную молекулу, подвергшуюся диссоциации. Из этого следует, что аддитивная величина или, иными словами, свойства коллигативного характера исследуемого р-ра, будут зависеть от количества содержащихся ионов всех типов в нем. Такие ионы будут частицами, что образовались в р-ре в результате протекания диссоциации изначально содержащихся молекул. Данный р-р представляется в виде смеси р-ров, составленных из каждого, отдельного типа частичек.
Примером тому служит р-р извести хлорной, содержащий 3 вида частиц – гипохлориты анионов, хлоридные анионы и катионы кальция. В общем понимании изотонический коэффициент Вант Гоффа позволяет нам узнать, на сколько же частичек находящихся в р-ре электролита, больше, чем в растворе неэлектролита, имеющего аналогичные показатели концентрации. Связан этот к-т со свойством вещества, распадающегося в р-ре, образовывать различного рода катионы и анионы, то есть он показывает степень происходящей диссоциации.
В случае, когда молекула или формульная единица заключает в себе n ионов либо атомов в р-рах с полярным типом связи, количество изначально взятых молекул будет равно N, в свою очередь α будет указывать уровень проявления диссоциации в соединении, и из этого понятно, что N·α. Таким образом, суммарная величина частичек в р-ре вычисляется по формуле – ((N – N·α) + N·α·n).
Нахождение в сильных электролитических растворах
Сильные электролиты в результате диссоциации распадаются практически на 100%, и из-за этого можно решить что, изотонический к-т будет равняться ионному количеству на одну формульную единицу или молекулу, но это не так. В реальности показатель будет меньше того, что был определен по формуле. Данное явление объясняется теорией сильных электролитов, созданной П. Дебаем совместно с Э. Хюккелем в 1923 году. Из этой теории следует, что движение ионов в р-ре будет затрудняться вследствие образования оболочки сольватации. К этому добавляем фактор взаимодействия ионов друг с другом, ведь разноименные частицы будут притягиваться, а одноименные – отталкиваться. Таким образом, взаимное притяжение создаст группы ионов, которые будут передвигаться в толще р-ра друг с другом. Группы таких ионов называются ассоциативными, или парными. В результате такого явления р-р начинает себя вести, словно он содержит меньшее количество частичек, чем есть на самом деле, что объясняется ограничением свободы их перемещения.
Физическая роль коэффициента
К-т Вант-Гоффа кроет в себе значение не только для химии. Физический смысл изотонического коэффициента заключен в учете увеличения количества частичек в р-ре электролитического характера по сравнению с р-ром неэлектролитической природы и аналогичного уровня концентрации.
Внешнее влияние на значение коэффициента
Изотонический коэффициент может изменяться под влиянием факторов различной природы внешнего характера. Например, ионное взаимодействие будет уменьшаться, если температуру раствора повысить (связано с возрастанием теплового движения частиц), или уменьшить концентрацию заряженных частиц путем разбавления р-ра (вследствие уменьшения шанса встречи пары частиц). Если мы будем экстраполировать уровень разбавления, приближая его к бесконечности, то увидим что к-т i пытается набрать свое максимальное значение, которое определяется при помощи формулы растворенных соединений.
Заключение
Итак, мы видим что данная безразмерная величина, представленная в виде изотонического к-та, является характеристикой растворов, а именно: объясняет суть того или иного поведения вещества в растворе, позволяет определять степень диссоциации растворов электролитической и неэлектролитической природы и делать расчет соотношения частичек (ионов) в подобных растворах в сравнении друг с другом.
Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
где C — молярная концентрация раствора, моль/м 3 ,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Уравнение вант гоффа изотонический коэффициент
Кафедра физической и коллоидной химии ЮФУ
Материалы к лекциям для студентов химфака
Растворы электролитов. Теория электролитической диссоциации
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов . Для учета этих отклонений Вант-Гофф внес в уравнение (35) для растворов электролитов поправку – изотонический коэффициент :
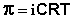
Аналогичная поправка вносится в законы Рауля и изотонический коэффициент определяется следующим образом:
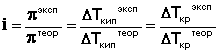
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает и стремится к некоторому целочисленному значению. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания и осмотическое давление для них всегда больше, чем вычисленные. Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации , основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α , которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул растворённого вещества N:
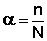
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные ( α ≥ 0.7), средней силы (0.3 α α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Слабые электролиты. Константа диссоциации.
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации . Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
константа диссоциации выразится следующим соотношением:
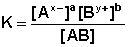
Для бинарного (распадающегося на два иона) электролита выражение (40) можно переписать в следующем виде:
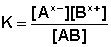
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (41) в этом случае можно записать следующим образом:
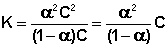
Для растворов слабых электролитов можно считать, что (1 – α ) приближённо равно 1. Тогда получаем:
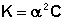
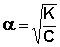
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (44) называют законом разбавления Оствальда . Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав ν n ионов ( ν – число ионов, образующихся при диссоциации молекулы). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
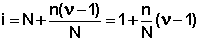
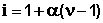
Соотношение (46) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита:
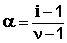
Copyright © С. И. Левченков, 2005.
http://zadachi-po-khimii.ru/obshaya-himiya/kolligativnye-svojstva-rastvorov.html
http://physchem.chimfak.sfedu.ru/Source/Phys/physchem_38.htm