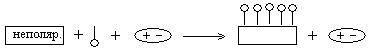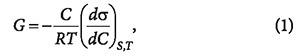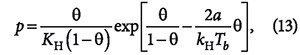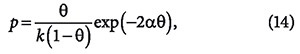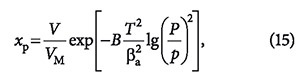Адсорбция на твердых сорбентах
Характерной особенностью твердых сорбентов является их пористость. Поглощение веществ на твердой поверхности значительно выше, чем на жидкой, т.к. на твердых сорбентах идет поглощение не только в поверхностных слоях, но и во внутренних.
При рассмотрении адсорбции из раствора на твердом теле принято различать два случая:
— адсорбцию неэлектролитов, когда адсорбируются молекулы адсорбтива — молекулярная адсорбция;
— адсорбцию электролитов, когда избирательно адсорбируется один из ионов электролита – ионная адсорбция.
3.1. Молекулярная адсорбция из растворов
Адсорбция на твердых сорбентах описывается теорией Лэнгмюра, основные положения которой сводятся к следую-щему:
— адсорбция происходит не на всей поверхности сорбента, а только на адсорбционных центрах – вершинах неровностей и узких порах;
— каждый адсорбционный центр может удерживать только одну молекулу сорбируемого вещества, что приводит к образованию мономолекулярного слоя;
— процесс адсорбции обратим и носит динамический характер, т.е. одновременно с адсорбцией происходит десорбция (удаление вещества с поверхностного слоя).
Лэнгмюром было предложено уравнение для расчета величины адсорбции на твердом сорбенте.


Г (моль/г, моль/м 2 ) – величина адсорбции;
Г∞ – предельная адсорбция, соответствующая образованию насыщенного мономолекулярного слоя на поверхности сорбента;
С – концентрация поглощаемого вещества (сорбтива), моль/м 3 , моль/л;
Р – парциальное давление газа;
В – константа сорбционного равновесия.
Уравнению Лэнгмюра соответствует изотерма адсорбции.
Изотерма – измерения проведены при постоянной температуре.
Г∞ — определяется экспериментально по изотерме Лэнгмюра.
Адсорбция на границе твердое тело – газ и твердое тело – раствор схожи по своей природе. Но при адсорбции из раствора явление сильно усложняется наличием третьего компонента – растворителя (среды), молекулы которого могут также адсорбироваться на поверхности адсорбента и, следовательно, являются конкурентами молекул адсорбтива. Т.о. адсорбция на границе раздела твердое тело – раствор – это адсорбция из смеси веществ, кроме того, необходимо учитывать взаимодействие молекул адсорбтива с молекулами растворителя.
Величина адсорбции зависит от следующих факторов:
— концентрации растворенного вещества — описывается уравнением Лэнгмюра;
— температуры – с повышением температуры адсорбция из раствора уменьшается, это связано с повышением растворимости сорбтива в данном растворе.
Влияние природы адсорбента
На адсорбцию из растворов сильно влияют полярность и пористость адсорбента. Адсорбенты делятся на:
• полярные: СаСО3 (мел), силикогель xSiO2·yH2O, глина, цеолиты;
• неполярные: С (активированный уголь), сажа, тальк.
Адсорбция протекает по правилу: подобное адсорбируется на подобном – полярные сорбенты хорошо адсорбируют полярные вещества, а неполярные сорбенты – неполярные вещества. В схемах адсорбции адсорбент изображается С СаСО3.
Влияние природы сорбтива
По своей природе сорбтивы также делятся на:
• полярные – это электролиты – о;
• неполярные – УВ: ароматические, алифатические – | ;
• 

Влияние природы растворителя
Адсорбируемость одного и того же адсорбтива сильно зависит от полярности адсорбента и среды. При этом можно исходить из правила уравнивания полярностей, сформулированного Ребиндером. Адсорбция растворенного вещества наступает в том случае, если значения полярности адсорбтива лежит между значениями полярностей адсорбента и растворителя. Из правила уравнивания полярностей вытекает, что чем больше разность полярностей между адсорбтивом и растворителем, т.е. чем меньше растворимость вещества, тем лучше оно будет адсорбироваться.
Растворители по своей природе делятся на:
— полярные – вода
— неполярные (бензол, УВ) –
— дифильные (спирт) –
о тдельные случаи адсорбции
1. Адсорбция дифильного вещества из неполярного растворителя на полярном адсорбенте.
Схема адсорбции:
Адсорбция полная, схема подчиняется правилу Ребиндера.
2. Адсорбция дифильного вещества из полярного растворителя на неполярном сорбенте.
Схема адсорбции:
Адсорбция полная, схема подчиняется правилу Ребиндера.


Чем лучше среда растворяет адсорбтив, тем хуже в этой среде идет адсорбция. Чем выше сродство между растворителем и сорбтивом, тем хуже сорбтив поглощается на твердом сорбенте, удерживаясь в растворителе в виде прочного сольвата.
Молекулярная адсорбция из раствора широко используется в медицинской практике. Так, при отравлениях обычно используется активированный уголь, адсорбирующий газы, алкалоиды, барбитураты, токсины из пищеварительной системы. в санитарно-гигиенической практике молекулярная адсорбция используется для очистки питьевой воды и сточных вод промышленных предприятий.
3.2. Ионная адсорбция
В зависимости от природы сорбента процесс адсорбции ионов электролита представлен двумя видами: ионной избирательной адсорбцией и ионообменной адсорбцией.
Механизм ионной адсорбции – электростатический за счет сродства между полярным сорбентом и ионами сорбтива. На величину ионной адсорбции оказывают влияние знак заряда иона и плотность заряда на поверхности гидратированного иона. Плотность заряда иона растет с повышением величины заряда иона и с уменьшением радиуса гидратированного иона. Избирательная ионная адсорбция подчиняется правилу Панета-Фаянса:
1. На поверхности твердого полярного сорбента преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки сорбента или близкие к ним по природе и свойствам.
2. На заряженной поверхности сорбента могут дополнительно сорбироваться противоположные по знаку ионы.
Приведем пример: рассмотрим адсорбцию из водного раствора ВаС12 на поверхности полярного сорбента – BaSO4;
схема адсорбции: ВаС12 р-р → Ва 2+ + 2С1 —
При ионообменной адсорбции ионы растворенного электролита эквивалентно обмениваются на ионы того же знака заряда из сорбента. Сорбенты в данном случае получили название ионообменников (ионитов).
Если сорбент способен к обмену катионов, то он называется катионитом (R-H, R-Na, R-K); если он обменивается анионами, то называется анионитом (R-OH, R-Cl и др.).
Способность ионита к обмену зависит от структуры ионита и свойств ионов электролита в растворе. Количественно способность ионитов к обмену оценивается величиной обменной емкости, которая выражается числом моль-экв ионов, которое может обменивать 1 г сухого ионита или 1 см 3 набухшего ионита.
Ионообменная адсорбция является эквивалентным и равновесным процессом и проходит обычно в две стадии:
— поглощение ионов из раствора на ионите;
— десорбция (элюирование) ионов из сорбента с последующим восстановлением структуры сорбента.
Ионообменная адсорбция лежит в основе извлечения ионов электролита из какого-либо раствора. Например, для извлечения Сl — -ионов из мочи используются аниониты, работа которых может быть представлена следующим образом:
1 стадия:
В результате этого процесса рН вытекающей из анионита жидкости будет больше 7 (щелочная среда).
Для извлечения сорбированных анионитом С1 — -ионов через колонку с сорбентом пропускают раствор натриевой щелочи – ионы ОН — вытесняют С1 — -ионы. Последние обнаруживаются в вытекающей жидкости, называемой элюатом, с помощью качественной реакции с нитратом серебра: Ag + + Cl — = AgCl↓ — белый творожистый осадок.
О процессе адсорбции на твердых адсорбентах
Адсорбцию применяют при очистке воды от органических и хлорорганических соединений, нефтепродуктов, аммиака и поверхностно-активных веществ при низких концентрациях загрязнений на стадии глубокой очистки. В статье рассмотрены основные математические модели адсорбции на твердых адсорбентах. Изучены теоретические аспекты процесса адсорбции из воды органических веществ на твердых адсорбентах. Приведен расчет аппаратов для проведения адсорбции, а также даны их основные технические характеристики.
Адсорбцией называется поглощение загрязнений поверхностью твердого адсорбента, осуществляемое за счет взаимодействия молекул загрязнителей с поверхностью адсорбента и последующей диффузии молекул веществ через пленку, окружающую частицы адсорбента, к его поверхности, скорость которой определяется строением адсорбента, наличием пор и размером молекул сорбируемого вещества. Лучшими сорбентами для удаления из воды растворенных органических веществ признаны активированные угли различных марок, получаемые в результате пиролиза твердых древесных и каменноугольных материалов, эффективность которых определяется наличием в них микропор, а также цеолиты, представляющие собой алюмосиликаты натрия, калия или других элементов.
Адсорбция — процесс увеличение концентрации растворенного вещества у поверхности раздела двух фаз («твердая фаза-жидкость», «конденсированная фаза-газ») вследствие некомпенсированных сил межмолекулярного взаимодействия на границе разделе фаз. Процесс, обратный адсорбции, называется десорбцией.
Адсорбция является частным случаем сорбции — поглощения загрязнений поверхностью твердого тела, которая происходит за счет диффузии молекул органических веществ через жидкостную пленку, окружающую частицы сорбента, к его поверхности и далее внутренней диффузии молекул, скорость которой определяется строением сорбента, наличием в нем пор и размером молекул сорбируемого вещества [1].
Причина адсорбции—нескомпенсированные специфические межмолекулярные силы и ван-дер-ваальсовые взаимодействия вблизи поверхности, что свидетельствует о наличии адсорбционного силового поля. Твердое вещество, создающее такое поле, называется адсорбентом, вещество, молекулы которого адсорбируются — адсорбтивом, а адсорбированное вещество — адсорбатом. Если в состав адсорбента входят ионы или поверхностные функциональные группы, способные к ионизации, то между адсорбентом и водным раствором электролита происходит ионный обмен. Адсорбент в данном случае обозначается «ионитом».
Адсорбция на границе «твердое теложидкость» сложна из-за физической неоднородности поверхности твердых тел, наличия дефектов поверхности — трещин, дислокаций, выходом разных граней кристалла на поверхность и др.
Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления
На эффективность протекания адсорбционных процессов оказывают влияние химическая природа и пористая структура адсорбента, состав и концентрация функциональных групп на его поверхности, химическая природа адсорбата, условия организации взаимодействия в системе «адсорбент-адсорбат», которое может протекать как в статических, так и динамических режимах. Последнее в значительной степени определяет аппаратурное оформление адсорбционных процессов.
Различают физическую и химическую адсорбцию (хемосорбцию). При физической адсорбции молекулы адсорбента и адсорбтива не вступают в химическое взаимодействие, между ними формируются межмолекулярные электростатические силы («ван-дер-ваальсовые взаимодействия») — между ионами, диполями или квадруполями; при этом адсорбция определяется химической природой молекул адсорбтива (специфическая адсорбция) [2]. Значительную роль при адсорбции играет также геометрия поверхности раздела фаз: в случае плоской поверхности происходит адсорбция на открытой поверхности, в случае слабо или сильно искривленной поверхности — адсорбция в порах адсорбента. При хемосорбции происходит химическое взаимодействие молекул поглощаемого вещества с адсорбентом, когда формируются химические валентные связи.
Физическая адсорбция обратима, а хемосорбция может быть необратимой. Отличительные признаки хемосорбции — необратимость процесса, высокие тепловые эффекты (сотни кДж/моль) и активированный характер, закономерности химических реакций (осуществляется со значительной энергией активации), экзотермический или эндотермический эффект реакции, с повышением температуры ее скорость возрастает по закону Аррениуса и др. [3].
Физическая адсорбция — это процесс экзотермический, то есть протекает с выделением тепла. Между физической и химической адсорбцией существует множество промежуточных состояний (адсорбция, о бусловленная о браз ованием водородных связей). Возможны различные типы физической адсорбции и проявление дисперсионных межмолекулярных сил притяжения, поскольку они приблизительно постоянны для адсорбентов с поверхностью любой химической природы («неспецифическая адсорбция»).
Адсорбция сопровождается уменьшением давления пара поглощаемого вещества в исходной смеси и выделением теплоты. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления [4]. Понижение давления и повышение температуры способствуют обратному процессу — десорбции. Количество выделяющейся при адсорбции теплоты [кДж/кмоль] определяется экспериментально.
Количественно адсорбция может быть охарактеризована с помощью нескольких величин:
- Величиной α, представляющую собой количество адсорбтива в объеме адсорбционного слоя на единицу массы адсорбента, или количество адсорбтива на единицу поверхности адсорбента. Единицы измерения — моль/г, моль/м 2 .
- Введенной Гибсом величиной Г, представляющей собою избыток числа молей адсорбтива в объеме поверхностного слоя площадью 1 см 2 по сравнению с числом его молей в том же объеме, если бы у межфазной границы не происходило изменение концентрации адсорбтива. При малых концентрациях адсорбтива гибсовская адсорбция Г близка к поверхностной концентрации α, при больших концентрациях адсорбтива величина Г отличается от α.
В случаях же, когда концентрация адсорбтива в поверхностном слое меньше его концентрации в остальном объеме, величина Г является отрицательной величиной, а само подобное явление обозначается так называемой «отрицательной адсорбцией».
Уравнение изотермы адсорбции Гиббса позволяет определять адсорбцию Г (концентрацию адсорбированного вещества, моль/м 2 ) на границе раздела «жидкость-газ» по зависимости σ(С) при Т = const и S = const:
где σ — поверхностное натяжение; C — объемная концентрация адсорбтива; S — величина поверхности границы раздела фаз; T — температура.
Для каждого растворителя существуют вещества, которые снижают поверхностное натяжение: dσ/dC 0. Граница раздела фаз обогащается растворенным веществом, и такие вещества называются поверхностно-активными. Вещества, для которых dσ/dC > 0 и Г 2 .
Зависимости, описываемые уравнениями (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основу их построения положена модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются (локализуются) молекулы адсорбтива; на одном центре адсорбируется только одна молекула, то есть при адсорбции образуется только один адсорбционный слой (монослой); адсорбция на данном центре не влияет на адсорбцию на других центрах, то есть взаимодействием адсорбированных молекул можно пренебречь.
На основании химической термодинамики получены конкретные выражения изотерм адсорбции, называемые изотермами Ленгмюра-Фрейндлиха:
где xp — концентрация поглощенного адсорбентом вещества (емкость адсорбента), кг на 1 кг адсорбента; a — предельная концентрация поглощенного компонента в адсорбенте, достигаемая при p/ps = 1 (ps — давление насыщенного пара при заданной температуре); b — адсорбционный коэффициент, обратный константе равновесия Кр -1 ; k и n — эмпирические константы и показатель степени, зависящие от природы адсорбента, адсорбируемого вещества и температуры, определяемые опытным путем; р — равновесное давление адсорбента в парогазовой смеси, Н/м 2 .
Зависимости (7) и (8), называются изотермами адсорбции и используются в теоретических расчетах. В основе их построения — модель Ленгмюра: поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются молекулы адсорбтива
Константа равновесия определяется следующим уравнением:
Равновесное давление адсорбента пропорционально р, а концентрация свободных активных центров — величине (ат — а), где ат — полное число активных центров, а — число занятых активных центров. В области очень малых давлений bр = 1 и а = (amb) p, что отвечает уравнению Генри, в котором Кн = атb (ат — поверхностная концентрация адсорбтива при заполнении им всех активных центров). В области очень больших давлений (bр ≥ 1 и а ≈ ат) адсорбция перестает зависеть от давления. При очень малых заполнениях поверхности адсорбента уравнение изотермы адсорбции приобретает вид уравнения Генри:
где Кн — коэффициент Генри.
Вид изотерм адсорбции зависит от множества следующих факторов: удельной площади поверхности адсорбента, объема пор, структуры адсорбента, поглощаемого вещества и его свойств, а также от температуры.
На рис. 1 показаны пять основных типов изотерм адсорбции. Тип 1 характерен для микропористых адсорбентов. Начальные выпуклые участки изотерм типов 2 и 4 определяются наличием микропор. Дальнейшую форму изотерм определяют полимолекулярная адсорбция и капиллярная конденсация.
Вогнутые участки на изотермах 3 и 5 характерны для систем «адсорбент-адсорбтив», когда силы взаимодействия молекул адсорбтива с адсорбентом меньше сил межмолекулярного взаимодействия между молекулами адсорбтива.
Существуют различные математические модели адсорбции — мономолекулярная адсорбция, полимолекулярная адсорбция, капиллярная конденсация, каждая из которых описывает экспериментальные данные, полученные в определенных условиях.
В теорию полимолекулярной адсорбции, которая постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое, является центром для молекул, образующих второй слой, и т.д. Большой вклад внес Я. де Бур [5], экспериментально показавший, что зависимость среднего числа слоев на всех поверхностях, близких по химической природе, от p/ps выражается универсальной кривой (так называемой «t-кривой»). Это позволяет оценивать площади поверхности адсорбтивов.
Предпринимались попытки учесть в модели Ленгмюра также взаимодействия между адсорбированными молекулами. Так, Т. Хилл и Я. де Бур, предположив, что уравнение состояния адсорбционного слоя является двухмерным аналогом уравнения Ван-дер-Ваальса, получили уравнение изотермы адсорбции:
где θ = а/ат (а и b — константы уравнения Ван-дер-Ваальса). В свою очередь, Фаулер и Э. Гуггенгейм, учитывая взаимодействие адсорбированных молекул, вывели уравнение:
где α — константа, связанная с парным взаимодействием молекул.
Принципиально отличную модель адсорбции (потенциальная адсорбция), предложил М. Поляни [6]. Согласно этой модели, вблизи поверхности адсорбента формируется потенциальное адсорбционное силовое поле, убывающее с расстоянием от поверхности. Вследствие этого давление адсорбтива, равное p вдали от поверхности, вблизи нее возрастает и на некотором расстоянии достигает значения ps, при котором адсорбтив конденсируется.
Объем слоя между поверхностью раздела и геометрическим местом точек, в которых р = ps, заполнен жидкостью, которая характеризуется нормальными значениями физических свойств объемной жидкости.
Обратимая изотермическая работа адсорбционных сил выражается уравнением ε = RT ln(p/ps), и обозначается адсорбционным потенциалом. При заданной величине объема V адсорбционного слоя потенциал е не зависит от температуры (вследствие независимости дисперсионных сил от температуры). Такая температурная инвариантность дает возможность пересчитывать адсорбцию с одной температуры на другую, хотя уравнения изотермы адсорбции на основе излагаемой теории получить не удалось.
Принято различать молекулярную, кнудсеновскую и поверхностную диффузии. Молекулярная диффузия осуществляется, если длина свободного пробега молекул в порах адсорбента меньше размера пор, кнудсеновская — если эта длина превышает размер пор
Советским физико-химиком М.М. Дубининым [7] разработана теория объемного заполнения пор (ТОЗП) и получены уравнения адсорбции для газов и паров для широкого диапазона температур, характеризующие зависимость равновесной концентрации адсорбтива от структуры пор адсорбента. Эти уравнения имеют сложный характер и применимы только к микропористым сорбентам с размерами пор ≤ 1 нм:
где V — суммарный объем пор адсорбента; VM — объем адсорбированного вещества в жидком состоянии; В — константа, определяемая структурой адсорбента; Т — абсолютная температура пара; βа — коэффициент аффинности, равный отношению мольных объемов в жидком состоянии в порах данного вещества и стандартного; Р — давление насыщаемого пара адсорбтива; р — парциальное давление пара адсорбтива при температуре адсорбции.
Кроме вышеописанных, существует еще один механизм, приводящий к дополнительной адсорбции адсорбтивов ниже их критической температуры на пористых адсорбентах, — капиллярная конденсация [8]. Этот тип адсорбции обусловлен наличием у адсорбента мелких пор. Пары адсорбата в данном случае конденсируются в таких порах при давлениях, меньших давления насыщенного пара ps над плоской поверхностью, вследствие образования в капиллярах вогнутых менисков.
Лекция №3 «Адсорбция на неподвижной поверхности раздела фаз»
Лекция №3 «Адсорбция на неподвижной поверхности раздела фаз»
При адсорбции веществ на поверхности твёрдых адсорбентов изменяется химический состав поверхности адсорбента. Количественной характеристикой этого процесса является величинаудельной адсорбции Г. Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы адсорбента.
В качестве адсорбентов обычно применяют мелкоизмельченные вещества или пористые тела, что обеспечивает большую площадь поверхности раздела фаз, которую определить практически невозможно. Поэтому удельная адсорбция для твердых адсорбентов преимущественно выражается в молях поглощенного вещества на единицу массы адсорбента:
Г =
где n –количество адсорбата, моль; m – масса адсорбента, г.
Адсорбция газов и паров адсорбата на твердых адсорбентах – процесс, протекающий за счет сил Ван-дер-Ваальса и водородных связей. Количество поглощенного газа или пара на твёрдых поверхностях зависит от следующих факторов.
От свободной поверхностной энергии адсорбента. Она весьма велика у адсорбентов с аморфной структурой (активированный уголь) и у кристаллических веществ (оксиды алюминия, кремния). Адсорбент тем эффективнее, чем меньше измельчен. От сродства адсорбтива к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные на неполярных. Чем больше адсорбент склонен к межмолекулярным взаимодействиям, тем интенсивнее идет адсорбция. При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям. От концентрации адсорбата. Зависимость имеет сложный характер, так как с адсорбцией идет одновременно процесс десорбции. При равенстве скоростей этих процессов наступает равновесие.
Теория мономолекулярной адсорбции Ленгмюра. Уравнение Ленгмюра
Изучая адсорбцию на твердых поверхностях Ленгмюр предложил теорию мономолекулярной адсорбции и уравнение адсорбции.
Основные положения теории Ленгмюра следующие:
Адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где имеются участки с наиболее нескомпенсированными силовыми полями; Каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества; Процесс адсорбции обратим и носит динамический характер, т. к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции:
Г =
Где Г∞- значение предельной адсорбции; с – равновесная концентрация адсорбента в системе; К – константа адсорбционного равновесия.
Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:
На кривой четко видны три участка:
I — ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞·Кс, т. е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата.
III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой).
II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра.
Существует еще одно уравнение, описывающее изотерму адсорбции, называемое уравнением Г. Фрёйндлиха(1906):
А= kС1/nилиА= kp1/n
где k и 1/n – константы. (Константа, являющаяся показателем степени, обычно записывается в виде 1/n, а не n, чтобы подчеркнуть, что равновесная концентрация или равновесное давление возводится в степень, которая всегда бывает меньше единицы).
Уравнение Фрёйндлиха является эмпирическим, т. е. за ним не стоит строгой теории. Оно было выбрано среди других уравнений как уравнение параболы, по виду напоминающей изотерму адсорбции. Поэтому теоретическая изотерма, построенная с его помощью, совпадает с экспериментальной только в области средних концентраций. В области же малых и, в особенности, очень больших концентраций (давлений) наблюдаются значительные расхождения между экспериментом и теоретически предсказанными величинами адсорбции. Однако в практической деятельности редко приходится иметь дело с такими областями концентраций. Поэтому уравнение Фрёйндлиха в силу его простоты и лёгкости определения констант, используется очень широко. Особенно часто его используют при исследовании адсорбции на пористых и порошкообразных адсорбентах.
Уравнение Фрейндлиха линеаризуется с помощью логарифмирования:
lgA = lgk + 1/nklgC
или. lgA= lgk+1/ nklgp
С учётом этого для графического определения констант по нескольким экспериментальным данным строится логарифмическая изотерма адсорбции в координатах lgA — lgC или, соответственно lgA — lgр(рис.). В этом случае график при экстраполяции отсекает от оси ординат отрезок ОМ, равный lgk (т. е. k = 100М), а тангенс угла наклона его к оси абсцисс равен 1/n.
Рисунок – Графическое определение констант уравнения Фрёйндлиха
Основы теории полимолекулярной адсорбции
Уравнение Ленгмюра даёт хорошие результаты при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это происходит при хемосорбции и при физической адсорбции газов при небольших давлениях и температуре выше критической (отсутствует конденсация на поверхности адсорбента).
Опыт показал, что, если адсорбция протекает с образованием полимолекулярного адсорбционного слоя, то изотерма отличается от ленгмюровской и имеет более сложный вид. Такие изотермы называют S-изотермы, так как адсорбция не останавливается на образовании монослоя. Возможность образования полимолекулярных адсорбционных слоёв рассматривается в теории Поляни. Эта теория допускает существование на поверхности твёрдых адсорбентах адсорбционных сил, действующих на расстоянии, значительно превышающих диаметр молекул адсорбата.
Основные положения теории Поляни следующие:
1. Адсорбция создаётся чисто физическими силами.
2. На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи от поверхности адсорбента, образуя непрерывное силовое поле.
3. Силовое поле, обусловливающее адсорбцию, действует на расстояния, которые больше, чем размеры отдельных молекул адсорбата. Иначе говоря, у поверхности адсорбента существует так называемый адсорбционный объём, который заполняется при адсорбции молекулами адсорбата.
4. Притяжение молекул адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объёме других молекул. Поэтому идёт полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры, поэтому с изменением температуры адсорбционный объём не изменяется.
Теория Поляни не дала математического выражения изотермы адсорбции. Однако представления Поляни легли в основу современной теории адсорбции, которую создали С. Брунауэр, П. Эммет и Е. Теллер. Поэтому сокращённо эту теорию называют теорией БЭТ.
Теория постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое является центром для молекул, образующих второй слой, и т. д.
Основные положения теории БЭТ:
1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношёнии активных центров, способных удерживать молекулы адсорбтива.
2. Для упрощения взаимодействием соседних адсорбированных молекул в первом и последующих слоях пренебрегают.
3. Каждая молекула первого слоя представляет собой возможный центр для адсорбции и образования второго адсорбционного слоя; каждая молекула второго слоя является возможным центром адсорбции в третьем и т. д.
4. Предполагается, что все молекулы во втором и более далеких слоях имеют такую же сумму статистических состояний, как в жидком состоянии (в общем отличающуюся от суммы состояний слоя).
Авторы этой теории вывели уравнение
ГдеР0– упругость насыщенного пара, V — объём адсорбированного газа при данном давлении газаР;VM– объём адсорбированного газа в монослое и с =
Уравнение БЭТ получило широкое применение. Из величиныVMможет быть вычислена полная адсорбирующая поверхность адсорбентаS, что имеет важное практическое значение, а из величиныСвычисляется теплота адсорбции газа в монослое. В качестве примера значений площадиSукажем, что адсорбирующая поверхность 1 г испытанного образца силикагеля составила 500м2, а 1 г коллагена – 350м2.Хорошие адсорбенты обладают весьма значительной удельной поверхностью, например, активированный уголь – до 1000м2/г.
Уравнение БЭТ применялось также для определения удельной поверхности различных аморфных и кристаллических полимеров.
Адсорбция на границе твердое тело – жидкость
Существенным отличием адсорбции веществ из растворов является конкуренция между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Рассматривая этот вид адсорбции, остановимся на следующем:
1.При адсорбции из раствора важным фактором является величина удельной поверхности адсорбента и его сродство к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) -–неполярные вещества.
2.Природа растворителя: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
3.Природа поглощаемого вещества:
а) выполняется правило «подобное взаимодействует с подобным», т. е. должно быть сродство между адсорбентом и адсорбтивом;
б) Выполняется правило Шилова:
Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
в) правило Ребиндера (правило уравнивания полярностей Ребиндера):
На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причём с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает
Эффективней всего адсорбируются молекулы веществ, имеющих дифильноестроение. В этом случае идёт эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент молекулы обращен всегда к полярной фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе – активированному углю, маслу.
4.Влияние концентрации растворенного вещества на процесс адсорбции при постояннойТописывается уравнением Ленгмюра.
5.Повышение температуры снижает эффективность адсорбции. Это объясняется ослаблением взаимодействия между адсорбентом и адсорбатом.
Молекулярная адсорбция из растворов на твердом адсорбенте широко используется в медицинской практике. Активированный уголь хорошо адсорбирует газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2.
Адсорбция растворённого в жидкости вещества на твёрдом адсорбенте
Различают молекулярную и ионную адсорбцию.
Молекулярная адсорбция– это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твёрдого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворённым веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворённого вещества его молекулы должны вытеснять с поверхности молекулы растворителя.
Экспериментально величину адсорбции «а» изучают измеряя молярную концентрацию раствора до контакта с адсорбентом (с0) и после наступления адсорбционного равновесия (сs)

а– количество адсорбированного вещества, приходящееся на 1 г адсорбента;m– масса адсорбента, г:V– объём раствора, из которого идёт адсорбция, л.
На молекулярную адсорбцию влияют:
равновесная концентрация растворённого вещества; природа растворителя; природа адсорбента; природа растворённого вещества; температура, время адсорбции.
Адгезия. Виды адгезии
В гетерогенных системах различают межмолекулярные взаимодействия внутри фаз имежду фазами.
Притяжение друг к другу (сцепление) частиц вещества — атомов, молекул, ионов — внутри одной фазы называется когезией (от лат. cohaesus – связанный, сцепленный). Когезияобусловлена межмолекулярными силами различной природы, а во многих случаях, кроме того, водородными и химическими связями. Она является причиной существования веществ в конденсированном – твёрдом или жидком — состоянии. В газах когезия незначительна; наиболее она выражена в твёрдых телах. Когезия характеризует прочность гомогенного тела по отношению к разрыву и другим деформациям. Преодоление сил когезии при разъединении тела на части требует совершения работы, называемой работой когезииWc. При этом подразумевается, что исследуемое тело не имеет дефектов структуры, например, трещин.
В случае легкоподвижных жидкостей обратимая работа когезии равна удвоенному значению поверхностного натяжения жидкости на границе с воздухом:

Это обстоятельство лежит в основе различных методов определения поверхностного натяжения жидкостей, например, метода отрыва кольца, метода отрыва капли (сталагмометрического), метода продавливания сквозь жидкость пузырьков воздуха.
Сцепление приведённых в контакт разнородных твёрдых или жидких тел (фаз) называется адгезией (от лат. adhaesium — прилипание). Подобно когезии, адгезия может быть обусловлена как межмолекулярным взаимодействием, так и химическими связями, в том числе ионной и металлической. Адгезия обусловливает возникновение между двумя телами соединения определённой прочности (прилипание).
В этом смысле когезию можно рассматривать как частный случай адгезии при соприкосновении двух однородных тел. Величиной, характеризующей удельное усилие разрушения адгезионного контакта является адгезионная прочность, используемая в технике для оценки свойств клеев, лакокрасочных покрытий и др.
В фармации адгезионной прочностью могут быть охарактеризованы, например, способность пластыря, мази или горчичника удерживаться на коже, прочность таблеток, спрессованных из различных порошков, прочность связи оболочек с таблетками и т. п. Количественно адгезионная прочность может быть охарактеризована работой адгезионного отрыва Wa.
При длительном контакте разнородных тел (фаз) может происходить взаимная диффузия веществ, что приводит к размытию адгезионного шва и к увеличению адгезионной прочности.
Смачивание. Растекание
В случае одновременного контакта между твёрдой, жидкой и газовой фазами адгезия неразрывно связана со смачиванием. В качестве газовой фазы чаще всего выступает воздух.
При нанесении небольшой капли жидкости на поверхность твёрдого тела (или другой, более плотной жидкости) можно в зависимости от природы контактирующих фаз наблюдать различные явления. В одних случаях капля растекается по поверхности с образованием очень тонкого, практически плоского слоя (растекание). Растекание обычно наблюдается при соприкосновении веществ с близкой полярностью, например, вода растекается по поверхности стекла или кварца (полярные жидкость и твёрдое тело), бензол – по поверхности воска или парафина (неполярные жидкость и твёрдое тело). Но многие неполярные жидкости, такие, как нефть, минеральные масла, бензин и т. п. могут растекаться по практически любым твёрдым (металлы, дерево, стекло, пластмассы и др.) или жидким (вода) поверхностям независимо от их полярности. Такое растекание объясняется слабым межмолекулярным взаимодействием и, как следствие, низким поверхностным натяжением жидкости.
При отсутствии сродства между жидкостью и твёрдой поверхностью наблюдается полное или практически полное несмачивание, когда маленькие капли жидкости принимают почти сферическую форму. Примером полного несмачивания может служить поведение капель ртути на поверхности большинства твёрдых тел (исключая хорошо амальгамирующиеся металлы).
Кроме полного смачивания или несмачивания возможны многочисленные случаи неполного смачивания, когда капля нанесённой жидкости при установившемся равновесии принимает на поверхности твёрдого тела определённую форму (рис. 2.1).
Рис. 1. Взаимодействие сил, определяющих форму капли
на твёрдой поверхности
В такой системе имеются три различных поверхности раздела фаз: между твёрдым телом и жидкостью (т — ж), твёрдым телом и газом (т — г) и между жидкостью и газом (ж — г) с поверхностными натяжениями утж, утг и ужгсоответственно.
Линия, в которой пересекаются все три поверхности раздела, называется контуром смачивания. Угол между плоскостью смачиваемой поверхности и плоскостью, касательной к поверхности жидкости в одной из точек контура смачивания, называется краевым углом смачивания q.
Краевой угол всегда измеряется со стороны жидкости. На каждую точку контура смачивания действуют три силы: утг, стремящаяся растянуть каплю по поверхности (т. е. уменьшить площадь поверхности «т — г»), утж и ужг, стремящиеся сжать каплю (т. е. уменьшить площадь поверхностей «т — ж» и «ж – г»). Равновесное значение q связано со значением поверхностного натяжения на всех трёх межфазных поверхностях уравнением Т. Юнга:
вытекающим из общего условия равновесия трёх сил:

Из уравнения Юнга видно, что сosq является количественной мерой смачивания. А именно: условие сosq = 1 (q = 0о) отвечает полному смачиванию или растеканию, условие 1 >сosq> 0 (0 о 90о; cosq 0 о причём с увеличением отношения wa / wк смачивание поверхности улучшается.
Поверхности, хорошо смачивающиеся данной жидкостью, являются по отношению к ней лиофильными (в случае воды – гидрофильными), плохо смачивающиеся – лиофобными (соответственно гидрофобными). Так как гидрофобные вещества обычно хорошо смачиваются маслами, их можно назвать также олеофильными. Гидрофильны, например, желатин, крахмал, глины, стекло; олеофильны — парафин, сажа. Кожа человека почти в одинаковой степени смачивается и водой, и маслами, что существенно при высвобождении и всасывании лекарственных веществ из линиментов, мазей, пластырей, примочек и т. п.
В процессе смачивания жидкостью твёрдой или жидкой поверхности выделяется теплота, называемая теплотой смачивания DHсм. (Правильнее эту величину следовало бы называть теплотой адгезии, так как она обусловлена только взаимодействием конденсированных фаз). В большинстве случаев теплота смачивания имеет значения от 0,4 до 40 кДж/м2. Чем больше теплота смачивания твёрдого тела данной жидкостью, тем лучше смачивание. Таким образом, теплота смачивания, как и краевой угол, может служить количественной характеристикой лиофильности твёрдых поверхностей. Для сравнения гидрофильности различных поверхностей часто используется так называемый коэффициент гидрофильности Kгидр, представляющий собой отношение теплот смачивания данной поверхности водой и бензолом:
Для гидрофильных веществ Кгидр> 1 для гидрофобных — Кгидр
http://www.c-o-k.ru/articles/o-processe-adsorbcii-na-tverdyh-adsorbentah
http://pandia.ru/text/80/463/48458.php