Уравнение восстановления бактериями азотфиксаторами молекулярного азота до аммиака
Химизм фиксации молекулярного азота
Химизм фиксации молекулярного азота ещё до конца не изучен. Наиболее изучен химизм симбиотических азотфиксаторов, и еще много неясного у свободноживущих. Механизм биологической азотфиксации бактериями-симбиотиками принципиально не отличается от механизма связывания азота свободноживущими азотфиксаторами. Очевидно, этот процесс осуществляется ферментным комплексом, который аналогичный такому же комплексу у свободноживущих азотфиксаторов и требует затраты большого количества энергии.Для обоих видов азотфиксаторов используется один и тот же фермент – нитратредуктаза.
Совершенно точно установлено, что в обоих случаях конечным продуктом усвоения N2 является аммиак. Молекулярный азот имеет чрезвычайно прочную химическую связь между атомами N, которая представлена тремя соединительными валентным связами N≡N , которые требуют для их разрыва 940 кДж/ моль энергии. Но у азотфиксаторов он идет чрезвычайно легко с постепенным восстановлением N, т.е поэтапно: N≡N + 2Н + → HN=NH + 2H + → H2N–NH2 + 2H + → 2 NH3
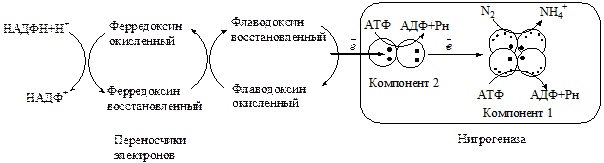
Этот процесс идет благодаря ферменту нитрогеназе с обязательным присутствием Fe и Mo , а также Со и Cu. Реакционный центр нитрогеназы состоит из двух компонентов : высокомолекулярного белка с Мо и Fе, и низкомолекулярного белка, содержащего только Fе. Высокомолекулярная субъединица служит для связывания и восстановления N, а малая является поставщиком е – для восстановления Fе и Мо в белке большой субъединицы (см. рис. ).В атмосфере азот находится в нейтральной форме. Активный центр нитрогеназы содержит Fе и Mo, расстояние между которыми равно величине молекулы N≡N. В этом «гнезде» и происходит расслабление связей, которые легко разрываются и Н + встраивается в молекулу азота. Донором Н + и е– является ПВК образуемая при расщеплении углеводов при дыхании, в гликолизе, что указывает на связь азотфиксации с дыханием и фотосинтезом. Важное место занимает цитохромная система электронного транспорта – ферредоксин.
Процесс требует большого количества АТФ, как источника энергии. Для усвоения 1 моля N2 требуется 12-15 молекул АТФ, а фактически расходуется до 30-40 молекул. Эту энергию организм Rhizobium получает от продуктов фотосинтеза, а Azotobacter и другие свободноживущие гетеротрофы от сбраживания или окисления углеводов, находящихся в почве (растительные остатки). Другая особенность, что процесс идет только в анаэробных условиях. Даже малейшее количество кислорода подавляет процесс азотфиксации. Поэтому азотфиксация в клубеньках бобовых происходит при участии специального соединения, красного цвета, образуемого в ткани клубенька — легоглобина. Имея высокое сродство с О2 он связывает его и создаёт анаэробные ус ловия. Легоглобин синтезируется только в клетках растения –хозяина. Соединяясь с О2 он встраивается в мембрану бактероида, снабжая его кислородом, и защищает нитрогеназу от повреждающего действия О2. В бактероиде функционирует цикл Кребса, аэробная фаза дыхания, которая является поставщиком АТФ и электрона, который через ферредоксин поступает через малую субединицу нитрогеназы в большую для восстановления F и Мо. Цикл Кребса поставляет также кетокислоты (α-кетоглутаровую, ЩУК и др.), которые аминируются образуемым при азотфиксации аммиаком и образуют аминокислоты, которые транспортируются в клетки растения-хозяина (рис. )
Рис. Схема фиксации N2 в бактероиде клубеньков бобовых ( Полевой,1989)
Аналогично работает нитрогеназа свободноживущих азотфиксирующих бактерий. Защита нитрогеназы от О2 имеет также большое значение, но осуществляется без легоглобина, и этот механизм пока не раскрыт. Механизм же работы нитрогеназы такой же как и у симбионтов, поэтапное восстановление N2 до NH3 (рис. ) Механизм биологической фиксации пока полностью не раскрыт. Однако Кретович (70-80- годы ХХ ст.) и другие исследователи установили, что этот процесс осуществляется с помощью нитрогеназы – особого ферментного комплекса, который содержит две белковых фракции. Одна из них состоит из азоферредоксина, который содержит негеминное железо (FeS), другая – из молибденоферредоксина, в которую,
Рис. Схема последовательного восстановления молекулярного азота до аммиака
кроме негеминного железа (FeS), входят два атома Мо. Источником необходимого для данного процесса восстановителя молекулярного азота служит восстановленный ферредоксин (поставляет ē), а источником энергии – АТФ, которая образуется при брожении (у анаэробных азотфиксаторов), или дыхания ( в аэробных). Активатором данной реакции является ионы Mg 2+ . Биологическая фиксация молекулярного азота играет в жизни экосистемы исключительно важную роль. Большое значение азотфиксаторов в природных биоценозах, где различные потери азота (вымывание солей, переход нитратного азота в молекулярный под действием денитрифицирующих бактерий и т) пополняются главным образом за счет их деятельности и лишь частично – в результате разрушения животных и растительных В агробиоценозах потери азота еще больше, так как здесь значительная его часть выносится вместе с урожаем Например, при урожае картофеля 250-300ц/га из почвы выносится около 200 кг/азота. Поэтому бобовые растения являются составной частью любого севооборота. Однако значительная часть потерь азота приходится пополнять путем внесения органических и минеральных удобрений.
Биологическая фиксация молекулярного азота
Важное место в биосинтезе азотсодержащих органических соединений занимают процессы, приводящие к включению к их состав азота. Первичным источником органических соединений служит атмосферный азот, составляющий по объему 78% атмосферы. Метаболизм азота в биосфере начинается с восстановления его до аммиака ,т.е. с биологической фиксации азота.
Способностью к восстановлению атмосферного азота обладают азотфиксирующие бактерии. К числу таких организмов относятся некоторые виды гетеротрофных бактерий как аэробных рода Azotobacter, так и анаэробных рода Clostridium, фотосинтезирующие бактерии рода Rhodospirillium, некоторые водоросли и, наконец, симбиотические системы, состоящие из бактерий рода Rhizobium и некоторых растений, в основном представителей семейства бобовых. В последнем случае ни бактерии, обитающие в корневых клубеньках растения, ни само растение не обладают способностью фиксировать азот, и только их симбиоз приводит к возникновению весьма эффективной и важной «кооперативной» системы фиксации азота.
Первый этап – фиксация атмосферного азота азотфиксирующими организмами является первым этапом цикла азота в природе.
Второй этап – нитрификация аммиака, осуществляемая почвенными микроорганизмами, которые способны использовать NH3 в качестве источника энергии, окисляя его до NO2 — до NO3 — . Важную роль как форма хранения азота в почве играет NO3 — .
Третий этап – восстановлении нитратов растениями и многими микроорганизмами вновь до аммиака при помощи фермента нитроредуктазы.
Четвертый этап – использование аммиака растениями, животными для синтеза аминокислот и построения своих белков.
Аминокислоты, выделяющиеся при распаде белков, возвращаются в почву, а нитрофицирующие бактерии вновь превращают их в NO2 — и NO3 — . Другие виды микроорганизмов осуществляют процесс денитрификации, превращая NO2 — в молекулярный азот, который возвращается в атмосферу.
Молекулярные механизмы фиксации азота
Энергия связи N≡N составляет 940 кДж/моль, т.е. она весьма устойчива к химическим воздействиям, недаром азот в переводе означает безжизненный. Ферментативная система, катализирующая реакцию фиксации N2, называется нитрогеназой:
:N≡N: + 6ē + 6H + → :N– Н
Таким образом, для фиксации N2 необходимы сильные восстановители (поток электронов), а также АТФ и Mg 2+ . Природа доноров электронов различная у разных микроорганизмов. У аэробных бактерий (Azotobacter, Rhizobium) необходимые для фиксации N2 восстановители и АТФ образуются в ходе углеводного обмена в реакциях с участием НАДФ. Фотосинтетические бактерии и сине-зеленые водоросли способны к фотохимическому образованию сильных восстановителей.
Нитрогеназный комплекс состоит из белковых компонентов двух типов.
1. Молибдоферредоксин (Mo-Fe-протеин), или собственно нитрогеназа, содержащая четыре идентичные субъединицы, в каждую из которых входит два атома молибдена, негеминовое железо, лабильный сульфид; молекулярная масса тетрамера
2. Редуктазный компонент (Fe-белок), или азоферредоксин, имеет молекулярную массу от 50 до 70 кДа, димер также содержит негеминовое железо и лабильный дисульфид.
Таким образом, оба компонента представляют собой железопротеины (Fe-S-белки), в которых железо связано с атомом серы остатка цистеина и неорганическим сульфидом.
Суммарное уравнение фиксации азота имеет следующий вид:
N2 + 3 НАДФН+Н + + 12 АФТ + 12 Н2О → 2 NH3 + 3 НАДФ + + 12 АДФ + 12 Н3РО4
Как было отмечено выше, для превращения N2→NH4 + под действием нитрогеназного комплекса необходимы мощные восстановители (первичный донор электронов НАДФН+Н + ) и АТФ. У большинства азотфиксирующих организмов непосредственно источником электронов с высоким потенциалом для этой шестиэлектронной реакции служит ферредоксин (железопротеин типа Fe4-S4, молекулярная масса
10 кДа), который восстанавливается НАДФН и переносит свои электроны на азоферредоксин (редуктазный компонент). Реакция катализируется флаводоксином (ФМН-содержащий фермент).
Ниже приведена возможная последовательность реакций фиксации молекулярного азота.
1. Восстановленный ферредоксин передает электроны редуктазному комплексу (компонент 2). Катализатором этой реакции является флаводоксин.
2. АТФ связывается с редуктазой, происходит изменение ее конформации, приводящее к увеличению восстановительной способности (окислительно-восстановительный потенциал снижается с -0,29 до 0,40 В), что делает редуктазу способной перенести электроны на нитрогеназный комплекс.
3. Происходит перенос электронов на компонент I, происходит гидролиз АТФ до АДФ и Н3РО4, и редуктаза отделяется от нитрогеназного компонента. Наконец, N2 связывается с нитрогеназным компонентом и восстанавливается до NH4 + . Энергия, необходимая для этого процесса, обеспечивается гидролизом АТФ (рис. 11.5).
Рис. 11.5. Нитрогеназа
Следует отметить важную функцию молибдена в процессе азотфиксации. Он способствует формированию функционально активной конформации нитрогеназы, участвует в передаче электронов и связывании азота. Известно также ,что молибден индуцирует синтез этого комплекса.
Ведутся поиски биологических методов, с помощью которых можно было бы сделать азот атмосферы более доступным для практических нужд. Большую часть биологически значимого азота дают клубеньковые бактерии – ризобии в симбиозе с бобовыми растениями. Методами генной инженерии можно интенсифицировать азотфиксацию этих бактерий с целью создания более эффективных симбиотических азотфиксаторов.
Дата добавления: 2015-06-12 ; просмотров: 4817 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
АГРОИНФормация
Агропортал — все для специалистов агропромышленного комплекса
Химизм фиксации микроорганизмами молекулярного азота
Молекулярный азот обладает большой инертностью и с трудом вступает в химическую связь с другими элементами и веществами. Используемый в промышленности метод Габера — Боша для получения из атмосферного воздуха аммиака требует температуры около 500°С и высокого давления (около 350 атм.). Биологическая же азотфиксация проходит в самых обычных условиях. Это вызывает особый интерес к каталитическим системам микроорганизмов, усваивающих молекулярный азот. Их изучение имеет не только большой научный интерес, но и может дать существенный результат для химической технологии.
Следует напомнить, что атомы молекулы азота соединены тремя связями (N==N). Труднее всего разрывается первая связь, существенно легче — вторая и наиболее легко — третья. Разрыв этих связей происходит не сразу, а последовательно, под воздействием ряда ферментных систем. Совершенно очевидно также, что процесс связывания молекулярного азота весьма энергоемок. Поэтому энергетический обмен азотфиксаторов должен как-то отличаться от обмена других микробов. Действительно, В. Л. Кретовичем установлено, что при развитии на молекулярном азоте микробы — азотусвоители на единицу массы новообразованных клеток тратят больше энергии, чем при росте на связанных соединениях азота.
В принципе фиксация молекулярного азота может идти по восстановительному или окислительному пути. Каждый из этих путей многоступенчат и должен катализироваться своей ферментной системой. В клетках микроорганизмов процесс идет по восстановительному пути. Сейчас известно, что в среде, где развиваются азотфиксаторы не только анаэробные, но даже аэробные, устанавливается низкий окислительно-восстановительный потенциал. Аэрация среды резко тормозит процесс фиксации азота, так как кислород является энергичным акцептором водорода и депрессирует образование восстановленных продуктов азота.
Важным аргументом в пользу восстановительного пути фиксации атмосферного азота служит обнаружение в культурах и бесклеточных препаратах азотфиксаторов восстановленных продуктов азота (NH3, NH2OH и т. д.). Весьма существенно также, что ряд предполагаемых продуктов восстановления азота (H2N—NH2, NH2 OH, NH3) усваивается культурами фиксаторов азота, а наиболее вероятный первый продукт окисления азота — закись азота N2О — плохо ассимилируется ими.
Предполагается, что химизм фиксации азота если не тождествен, то близок у аэробных и анаэробных форм микроорганизмов. Допущение же возможности первичного окисления молекулы азота аэробными микроорганизмами привело бы к неизбежному выводу о разных путях фиксации азота аэробами и анаэробами, что трудно допустить.
Таким образом, следует признать, что при фиксации азота происходит восстановление молекулярного азота.
Изучение фиксации молекулярного азота культурами микроорганизмов позволило заключить, что процесс идет активно лишь при наличии в среде соединений молибдена и железа. Это свидетельствует о том, что отмеченные элементы входят в каталитическую ферментную систему, восстанавливающую молекулярный азот до аммиака.
Первые опыты по изучению ферментного комплекса, обеспечивающего азотфиксацию, относятся к 1934 г., когда академик А. Н. Бах и его сотрудники сделали попытку получения бесклеточного препарата, содержащего нитрогеназу — фермента, связывающего молекулярный азот. Эта весьма сложная задача была решена лишь недавно работами многих ученых.
Можно считать установленным, что нитрогеназа состоит из двух фракций. Одна из них, содержащая Мо, получила наименование молибдобелок. Препараты этой фракции, выделенные из различных азотфиксирующих микроорганизмов, близки по свойствам, но различаются по молекулярной массе (в пределах 180 000— 270 000). Молибдобелок состоит из четырех белков, несколько различающихся по молекулярной массе. В молибдобелок входят сульфидные группы и железо. Он инактивируется кислородом.
Молибден играет важную роль в структуре нитрогеназы. Функции его многогранны. Он непосредственно участвует в связывании азота, активизируя восстановительную систему и молекулярный азот, поддерживает структуру нитрогеназы и ее биосинтез и т. д. В переносе электронов к азоту от восстановителя, по-видимому, принимают участие соединения железа. Сульфидные группировки содействуют снижению окислительно-восстановительного потенциала.
Вторая фракция нитрогеназы содержит железо и названа железобелок. Она имеет молекулярную массу 55 000 и состоит из двух равных белковых субъединиц. В нее входят сульфидные группы, эта фракция, как и молибдобелок, инактивируется кислородом.
Активирование азота и водорода, необходимое для превращения N2 в NH3, в клетках азотфиксаторов осуществляется белком негеминной природы — ферредоксином (Fd), молекулярная масса которого составляет около 6000, или близкими к нему соединениями. Их окислительно-восстановительный потенциал лежит в зоне потенциала водородного электрода. Чтобы произошел процесс восстановления азота до аммиака, необходим источник энергии в виде АТФ, а также ионы магния.
В. JI. Кретович приводит схему процесса усвоения азота и дальнейшего превращения аммиака в органические кислоты (рис. 42). Восстановление N2 до NH3 идет ступенчато. Первоначально N2 превращается в диимид (HN = NH), затем в гидразин (H2N—NH2) и, наконец, в NH3.
Установлено, что нитрогеназа может восстанавливать не только молекулярный азот, но и другие соединения, в частности ацетилен С2Н2 до этилена С2Н4. Это свойство нитрогеназы используют для определения ее активности.
Нитрогеназа при участии АТФ катализирует также восстановление ионов водорода, образующихся при процессе азотфиксации, до молекулярного водорода.
Аммиак, образовавшийся при фиксации N2, связывается кетокислотами, что приводит к синтезу аминокислот. Так, из б — кетоглютарата и аммиака получается глютаминовая кислота, которая служит исходным веществом для синтеза ряда метаболитов:
Глютаминовая кислота с затратой энергии в виде АТФ превращается в глютамин, а из него синтезируется важнейший метаболит — аспарагин:
Из щавелевоуксусной кислоты и аммиака образуется аспарагиновая кислота, из пировииоградной кислоты и NH3 — б-аланин и т. д.
В дальнейшем аминокислоты транспортируются в наземную часть растения и расходуются на синтез белков и других органических соединений. У некоторых бобовых культур отток азотсодержащих веществ из клубеньков происходит в форме амидов, а также уреидов (аллантоина и аллантоиновой кислоты).
Леггемоглобин, содержащийся в активно фиксирующих азот клубеньках, служит переносчиком кислорода к бактероидам клубеньков. Вместе с тем он нормирует поступление кислорода в клубеньки, так как нитрогеназа чрезвычайно чувствительна к этому элементу.
Свободноживущим анаэробным азотфиксаторам (Clostridium pasteurianum) подобная защита не требуется. В среде их обитания кислород отсутствует. Клетки аэробных бактерий, усваивающих молекулярный азот, обычно окружены слизистой массой, изолирующей их от воздуха. У цианобактерий N2-фиксация протекает, как правило, в особых клетках — гетероцистах, имеющих мощную оболочку.
Как было отмечено, процесс азотфиксации требует существенных энергетических затрат, которые аккумулируются у микроорганизмов в виде АТФ. Для клубеньковых бактерий «биологическим топливом» в процессе азотфиксации служат продукты фотосинтеза, поступающие из листьев растений. Они трансформируются и запасаются в клетках бактероидов главным образом в виде в — оксимасляной кислоты, при использовании которой происходит генерация АТФ. У свободноживущих сапрофитных азотфиксаторов для этой цели служат разнообразные органические соединения, ассимилируемые из окружающей среды. Бактерии (в том числе цианобактерии), содержащие хлорофилл, получают энергию от фотосинтеза.
При использовании различных комплексных соединений, имеющих переходные металлы, работу нитрогеназы удается моделировать.
Эти исследования дают основание утверждать, что со временем будет разработан промышленный способ мягкой химической фиксации молекулярного азота. Работу по моделированию процесса азотфиксации ведут в СНГ А. Е. Шилов, Г. И. Лихтенштейн и другие ученые.
http://helpiks.org/3-79256.html
http://agroinf.com/mikrobiologiya/2013-11-08-15-08-18/ximizm-fiksacii-mikroorganizmami-molekulyarnogo-azota.html