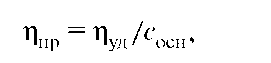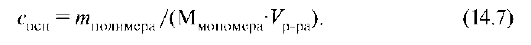Тема: Понятие о ВМС, классификаций. Свойства ВМС. Молекулярные коллоидные системы (растворы ВМС). Набухание и растворение ВМС. Лиотропные ряды ионов. Вязкость и осмотические свойства растворов ВМС
Тема: Понятие о ВМС, классификаций. Свойства ВМС.
Молекулярные коллоидные системы (растворы ВМС). Набухание и растворение ВМС. Лиотропные ряды ионов. Вязкость и осмотические свойства растворов ВМС.
Высокомолекулярные вещества (ВМВ).
Высокомолекулярные соединения (ВМС) – это вещества, молекулы которых состоят из большого числа химически связанных атомов. Такие молекулы называют макромолекулами. К высокомолекулярным веществам относятся вещества, состоящие из макромолекул с молекулярной массой порядка 104-106 и выше.
— природные полимеры (например, белки, нуклеиновые кислоты, полисахариды, натуральный каучук);
— синтетические полимеры, которые получаются в результате реакции полимеризации или поликонденсации (например, полиэтилен, синтетический каучук, фенолформальдегидные пластмассы);
— полусинтетические («искусственные»), которые получаются в результате химической обработки природных ВМВ (например, ацетилцеллюлоза, нитроцеллюлоза).
По строению макромолекул:
— линейные полимеры, макромолекулы, которых представляют собой открытую линейную цепь (например, натуральных каучук, целлюлоза, полиэтилен, пропилен);
— разветвленные макромолекулы ВМВ, имеющие цепи с разветвлениями (например, гликоген, амилопектин, крахмал);
— пространственные ВМВ, молекулы, которых представляют собой трехмерные сетки, образованные отрезками цепного строения (например, фенолформальдегидные смолы).
Из пространственных полимеров в особую группу выделяют полимеры:
— сетчатые, у которых фрагменты макромолекул, образующие сетки (пространственные ячейки), приблизительно равны (например, полистирол);
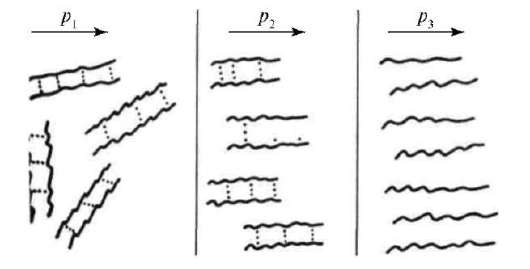
— сшитые, цепи которых сшиты короткими мостиками (обычно состоящими из одного или нескольких атомов, например, серы в резине) (рис.1).
Практически все важные свойства ВМВ тесно связаны с их строением. Так линейной формой макромолекул определяются: способность ВМВ образовывать прочные пленки, нити, набухать, давать при растворении вязкие растворы, быть эластичными.
Полимеры с пространственной структурой, обычно, не растворимы в воде. Форма макромолекулы, имеющей линейную цепь, может приближаться к палочке (полифенилены, полиацетилены), свертываться в спираль (амилоза, пептиды, нуклеиновые кислоты) или в клубок (глобулярные белки).
От формы макромолекулы зависят их свойства.
Линейные полимеры легко переводятся в раствор, обладающий даже при небольших концентрациях высокой вязкостью. Такие полимеры прочны и эластичны.
У разветвленных полимеров, за счет меньшей степени асимметрии молекул вязкость растворов не высока, и они обладают низкой прочностью.
Сетчатые полимеры, в которых прочные химические связи между макромолекулами, не могут быть переведены в раствор. Они тверды, и приближаются по свойствам к кристаллам (например, кристаллический полимер с правильной пространственной решеткой — алмаз).
Рис.1. Схемы строения макромолекул полимеров:
А – линейного; Б – разветвленного; В – пространственного; Г – сшитого.
Возможна классификация ВМВ и по:
а) химическому составу:
— гомополимеры, которые содержат одинаковые мономерные звенья (например, полиэтилен, полипропилен);
— сополимеры, которые содержат два или более различных мономеров (например, белки, нуклеиновые кислоты);
б) физическому состоянию:
— аморфные, у которых отдельные макромолекулы или их сегменты расположены хаотично относительно друг друга (например, каучук, поли-, изо-бутелен);
— кристаллические, у которых отдельные макромолекулы или их сегменты расположены по отношению друг к другу упорядоченно (например, полиамиды, полиэтилен).
Возможны и другие подходы к классификации.
Получение синтетических ВМВ основано на реакциях – полимеризации и поликонденсации. При полимеризации побочных продуктов не образуется. При поликонденсации в качестве побочного продукта образуется низкомолекулярное вещество (часто вода).
Специфические свойства полимеров обусловлены главным образом двумя особенностями: 1) существованием двух типов связей – химических и межмолекулярных, удерживающих макромолекулярные цепи друг около друга; 2) гибкостью цепей, связанной с внутренним вращеньем звеньев. В результате чего макромолекула может изменять пространственную форму путем перехода из одной конформации к другой. В результате конформационных изменений макромолекулы могут либо свертываться, образуя глобулы и клубки или выпрямляться и укладываться в ориентированные структуры – пачки. Наиболее вероятной конформацией молекулы ВМС является клубок, или глобула. Гибкость цепей полимеров зависит от химического строения цепи, природы заместителей, их числа и распределения по длине цепи, числа звеньев в цепи.
Свойства растворов ВМС
Растворы ВМС, как и растворы низкомолекулярных соединений (НМС), являются гомогенными, термодинамически равновесными и агрегативно устойчивыми системами. Это истинные растворы.
Однако свойства растворов ВМС (табл. 1) существенно отличаются от свойств растворов НМС. Отличия заключается в том, что растворы ВМС обладают малой скоростью диффузии, малым осмотическим давлением, значительной вязкостью, чем соответствующие им по концентрации растворы НМС. Растворы ВМС имеют также свойства. Не присущие растворам НМС: светорассеивание, тиксотропия.
Тиксотропия– способность в изотермических условиях самопроизвольно восстанавливать свою структуру после механического разрушения.
Таблица 1
Характеристики и свойства различных дисперсных систем
Характеристики и свойства
1. Дисперсологическая характеристика
Гомогенная система
1.1. Дисперсионная среда
1.2. Дисперсная фаза
1.3. Поверхность раздела фаз
1.4. Размер частиц дисперсной фазы, нм
3. Физические свойства
3.3. Осмотическое давление
3.4. Броуновское движение
3.5. Конус Тиндаля
3.7. Возможность ультрафильтрации (диаметр пор фильтра менее 1 нм)
3.8. Возможность фильтрации через бумажный фильтр
Есть для невязких растворов
3.9. Возможные явления под действием электролитов, спирта, сиропов, глицерина
Растворение ВМС происходит самопроизвольно, но имеет характерную особенность, растворению предшествует набухание, которое заключается в увеличении объема и массы полимера за счет поглощения им какого-то количества растворителя. Количественной мерой набухания является степень набухания б, которая может иметь объемное или массовое выражение:
б – степень набухания;
V0 и V, m0 и m – соответственно объемы и массы исходного и набухавшего полимера.
Причина набухания заключается в различии свойств двух компонентов – ВМС и НМС. Скорость этого процесса определяется подвижностью молекул, коэффициентом их диффузии. Специфика набухания полимеров заключается в том, что взаимодействуют и смешиваются молекулы, различающиеся между собой на много порядков по своим размерам и подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, тогда как молекулы НМС быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем.
Гибкость цепей облегчает проникновение малых молекул в сетку полимера. То есть, процесс набухания представляет собой одностороннее смещение, обусловленное большим различием в размерах молекул.
Способность к набуханию есть свойство полимера, определяемое его составом и строением, как и структурно-механические его свойства. Поэтому процесс набухания всегда специфичен. Полимер набухает ни в любом, а лишь в «хорошем» растворителе, с которым он взаимодействует. Это взаимодействие связано с полярностью. Поэтому полярные полимеры набухают в полярных жидкостях, например, белки в воде, неполярные – в неполярных (каучук в бензоле).
Набухание может быть ограниченным и неограниченным. В первом случае б достигает постоянной предельной величины (например, набухание желатина в воде при комнатной температуре), во втором – значения m и б проходят через максимум, после которого полимер постепенно растворяется (например, желатин в горячей воде). В этом случае набухание является начальной стадией растворения.
Процесс набухания можно разделить на 2 стадии. На первой стадии происходит выделение теплоты ∆Н, наблюдается контракция системы (уменьшение общего объема). Вторая стадия почти не сопровождается контракцией и выделением теплоты, но характеризуется увеличением б и объема набухающего полимера.
Ограниченное набухание обычно заканчивается на второй стадии, неограниченное приводит к растворению полимера. Ограниченно набухший полимер называется студнем.
Одним из факторов, влияющим на процесс набухания и растворения полимеров, является степень полярности звеньев полимера и молекул растворителя. Если полярности звеньев цепи и молекул растворителя близки между собой, то набухание и растворение таких полимеров происходит относительно легко.
Вторым фактором, способствующим этим процессам, является гибкость цепей полимера, так как процесс растворения связан с отделением цепей друг от друга и диффузией их в растворителе.
Определенное значение в процессах набухания и растворения ВМС имеет молярная масса полимера, поскольку с удлинением цепей энергия взаимодействия между ними возрастает и для отделения их друга от друга требуется больше энергии. Чем выше молярная масса полимера, тем труднее он растворяется. На процесс набухания влияет также температура, рН среды, присутствие электролитов.
Растворы высокомолекулярных веществ.
Растворение ВМВ – процесс самопроизвольный. Для него можно записать: 
Первая стадия определяется в основном сольватационным фактором, а вторая – энтропийным.
Благодаря специфическим свойствам макромолекул (их размерам и способности принимать различные конформации) растворы ВМВ имеют:
— общее свойства сходные с истинными раствораминизкомолекулярных
— общие свойства сходные с коллоидными растворами;
— специфические свойства, свойственные только ВМВ.
Свойства растворов ВМВ.
Свойства растворов ВМВ, сближающие их с истинными растворами:
— обратимость (возможность перевода из раствора в полимер, например, при высушивании и обратно).
Свойства растворов ВМВ, сближающие их с коллоидными растворами:
— малое осмотическое давление;
— малая скорость диффузии;
— способность к электрофорезу.
Специфические свойства растворов полимеров:
— способность к набуханию;
— способность к застудневанию;
— способность к высаливанию;
Фазовые состояния ВМВ.
ВМВ вследствие их большой молекулярной массы нелетучи и не способны перегоняться, и не могут быть переведены в газообразное состояние. При нагревании и достижении определенной температуры происходит термическое разложение веществ с разрывом химических связей.
ВМВ могут существовать только в двух агрегатных состояниях – твердом и жидком.
Аморфные полимеры плавятся и отвердевают не при фиксированной температуре, а в некотором температурном интервале.
В зависимости от температуры ВМВ имеет 3 физических состояния:
Температуры перехода одного физического состояния в другое называют температурами фазового перехода.
При низких температурах (Тс – температура стеклования) ВМВ находятся в стеклообразном состоянии (твердое, хрупкое – пластмасса, органические стекла). Тс – характеризуется морозостойкостью материала, сохраняющего эластичность и при низких температурах, например, Тс натурального каучука -73 0С, найлона — 47 0С.
При таком состоянии отсутствует перемещение, вращение как макромолекул, так и их сегментов. Звенья макромолекул проявляют лишь колебательное движение около положения равновесия.
При нагревании выше Тс аморфный полимер переходит в высокоэластичное состояние, цепи становятся гибкими, в них начинает проявляться микроброуновское движение, появляется способность к обратной деформации, которую имеют, например, резина, каучук.
Высокоэластичное состояние характеризуется способностью отдельных сегментов макромолекул перемещаться (вращаться) относительно друг друга.
Температура (Тт — температура текучести), при которой полимер переходит в вязкотекучее состояние, представляет собой широкий интервал.
Вязкотекучее состояние характеризуется способностью перемещаться друг относительно друга как отдельных сегментов, так и макромолекулы в целом.
Такое состояние полимера называют пластичностью (пластическим течением) – способностью его к необратимой деформации. Необратимую деформацию, заключающуюся в перемещении цепи отельными участками, относительно друг друга, называют пластическим течением.
Температуры фазовых переходов зависят от гибкости и длины цепи.
— полимеры с сетчатой структурой существуют в стеклообразном состоянии;
— полимерам с короткими цепями присущи только 2 состояния: стеклообразное и вязкотекучее.
По мере роста длины цепи увеличивается интервал температур Тс-Тт, усиливаются эластические свойства полимера.
Набуханием называют процесс увеличения объема (массы) образца ВМВ в результате поглощения растворителя.
Количественной мерой набухания служит степень набухания (α),которая может иметь объемное или массовое выражение:
или 
V и V0 ,m и m0 – соответственно объемы и массы набухшего и исходного полимера.
Различают виды набухания:
— ограниченное набухание, при котором степень набухания (α) достигает предельного значения, после чего набухание не зависит от времени (например, желатин в холодной воде), синтетические полимеры для контактных линз глаза.
— неограниченное набухание – заканчивается растворением полимера (например, желатин в горячей воде).
Кривые ограниченного (1) и неограниченного (2) набухания имеют вид (рис.2)
Рис. 2. Кинетические кривые набухания (V0,Vmax – j, — объемы исходного и набухающего примера).
Факторы, влияющие на набухание: добавление электролитов. Это влияние обусловлено, в основном, природой анионов и связано сихгидратируемостью.
По влиянию на набухание анионы располагаются в лиотропный ряд:
SO42- CH3COO-Cl- NO3- Br- I- NCS-
— природа растворителя и полимера. Процесс набухания всегда специфичен. Полярные полимеры набухают в полярных жидкостях (например, белки в воде), а неполярные – в неполярных (например, каучук в бензоле);
- температура и давление (по принципу Ле-Шателье); рН среды; степень измельченности полимера. Повышение степени измельченности увеличивает скорость набухания. Увеличивается общая поверхность вещества, благодаря чему ускоряется проникновение молекул растворителя внутрь ВМВ. возраст (свежесть) полимера, чем моложе ВМВ, тем больше степень и скорость набухания.
Процесс набухания протекает самопроизвольно и включает две стадии. 1-я стадия – диффузия молекул растворителя внутрь полимера. 2-я стадия разрыхление сетки с частичным освобождением отдельных молекул и увеличением энтропии системы (∆Н≈0, ∆S>0).
В основе процесса набухания лежит:
- сольватация макромолекулы – об этом свидетельствует выделение теплоты набухания (∆Н
Аномальная вязкость растворов ВМС
Растворы ВМС только при очень больших разбавлениях (
0,01%) подчиняются законам Ньютона и Пуазейля. Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях.
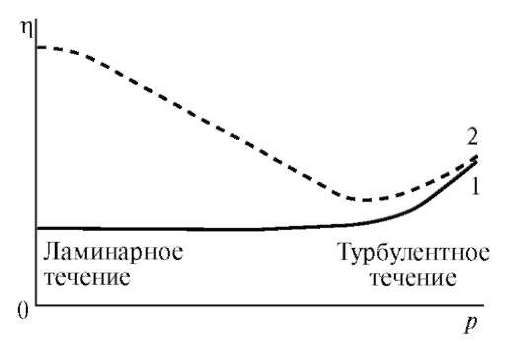
Вязкостью (внутренним трением) называют свойство жидкостей оказывать сопротивление действию внешних сил, вызывающих их течение. Помимо этого растворы ВМС не являются ньютоновскими жидкостями, так как величина их вязкости (η) зависит от напряжения сдвига (р) — отношения тангенциально приложенной к образцу силы к единице поверхности (рис. 17).
Причины аномалии вязкости заключаются в наличии структурной вязкости у подобных систем. Структурная вязкость — это дополнительная вязкость, обусловленная добавочным сопротивлением течению со стороны внутренних надмолекулярных пространственных структур — сеток, нитей, крупных капель эмульсий. Вязкость таких систем не остается постоянной при увеличении напряжения сдвига, а резко падает, пока не достигает постоянной величины, но на более низком уровне вследствие разрушения структуры (рис. 18).
Рис. 17.Зависимость вязкости растворов низкомолекулярных веществ ньютоновских жидкостей (1) и растворов ВМС (2) от напряжения сдвига
Особенно сильно это свойство проявляется у полимеров с длинными линейными молекулами, например у каучука. Растворы полимеров с той же молекулярной массой, но со сферической формой молекул имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре вязкость возрастает с увеличением молекулярной массы. Она зависит также от концентрации полимера и межмолекулярных сил взаимодействия.
Рис. 18. Изменение структуры растворов ВМС при увеличении напряжения сдвига
Область постоянства вязкости аномально вязких жидкостей называют псевдопластической областью. Дальнейшее повышение напряжения сдвига вызывает увеличение коэффициента вязкости, что связано с турбулентностью.
Экспериментальные данные показывают, что коллоидные аномально вязкие системы могут течь и при очень малых давлениях и при этом вязкость остается постоянной, но очень высокой. Такое течение называют ползучестью.
Увеличение давления резко снижает вязкость ползучих систем, пока не наступает вторая область постоянства вязкости — псевдопластическая.
Аномалии вязкости вызываются рядом причин.
1. Структурообразование — процесс агрегации частиц коллоидных растворов, суспензий, растворов ВМС и образования пространственных легкоразрушимых структур.
2. Изменение ориентации в потоке частиц удлиненной формы и макромолекул при увеличении градиента скорости.
3. Деформация клубков макромолекул полимера или капель эмульсий в потоке.
С повышением температуры вязкость структурированных систем резко уменьшается за счет разрушения структуры. При понижении температуры доля структурной вязкости значительно увеличивается.
Для характеристики вязкости растворов пользуются величинами относительной и удельной вязкости. Относительную вязкость ηотн рассчитывают по уравнению:
где η — вязкость раствора; ηо — вязкость растворителя. Для расчета удельной вязкости используют соотношение:
Вязкость растворов ВМС увеличивается с возрастанием их средней молярной массы, поэтому вязкость растворов полимеров часто характеризуют приведенной вязкостью ηпр:
где Сосн — концентрация в основных молях:
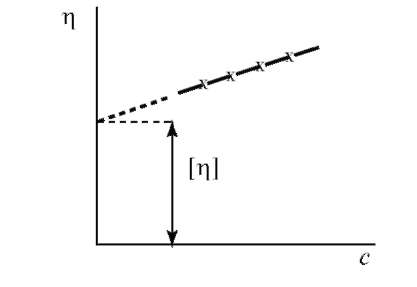
Приведенная вязкость увеличивается при увеличении концентрации (рис. 19).
Приведенную вязкость бесконечно разбавленного раствора называют характеристической вязкостью [η].
Рис. 19. График зависимости приведенной вязкости от концентрации
Растворы ВМС представляют собой истинные растворы, т.е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. В концентрированных растворах ВМС обычно возникают достаточно большие ассоциаты молекул, которые можно рассматривать как вторую фазу. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС.
В противоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью, что используется для определения их молекулярной массы.
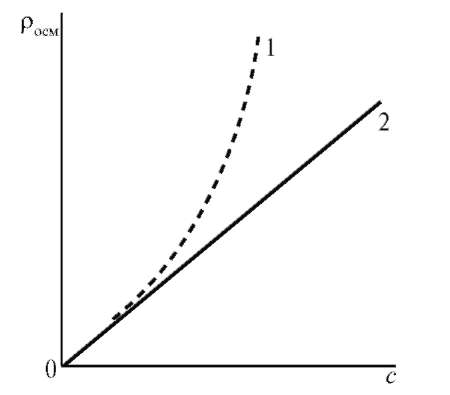
С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант-Гоффа (π = cRT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой.
Рис. 20. Зависимость осмотического давления от концентрации раствора: 1 — раствор ВМС; 2 — раствор низкомолекулярного неэлектролита
Причиной отклонения от законов Вант-Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера:
где c — концентрация раствора ВМС, г/л; М — молярная масса, г/моль; b — коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе.
В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотического давления относительно невелика: она составляет примерно 0,5% от суммарного осмотического давления (≈3,1кПа), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма.
Дата добавления: 2015-05-26 ; просмотров: 8835 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Гибкость макромолекул
Автор: Пользователь скрыл имя, 01 Ноября 2011 в 17:17, курсовая работа
Краткое описание
Гибкость цепи — одна из важнейших характеристик полимера, определяющих его основные макроскопические свойства.. Гибкость макромолекул – это способность полимерных цепей изменить свою конфигурацию или конформацию под действием внутримолекулярного теплового движения или внешних сил в результате заторможенного вращения звеньев вокруг С–С связей основной цепи макромолекулы Она реализуется за счет возможности вращения вокруг связей, образующих основную цепь макромолекул.
Оглавление
Введение 3
Природа гибкости макромолекул
4
Тепловое движение макромолекулы. Термодинамический сегмент Куна
7
Модели макроцепей
10
Конфигурация и конформация макромолекул
14
Механизмы гибкости
19
5.1 Поворотно-изомерный механизм 19
5.2 Персистентная гибкость 24
Параметры гибкости цепи
29
Виды гибкости
31
7.1 Термодинамическая гибкость 31
7.2 Кинетическая гибкость 37
Факторы, определяющие гибкость цепи
42
Заключение 47
Список литературы 48
Файлы: 1 файл
курсовая по химии.docx
Рис. 15 К определению персистентной длины червеобразной цепи.
Существенно, однако, что методы (главным образом, рентгеноструктурный анализ) определения а не связаны с ограничениями, накладываемыми длиной или подвижностью цепи. Действительно, если Z≤χ или χ/2 (что соответствует а), цепочка практически не способна изменить конформацию, но это не значит, что ее равновесная гибкость уменьшилась: просто размер цепи слишком мал, чтобы она могла проявиться. Гибкость сохраняется, но ограничивается подвижность; этим еще раз подчеркивается физическое различие обоих понятий, хотя они и взаимосвязаны. Однако а можно измерить непосредственно и в этом случае и оценить гибкость макромолекулы . независимо от Z. Чем больше Z, тем больше жесткость. Для жесткой палочки cos φ=0 и а→∞, т. е. вся цепь как бы обращается в один сегмент; в этом случае, однако, понятие сегмента вряд ли сохраняет смысл.
Поскольку равновесная гибкость выражается через размеры невозмущенного статистического клубка, то для определения ее пригоден любой экспериментальный метод, позволяющий определить размеры цепи и Z (светорассеяние, малоугловое рассеяние рентгеновых лучей, седиментация в ультрацентрифуге, свободная диффузия, определение вязкости характеристической и др.).
Представления о равновесной гибкости, так или иначе сводимые к степени свернутости цепи, неприменимы к макромолекулам блок- или привитых сополимеров, многих дифильных сополимеров и биополимеров. Вследствие сильных избирательных внутрицепных взаимодействий такие макромолекулы могут принимать конформации, сильно отличающиеся от статистического клубка; подвижность всех или значительной части звеньев подавлена, и возвращение к конформации клубка при изменении температуры или растворителя происходит очень резко, будучи по физическому смыслу аналогично фазовому превращению (этот особый тип жесткости иногда называют структурной жесткостью).
Таблица 5. Характеристики равновесной гибкости некоторых полимеров 14
| Полимер | А, нм (Å) | χ* | Тс, К | |
| Полиэтилен | 2,3-2,4 | 2,08(20,8) | 8,3 | — |
| Полипропилен | 2,4 | 2,17(21,7) | 8,6 | — |
| Полиизобутилен | 2,2 | 1,83(18,3) | 7,3 | — |
| Поливинилхлорид | 2,8 | 2,96(29,6) | 11,7 | 353 |
| Полистирол | 2,2-2,4 | 2,00(20,0) | 7,9 | 354 |
| Полиакрилонитрил | 2,6-3,2 | 3,17(31,7) | 12,6 | 500 |
| Поливинилацетат | 2,1-2,3 | 1,74(17,4) | 6,9 | 301 |
| Полиметилметакрилат | 1,8-2,2 | 1,51(15,1) | 6,0 | 373 |
| цис-Полиизопрен (натуральный каучук) | 1,7 | — | — | 203 |
| транс-Полиизопрен (гуттаперча) | 1,45 | — | — | — |
| Полихлоропрен | 1,4 | — | — | 233 |
| Полиакриламид | 2,72 | — | — | — |
| Полипропиленоксид | 1,6 | — | — | — |
| Полибутадиен | 1,7 | — | — | 233 |
| Полидиметилсилоксан | 1,4-1,6 | 14,0 | 4,9 | — |
| Полиметилметакрилат | 2,2 | 15,1 | 6,0 | — |
| Полигексилметакрилат | 2,4 | 21,7 | 8,6 | — |
| Полиметилакрилат | — | 20 | — | — |
| Полицетилакрилат | — | 50 | — | — |
| Полиоктадецилакрилат | — | 60 | — | — |
| Производные целлюлозы | 4,0-4,5 | 100-250 | — | — |
| Полиалкилизоцианаты | — | 1000 | — | — |
| Поли-n-бензамид | — | 2100 | — | 320 |
| Биополимеры | — | 2400 | — | — |
| Полиакрилонитрил | 2,6-3,2 | 31,7 | — | — |
| Этилцеллюлоза | 4,0 | 2100 | — | — |
| Поливиниловый спирт | 2,0 | 17,0 | — | — |
| Полиоксиэтилен | 1,6 | 15,0 | — | — |
* χ — степень полимеризации статистического сегмента. Для сопоставления в ряде случаев приводится температуpa стеклования Тс.
В таблице 5 приведены значения σ и А для ряда полимеров. Видно, что равновесная гибкость цепи зависит от химического строения основной цепи, а также природы и размера заместителя. Наибольшей равновесной гибкостью характеризуется полидиметлсилоксан, затем идут виниловые полимеры, которые обладают большой равновесной гибкостью, не изменяющейся даже при введении такого большого заместителя, как фенил. Увеличение размеров заместителей в цепи, например гребнеобразных полимеров (полиметилметакрилатов), приводит к возрастанию сегмента Куна до 50 Å, т. е. к увеличению «скелетной» жесткости цепи. Однако введением боковых заместителей очень сильно изменить жесткость цепи нельзя 15 .
Очень гибкоцепными полимерами являются простые и сложные алифатические полиэфиры. Их большая равновесная гибкость обусловливается низким потенциалом торможения вокруг связей С—С и С—О—С. В отсутствие межцепного взаимодействия, т. е. в очень разбавленных растворах, большой равновесной гибкостью обладают и ароматические полиэфиры — полиарилаты.
Иначе ведут себя полиамиды. В самой амидной группе вследствие квазисопряженного характера связей вращение сильно заторможено. Поэтому полиамиды могут обладать большой равновесной гибкостью только в том случае, если амидные группы разделены достаточно большим числом (не менее четырех) метиленовых групп, когда вращение происходит вокруг связей С—С. Поэтому алифатические полиамиды характеризуются небольшим значением сегмента Куна, т. е. являются гибкоцепными полимерами.
Еще большей равновесной жесткостью обладают полимеры, в цепи которых ароматические ядра соединены в пара-положении, например поли-п-бензамид, поли-п-фенилентерефталамид, поли-п-аминогидразид
Таким образом, в зависимости от химического строения макромолекулы равновесная жесткость может изменяться в очень широких пределах. При этом малое значение а, полученное при исследовании равновесных свойств макромолекул, не обязательно означает близость вращения к «истинно свободному». Небольшое значение а может отвечать наличию высоких потенциальных барьеров, препятствующих вращению 16 . Кроме того, огромное значение имеет межмолекулярное взаимодействие, которое также оказывает влияние на гибкость цепи. Это проявляется даже в разбавленных растворах, когда гибкость цепи зависит от ее взаимодействия с молекулами растворителя. Межцепное взаимодействие также может играть роль, поэтому гибкость макромолекул в блоке может отличаться от гибкости, измеренной в разбавленных растворах.
7.2 Кинетическая гибкость
Кинетическая (механическая) гибкость. Во внешнем, обычно гидродинамическом, поле макромолекула может проявлять подвижность (включая изменение формы или размеров) в целом или на отдельных участках цепи. В отличие от статистического сегмента, длина кинетического сегмента даже у изолированной молекулы не является константой и зависит от скорости воздействия. В квазиравновесных условиях (очень медленная деформация) она близка к длине статистического сегмента; при очень быстрой деформации вся макромолекула ведет себя как абсолютно жесткая («превращается» в один кинетический сегмент), ибо не успевает деформироваться. Поэтому более или менее однозначная оценка кинетического сегмента изолированных макромолекул и вообще кинетической гибкости может быть произведена лишь в экспериментах, где цепи деформируются в стационарном режиме. Мерой кинетической гибкости является в этом случае внутренняя вязкость В, определяемая из соотношения
где F — деформирующая сила; dh/dt — скорость деформации (растяжения) макромолекулы. Параметр В связан с подвижностью, чем больше Z, тем большую деформацию способна претерпеть цепь, т. е. тем меньше В. Эта неоднозначность устраняется при введения коэффициента жесткости γ=BZ, который уже от Z не зависит (ибо В
) и выражается через cos φ или а.
При переходе к конденсированным системам основные закономерности для кинетической гибкости сохраняются, но осложняются из-за межцепных взаимодействий, дополнительно ограничивающих свободу вращения звеньев. Тем не менее представление о кинетической гибкости лежит в основе подразделения всех практически важных полимеров на эластомеры и стекла. Кинетическая гибкость в конденсированных системах начинает проявляться выше температуры стеклования Тс, которая может служить качественной мерой гибкости макромолекул. По аналогии с кинетическим сегментом можно определить механический сегмент как эквивалентную цепь, по достижении длины которой Тс перестает зависеть от Z. При известных молекулярной массе или Z размер механического сегмента может быть оценен из термомеханических кривых по формуле, аналогичной уравнению Вильямса — Ланделла — Ферри, но выведенной значительно раньше В. А. Каргиным и Г. Л. Слонимским:
Здесь NK — число механических сегментов в цепи (равное Z/χк, где χк – степень полимеризации механического сегмента); Тт — температура текучести; С и D — эмпирические константы для данного полимера. Напомним, что, в отличие от N и χ, Nк и χк зависят от способа определения Тс и Тт. Поэтому, хотя интервал ΔТ=Тт—Тс и зависит от Z, формула может использоваться для приближенных оценок Z лишь при ряде оговорок.
Выше Тт, т. е. в условиях, когда расплав способен к истинному течению, вязкость его является функцией Z, следуя закону η=KZ b . Для большинства исследованных полимеров показатель степени b по достижении Z и концентрацией (в случае растворов) некоторых предельных значений становится равным 3,4. Коэффициент К зависит от концентрации, становясь при тех же условиях пропорциональным ее пятой степени. Теплота активации вязкого течения до определенного предела также растет с Z, принимая затем постоянное значение. Это значение Z может быть другой мерой длины механического (или «реологического») сегмента, которая не обязательно совпадет с оценкой по формуле.
Кинетическая гибкость цепи определяется, в первую очередь, величиной потенциальных барьеров вращения, а также внутри- и межмолекулярным взаимодействием. Последнее особенно существенно для конденсированного состояния полимеров. Потенциальный барьер вращения определяется взаимодействием атомов и атомных группировок соседних звеньев и зависит от полярности заместителей. Потенциальные барьеры вращения простых молекул определяются спектральными методами по температурной зависимости интенсивности поглощения. Значения потенциальных барьеров, приведенные в таблице 1, рассчитаны для веществ, находящихся в состоянии идеального газа; следовательно, строго говоря, они не отражают поведения реальных веществ. Однако качественную картину они дают. Так, полимеры, характеризующиеся малыми значениями потенциальных барьеров вращения, обладают большой кинетической гибкостью. К ним относятся:
- полимерные углеводороды (полиэтилен, полипропилен, полиизобутилен, полибутадиен и полиизопрен);
- карбоцепные полимеры, у которых полярные заместители расположены редко по цепи и не оказывают влияние на потенциальный барьер вращения вокруг связи С—С, который определяется взаимодействием только соседних звеньев полихлоропрен, нитрильные каучуки СКН-18, СКН-26, СКН-40);
- карбоцепные полимеры, у которых имеются заместители больших размеров, редко расположенные по цепи (сополимеры стирола и бутадиена, содержащие до 50—60% стирола);
- гетероцепные, в цепи которых имеются группировки С—О—С, разделенные большим числом метиленовых групп (простые и сложные полиэфиры, полиуретаны).
Из таблицы 1 следует, что наиболее низки потенциальные барьеры вращения вокруг связей С-О, C-S, C-Si, С-С=С. Известно, что еще более низкими являются потенциальные барьеры вращения вокруг связей Si-O, Р-О, P-N.
Кинетическая или динамическая гибкость цепи зависит от высоты потенциального барьера ΔЕ, разделяющего транс- и транс-гош состояния. Если ΔЕ≈kТ, то переход между двумя локальными конформациями или транс-гош-изомеризация может происходить за время τр порядка 10 -11 с, что отвечает кинетической гибкости цепи. В общем случае:
где τр — время, необходимое для изменения локальной конформации; τ0 — величина, близкая 10 -14 с.
Рис. 16 Зависимость фактора гибкости полиметакрилатов от молярного объема заместителей основной цепи
Макромолекулы могут обладать значительной термодинамической и малой кинетической гибкостью, например макромолекулы с гибкой основной цепью и объемными или полярными заместителями. В этом случае клубок «заторможен» в одном из конформационных состояний. Кинетическая гибкость, т.е. скорость изменения конформации может быть увеличена в результате воздействия на макромолекулу внешних сил.
Кинетическая гибкость может проявляться как в растворе, так и в конденсированных полимерных телах. В первом случае она проявляется наиболее ярко в гидродинамическом поле. При действии больших напряжений сдвига макромолекулы разворачиваются. Кинетическая гибкость макромолекул в растворе характеризуется величиной кинетического сегмента, т. е. минимальным отрезком цепи, который может изменять форму под действием внешней силы. Длина кинетического сегмента зависит от скорости воздействия, с ее уменьшением длина кинетического сегмента уменьшается и стремится к длине термодинамического сегмента.
Гибкость цепи оказывает большое влияние на свойства полимеров и определяет области их использования. Например, кинетическая гибкость приводит к возникновению у полимеров такого уникального и технически важного свойства, как высокоэластичность, кроме того, она обусловливает способность макромолекул к ориентации, что имеет огромное значение при формировании волокон.
С кинетической гибкостью связаны температуры стеклования полимеров. Полимеры, цепи которых имеют высокую кинетическую гибкость, характеризуются низкими температурами стеклования. При комнатной температуре — это каучукоподобные материалы. Полимеры со средним значением кинетической жесткости цепей имеют температуры стеклования 80-100. Жесткоцепные полимеры характеризуются очень высокими температурами стеклования — выше 200 °С.
http://helpiks.org/3-60924.html
http://student.zoomru.ru/him/gibkost-makromolekul/39474.298668.s5.html