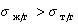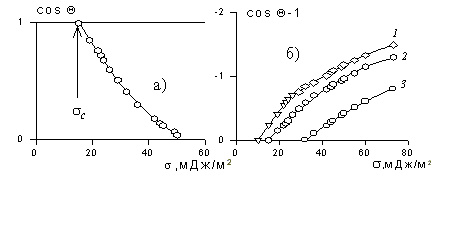Лекция №4
План лекции:
МЕЖФАЗНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОНДЕНСИРОВАННЫМИ ФАЗАМИ
К межфазным взаимодействиям между конденсированными фазами относятся смачивание, растекание и адгезия.
Как правило, адгезия и смачивание сопровождают друг друга. Эти явления широко распространены в природе и в различных отраслях промышленности (нанесение лакокрасочных покрытий, получение материалов на основе связующих и наполнителей — бетон, резина и т. д.)
АДГЕЗИЯ
Адгезия — межфазное взаимодействие, или взаимодействие между приведёнными в контакт поверхностями конденсированных тел разной природы (прилипание). Адгезия обеспечивает между двумя телами соединение определенной прочности, обусловленное межмолекулярными силами.
Адгезия между — ж/ж, ж/т, т/т.
Адгезия — результат стремления системы к уменьшению поверхностной энергии, поэтому это самопроизвольный процесс. Работа адгезии Wa, характеризующая прочность адгезионной связи, определяется работой обратного разрыва адгезионной связи, отнесённой к единице площади:
W s = WаS, где Ws — полная работа адгезии (4.1)
Cоотношение между Wa и s :
Предположим, что имеется контакт между 3 фазами — 1 — газ, 2 -жидкость, 3 — твердое тело, 2, 3 — конденсированные фазы. Введем следующие обозначения поверхностных натяжений:
s 2,3 — поверхностное натяжение на границе раздела двух конденсированных фаз
s 2,1 и s 3,1 — поверхностное натяжение на границе с воздухом
Уравнение Дюпре отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение.
Уравнение 4.2 справедливо только для изобарно-изотермического процесса в отсутствии электрического и химического взаимодействия между контактирующими телами, его используют только для определения равновесной работы адгезии жидкости.
Равновесную работу адгезии можно сопоставить с равновесной работой когезии. Когезия — определяет связь между молекулами внутри тела и в пределах одной фазы, характеризует прочность конденсированных тел и их способность противодействовать внешнему усилию.
Механизм адгезии
Первая стадия — транспортная, перемещение адгезива (клеящего вещества) к поверхности субстрата (тело, на которое наносят адгезив) и их определенное ориентирование в межфазном слое.
Вторая стадия — взаимодействие адгезива и субстрата, обусловлено различными силами (от ван-дер-ваальсовых до химических).
Завершается процесс адгезии межмолекулярным взаимодействием контактирующих фаз, что соответствует минимальной поверхностной энергии. Различают несколько механизмов (и, соответственно, теорий) в зависимости от природы взаимодействующих тел и условий, при которых происходит адгезия.
1.Механическая адгезия — осуществляется путем затекания в поры и трещины поверхности твердого тела жидкого адгезива., который потом затвердевает, обеспечивая механическое зацепление.
2.Молекулярная (адсорбционная) адгезия — возникает под действием межмолекулярных ван-дер-ваальсовых сил и водородных связей.
3.Электрическая теория — связана с образованием ДЭС на границе раздела между адгезивом и субстратом.
4.Диффузионный механизм — предусматривает взаимное проникновение молекул и атомов в поверхностные слои взаимодействующих фаз.
Чаще всего механизм адгезии является смешанным.
Теоретическая оценка адгезии очень приближённа, т. е., механизм её недостаточно изучен.
СМАЧИВАНИЕ
Смачивание — это поверхностное явление, заключающееся во взаимодействии жидкости с твёрдым или другим жидким телом при наличии контакта трех несмачивающихся фаз, одна из которых воздух.
Степень смачивания количественно характеризуется косинусом краевого угла (угла смачивания) или просто краевым углом (углом смачивания).
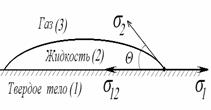
Рис.4.2. К выводу уравнения для краевого угла (закон Юнга).
Рис.4.2. иллюстрирует состояние капли жидкости на поверхности твердого тела в условиях равновесия. Поверхностная энергия твердого тела, стремясь уменьшиться, вызывает растяжение капли по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом s 3,1 .Межфазная энергия на границе твердого тела с жидкостью s 2,3 стремится сжать каплю. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между твердой, жидкой и газообразной фазами по касательной к сферической поверхности капли и равно s 2,1 .Угол q — краевой угол или угол смачивания.
Чем меньше краевой угол , тем лучше смачивание поверхности.
Если cos( q )>0 , то поверхность хорошо смачиваемая, cos( q )
Если разность s 3,1 — s 2,3 в уравнении Дюпре заменить её выражением из закона Юнга, то
Wa/ s 2,1 = 1+ cos( q ) — уравнение Дюпре-Юнга (4.5)
4.3, 4.4, 4.5 — только для идеально гладких тел. На поверхности реальных тел есть поры, трещины, и т. д.
Рассмотрим кинетический катерезис, который замедляет достижение равновесной формы капли.
Рис.4.3.Статические углы натекания и оттекания.
Для реальных тел: равновесный угол смачивания равен полусумме предельных углов натекания и оттекания:
cos( q ) = (cos( q нт ) + сos( q от ))/2 (4.6)
Влияние шероховатости на кривой угол:
k = cos( q ш )/cos( q ) , где к — коэфф. шероховатости
При повышении степени шероховатости смачиваемость улучшается.
РАСТЕКАНИЕ
Капля жидкости, нанесенная на поверхность, может оставаться на ее определенном участке, и система будет находится в равновесии в соответствии с законом Юнга, или же растекаться по поверхности. В обоих случаях система переходит в состояние с минимальной энергией Гиббса.
Из этого соотношения следует, что уменьшение межфазного натяжения s 2,3 (увеличение работы адгезии) и поверхностного натяжения жидкости s 2,1 , способствует растеканию жидкости.
Растекание происходит в том случае, если работа адгезии превышает работу когезии.
Способность жидкости растекаться зависит от когезии наносимых на поверхность жидкостей.
С повышением температуры увеличивается работа адгезии, поэтому нерастекающаяся жидкость с увеличением температуры может начать растекаться.
2.3.2. Смачивание и растекание на границе твердое тело – жидкость – газ
В большинстве случаев жидкость на поверхности твердого тела остается в виде капли, большей или меньшей толщины, контактирующей с твердым телом под определенным углом, который называется краевым углом смачивания и обозначается буквой Q (рис. 1.24). Растекание капли по поверхности прекратится при достижении равновесия, которое без учета сил тяжести может быть описано уравнением Юнга:

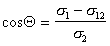
где индексы 1, 2, 3 – обозначают, соответственно, твердую, жидкую и газовую фазы.
Работа адгезии выражается уравнением Дюпре:
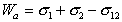
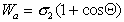
Рис. 1.24. Капля жидкости на поверхности твердого тела (схема)
Работа адгезии при 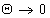
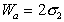
Следует помнить, что определение работы адгезии в реальных системах предполагает равновесие фаз, насыщенных относительно друг друга.
Кроме того, твердая поверхность, по которой происходит растекание жидкости, не свободна. Она обычно покрыта пленкой вещества, адсорбированного из газо-паровой фазы. Эта пленка имеет поверхностное давление p, поэтому
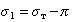
Смачивание неоднородных, пористых или шероховатых поверхностей сопровождается запиранием пузырьков воздуха в неровностях. В результате этого краевые углы смачивания сухой и предварительно увлажненной поверхностей различаются. Такое явление носит название «гистерезис смачивания». Гистерезис смачивания проявляется также при загрязнении поверхности, в результате чего она становится неоднородной при закреплении на ней твердых частиц или жировых пленок. В этом случае поверхность ведет себя как составная.
Шероховатость поверхности учитывается введением коэффициента шероховатости r, представляющего отношение площади поверхности реального тела к площади идеально гладкой поверхности, тогда
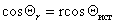
Можно отметить, что если краевой угол смачивания гладкой поверхности, например полимерной пленки, меньше 90 o , то шероховатость (ткань из волокон этого полимера) уменьшает его, если же он больше 90 o , то шероховатость его увеличивает. Для составной поверхности, которая специфична для большинства текстильных материалов, наличие участков различной природы может быть учтено введением коэффициентов x, характеризующих долю поверхности с различными свойствами. Например, если текстильный материал изготовлен из волокон двух видов 1 и 2, то
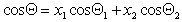
Если переплетение нитей таково, что получается сетчатый или дырчатый материал, то уравнение (2.50) принимает вид
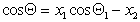
где х2 – доля открытой поверхности.
Как мы обсуждали выше, поверхностное натяжение можно разделить на компоненты дисперсионных и полярных сил, а при нахождении межфазового натяжения для многих жидких границ можно ограничиться лишь дисперсионной составляющей. Такое ограничение позволяет провести обсуждение явления смачивания (по крайней мере, низкоэнергетических поверхностей, к каковым можно отнести подавляющее большинство волокнообразующих полимеров), в рамках теории дисперсионных сил.
Как показал Н. В. Чураев смачивание неполярной жидкостью твердой поверхности возможно, если будет соблюдаться условие смачивания, которое выражается уравнением
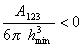
где А123 – составная постоянная Гамакера при взаимодействии жидкости (фаза 2) с твердым телом (фаза 1) на границе с воздухом (фаза 3); hmin — наименьшая толщина пленки, которая фактически соответствует Ван-дер-Ваальсову расстоянию, т.е. hmin = (0,22¸0,24) нм. Например, для воды на поверхности тефлона А123 = -7·10 — 21 Дж.
Учет только дисперсионных сил приводит к уравнению
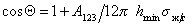
При расчетах углов смачивания твердых поверхностей следует учитывать поверхностное давление пленки, образованной при адсорбции из газо-паровой фазы. Тогда с учетом уравнения (1.2.48), уравнение Юнга (1.2.45) следует записать в виде
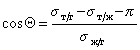
Способ расчета поверхностного давления предложили Бэнгхэм и Разорук:
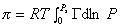
где P – равновесное давление, Г– равновесная адсорбция газа (пара), Ps – давление насыщения.
При больших углах смачивания и слабом взаимодействии жидкости с твердым телом поверхностное давление обычно не учитывают.
Для неполярных жидкостей на низкоэнергетической поверхности твердого тела для работы адгезии было получено выражение
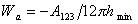
Поэтому уравнение Дюпре (1.2.46) можно записать
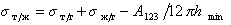
Для дисперсионной составляющей жидкости
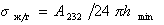
где А232 – постоянная Гамакера взаимодействия жидкости через прослойку газа (пара).
Сочетая уравнения (1.2.47), (1.2.55) и (1.2.56), получаем
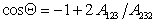
Очевидно, что Q = 0, т.е. при полном смачивании, cosQ = 1, если
Уравнение (1.2.57) позволяет прогнозировать вероятность смачивания (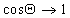
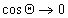
Чаще, однако, прибегают к определению постоянной Гамакера по известному значению межфазового натяжения на границе «твердое тело — газ». Эту характеристику поверхности твердого тела находят при распространении подхода Джирифалько и Гуда, рассмотренного нами выше для границы двух жидкостей, на поверхность раздела «жидкость — твердое тело», уравнения (1.2.23), (1.2.35).
Так приложение уравнения (1.2.34) к уравнению Юнга для случая смачивания неполярной жидкостью поверхности полимерного материала позволяет получить уравнение, известное как уравнение Фоукса, при
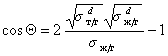
Если жидкости неполярны и 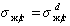
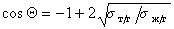
Уравнение (1.2.59) Зисман предложил использовать для определения поверхностного натяжения твердых тел. Очевидно, что при 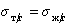
Естественно, что метод Зисмана ограничен некоторыми условиями, в частности, из уравнения (1.2.57) следует, что полное смачивание возможно при дисперсионной неразличимости твердого тела и жидкости, т.е. при А232= А123.
В действительности такого условия никогда невозможно достигнуть хотя бы потому, что если жидкость и твердое тело будут иметь одинаковый химический состав, их постоянные Гамакера будут различаться из-за различий в плотности.
Другое ограничение, связанное с применением метода Зисмана, основано на том, что использовать для измерения краевых углов смачивания следует лишь неполярные жидкости. Наиболее целесообразно применять гомологические ряды жидкостей. При величине поверхностного натяжения жидкостей более 35 мДж/м 2 метод Зисмана уже дает высокую погрешность, так как необходимо учитывать вклад полярных сил, которые в отличие от дисперсионной составляющей могут иметь и отрицательное значение. С другой стороны, приложение для смачивания твердых тел полярными жидкостями уравнения Ву (1.2.36) позволяет рассчитать полярную составляющую поверхностного натяжения жидкости, если для одной из неполярных жидкостей измерить краевой угол смачивания. Для расчета используют уравнение
Рис. 1.25. Зависимость смачивания поверхностей от поверхностного натяжения жидкостей. Материал поверхности: 1- FC-721; 2- ПТФЭ (тефлон); 3 — полиэтилен
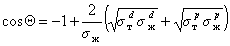
Этот метод позволил разделить величину поверхностного натяжения жидкостей на полярную и дисперсионную компоненты и определить поверхностное натяжение многих волокнообразующих полимеров.
Пример зависимости косинуса угла смачивания поверхности пленок различными жидкостями приведен на рис.1.25. Для описания этих зависимостей Зисман предложил использовать эмпирическое уравнение
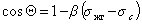
где bэмпирическая постоянная, sс – «критическое» поверхностное натяжение твердого тела, при котором происходит полное смачивание твердого тела жидкостью. Очевидно, что cos Q =1 при условии sжг = sс .
Как мы обсуждали выше, этот критерий в известной мере является условным, хотя и отражает энергетическое состояние поверхности твердого тела.
Реальное значение поверхностного натяжения твердого тела экспериментально определить невозможно, также как и рассчитать его теоретически. В этой связи метод Зисмана нашел широкое применение в практике исследования полимерных материалов, а также полимерных покрытий тканей, используемых в качестве отделочных материалов
Поверхностная энергия и поверхностное натяжение
Лекция 6. Поверхностная энергия и поверхностное натяжение.
Оценка поверхностного натяжения жидкостей. Методы.
Определение поверхностного натяжения твердых тел.
Адсорбция на границе жидкость-газ.
Рекомендуемые файлы
Изотерма адсорбции. Построение.
Поверхностный слой жидкости, соприкасающийся с другой средой, находится в особых условиях по сравнению с остальной массой жидкости.
Эти особые условия возникают потому, что молекулы поверхностного слоя, в отличии от молекул внутренних слоев, подвергаются неодинаковому притяжению молекулами жидкости и газа.
Каждая молекула внутри жидкости со всех сторон притягивается с одинаковыми силами соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил, как показано на рис. 6.1.
Рис. 6.1. Схема действия межмолекулярных сил внутри жидкости и на ее поверхности.
В результате, силы притяжения компенсируются и равнодействующая сил для молекулы 1 равна 0.
У молекул поверхностного слоя (молекула 2) одна часть сферы действия межмолекулярных сил находится в жидкости, другая – в газовой фазе. Так как плотность газа меньше плотности жидкости, то силы притяжения молекул газа очень малы и равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно ее поверхности.
Таким образом, поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь и, тем самым, сократить поверхность жидкости.
Этим объясняется шарообразная форма капли жидкости (шар имеет минимальную поверхность).
При увеличении поверхности, например, при растяжении жидкой пленки, некоторое число молекул из внутренних областей жидкости переходит на поверхность. Этот переход молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы.
Работа, затрачиваемая на увеличение площади поверхности жидкости, переходит в потенциальную энергию молекул поверхностного слоя – поверхностную энергию.
Поверхностная энергия, отнесенная к единице поверхности, называется поверхностным натяжением (ПН):
где 


В единицах СИ поверхностное натяжение измеряется в Дж/м 2 или Н/м, так как Дж=Н . м.
Единица измерения ПН [Н/м] соответствует представлению о ПН как о силе, отнесенной к единице длины контура поверхности, направленной вдоль поверхности и стремящейся ее уменьшить.
Так как ПН определяется работой создания единицы площади поверхности, расходуемой на разрыв межмолекулярных связей, то чем прочнее межмолекулярные связи, тем больше ПН жидкости (например, вода ПНводы=71,95 мН/м, бензол ПНбензола=28,2 мН/м при 25 0 С).
С повышением температуры ПН снижается, т.к. ослабляются межмолекулярные связи.
Таким образом, поверхностная энергия – это прямое проявление межмолекулярных взаимодействий.
Молекулы, находящиеся на поверхности жидкости или твердого тела испытывают воздействие неуравновешенных молекулярных сил, вследствие чего получают дополнительную энергию по сравнению с молекулами, которые находятся внутри жидкости или твердого тела.
Проявляет себя поверхностная энергия как сила, которая стремится уменьшить площадь поверхности до минимально возможной величины.
В твердых телах подвижность молекул на поверхности отсутствует, поэтому поверхностная энергия здесь не может наблюдаться в виде поверхностного натяжения. Измерять поверхностную энергию можно лишь косвенными методами.
Дополнительная свободная энергия на поверхности раздела двух конденсированных фаз называется межфазным натяжением.
ПН и межфазное натяжение являются важными характеристиками, потому что они определяют ход важных технологических процессов.
Эти показатели важны для устойчивости дисперсий, суспензий, эмульсий и других дисперсных систем.
Существует ряд независимых методов оценки ПН, среди которых различают статистические и динамические, косвенные и непосредственные.
Оценка ПН жидкостей из родственных
Поскольку ПН есть проявление действия межмолекулярных сил, эта характеристика связана с другими свойствами, в основе которых лежит действие межмолекулярных сил, например, с энергией когезии.
Известно эмпирическое сооотношение между ПН и плотностью энергии когезии (
где 
Связь между ПН, энергией когезии и мольным объемом для низкомолекулярных соединений устанавливает соотношение:
где 


Расчет ПН из аддитивной функции через парахор:


Парахор – аддитивная величина. Понятие парахора ввел Сагден.
Межфазное натяжение на поверхности раздела
твердое тело-жидкость. Смачивание.
Капля жидкости на поверхности твердого тела может вести себя различно (рис. 6.2):
Рис. 6.2. Контактные углы, образованные жидкостями на поверхности твердого тела:
S — твердое тело;
L — капля жидкости;

Если жидкость смачивает твердое тело, то она стремится растечься по поверхности.
Контактный угол при этом равен 0 (рис. 6.2а), т.е. при полном смачивании q=0, а cos q=1.
Краевой угол q является мерой смачивания. Он определяется как угол между твердой поверхностью и касательной в точке соприкосновения трех фаз. Угол q отсчитывается в сторону жидкой фазы.
В случае жидкости L2 (рис. 6.2б) тенденция к растеканию по поверхности менее выражена и угол 0 0 .
В третьем примере жидкость не смачивает поверхность (рис. 6.2в) и контактный угол превышает 90 0 . Жидкость стремится уменьшить площадь контакта с твердым телом.
В состоянии равновесия:
Величина 
Уравнение известно как соотношение Юнга-Дюпре, которое устанавливает условие равновесия сил, из которого можно определить ПН твердого тела или межфазное натяжение:
Поверхностные натяжения рассмотрены как силы, приложенные перпендикулярно к единице длины периметра смачивания и действующие по касательной к соответствующим поверхностям (рис. 6.3).
Рис. 6.3. Действие трех сил (пограничных) поверхностного натяжения.
Смачиванию благоприятствует низкая свободная энергия поверхности раздела, высокая поверхностная энергия твердого тела и низкая свободная энергия поверхности жидкости.




Величины 



При этом различают силы когезии (слипания) и адгезии (прилипания).
Первые действуют между молекулами внутри фазы, вторые – в разных фазах.
Работа когезии 
Поскольку при этом образуется две новых поверхности жидкости, то:
Работа адгезии 
(Свободная энергия уменьшается за счет работы сил взаимодействия).
Из этих двух уравнений следует уравнение, известное как уравнение Дюпре:
По этому уравнению вычисляют 



Таким образом силы межфазного взаимодействия (адгезионные силы) стремятся растянуть каплю, а силы когезии стягивают каплю, препятствуя растеканию.
Определение 

Эта величина определяется как значение 



Жидкость с 
Если Г>0 адсорбцию называют положительной, если Г 0, концентрация растворенного вещества в поверхностном слое будет уменьшаться: Г 2 поверхности, кмоль/м 2 ;

Зная Г можно рассчитать площадь S, приходящуюся на 1 молекулу.
Число адсорбированных молекул на 1 м 2 составляет:
С увеличением Г величина S уменьшается и при 

Пользуясь 



Строят изотерму ПН (зависимость 
По изотерме ПН рассчитывают Г по уравнению Гиббса.
Для этого к кривой 




Рис. 6.5. Построение изотермы адсорбции по изотерме
Каждой концентрации С соответствует отрезок Z на оси ординат.
Длина отрезка, выраженная в единицах ПН равна: 

Подставив полученные значения Z в уравнение:
Используя Z для ряда концентраций, рассчитывают адсорбцию Г.
Строят изотерму адсорбции, откладывая по оси абсцисс С, а по оси ординат Г.
Где сложно провести касательную (в интервале концентраций 0,2-0,15 моль/л) рассчитывают изменение: 


Данные заносят в таблицу:
Значение 
Рис. 6.6. График уравнения Ленгмюра в прямолинейных координатах.
Угол 


Отрезок 
Из этого уравнения определяем 
Из уравнения 



http://xumuk.ru/colloidchem/35.html
http://studizba.com/lectures/107-himija/1417-kolloidnaja-himija/26138-6-poverhnostnaja-jenergija-i-poverhnostnoe-natjazhenie.html