Второй закон термодинамики для замкнутых и незамкнутых систем.
Второй закон термодинамики для замкнутых и незамкнутых систем.
- Введение. Первая формулировка второго закона термодинамики.
- Второй закон термодинамики для замкнутых систем.
- Второй закон термодинамики незамкнутых систем
- Заключение.
Введение. Первая формулировка второго закона термодинамики.
Как и первый, второй закон термодинамики был установлен опытным путём. Впервые этот закон сформулировал физик по имени Клаузиус. Тогда он звучал так «теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении».
Современная формулировка второго закона термодинамики выглядит следующим образом: самопроизвольные процессы в природе идут с увеличением энтропии. Энтропия — мера хаотичности, неупорядоченности системы, мера неопределенности.
Второй закон термодинамики для замкнутых систем.
Для примера рассмотрим замкнутую систему, состоящую из двух контактирующих тел с разными температурами. Каждый может утверждать, что тепло пойдет от тела с большей температурой к телу с меньшей. Та кое распределение тепла будет продолжаться до тех пор, пока температуры обоих тел не выровняются. В результате этого процесса от одного тела к другому будет передано определенное количество тепла, равное dQ. А энтропия при этом у первого тела уменьшится на меньшую величину, чем она увеличится у второго тела (у тела, которое принимает теплоту). По определению энтропии, dS=dQ/T (обратите внимание на то, что температура находится в знаменателе). То есть, в результате такого самопроизвольного процесса энтропия системы из двух тел станет больше суммы энтропий этих тел до начала процесса. Иначе говоря, самопроизвольный процесс передачи тепла от тела с высокой Т к телу с более низкой Т привел к тому, что энтропия системы из этих двух тел увеличилась.
В начале опыта мы указали, что рассматриваемая система является замкнутой (или изолированной) — она не обменивается теплом с окружающей средой. Из рассмотренного нами примера вытекает еще одна формулировка второго закона термодинамики: при прохождении в изолированной системе самопроизвольных процессов энтропия системы возрастает. Иначе можно сказать, что энтропия изолированной системы стремится к максимуму, так как самопроизвольные процессы передачи тепла всегда будут происходить, пока есть перепады температур.
Второй закон термодинамики для замкнутых систем.
Теперь рассмотрим неизолированную систему, в которую поступает тепло. Естественно предположить, что ее энтропия будет увеличиваться еще больше, что опять же следует из определения энтропии: dS=dQ/T- тепло и энтропия пропорциональны по величине.
Для простоты понимания и запоминания второй закон термодинамики обычно формулируют для замкнутых систем. Хотя некоторые люди, по своей неграмотности, утверждают, что закон термодинамики действует только в изолированных системах, при необходимости легко доказать, что он действует точно также и для открытых систем в случае поступления в них тепла,
Ошибка в тексте? Выдели её мышкой и нажми
Остались рефераты, курсовые, презентации? Поделись с нами — загрузи их здесь!
Термодинамика замкнутых систем
Вы будете перенаправлены на Автор24
Термодинамическими системами, зачастую, будут называться не любые, а исключительно макроскопические системы, пребывающие в термодинамическом равновесии. Аналогичным образом, термодинамическими параметрами будут считаться такие параметры, которые могут характеризовать систему в термодинамическом равновесии.
Рисунок 1. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
В свою очередь, внутренние параметры системы будут подразделяться на определенные разновидности:
- интенсивные (не зависимые от массы и количества частиц в системе), способны принимать в каждой ее точке определенные значения;
- экстенсивные (пропорциональны массе или числу частиц в системе), еще называются аддитивными и характеризуют систему в формате целого.
Разновидности систем в термодинамике
Рисунок 2. Типы термодинамических систем. Автор24 — интернет-биржа студенческих работ
Системы в термодинамике подвержены классификации следующим образом:
- замкнутая (изолированная) система (система с отсутствующим энергообменом с внешними телами, также они не обмениваются веществом и информацией);
- закрытая система (здесь наблюдается исключительно энергетический обмен);
- адиабатно изолированная система (наблюдается наличие энергообмена исключительно в формате теплоты);
- открытая система (здесь уже присутствует три вида обмена: информацией, веществом и энергией).
Готовые работы на аналогичную тему
На базе первого начала термодинамики, внутренняя энергия системы представляет однозначную функцию ее состояния, а изменение осуществляется исключительно в условиях воздействия внешних факторов. Первое начало можно сформулировать в таких видах:
- появление и ликвидация энергии становятся невозможными;
- любая форма движения в состоянии и обязана становиться любой иной формой движения;
- внутренняя энергия представляет собой однозначную форму состояния;
- исключается возможность вечного двигателя первого рода;
- бесконечно малое изменение внутренней энергии считается полным дифференциалом;
- исключается зависимость суммы количества теплоты и работы от пути процесса.
Первый закон термодинамики постулированием закона сохранения энергии для термодинамической системы не может указывать направление выполняемых в природе процессов, которое устанавливает второе начало термодинамики.
Второй закон термодинамики для замкнутых систем
Рисунок 3. Второй закон термодинамики. Автор24 — интернет-биржа студенческих работ
При изучении второго закона термодинамики, для лучшего понимания замкнутых систем, стоит рассматривать такой вид систем на примерах. Так, можно рассмотреть замкнутую систему, состоящую из двух контактирующих между собой тел с различными температурами. Тепло при этом начнет передаваться от тела с большей температурой к телу, обладающему меньшей.
Подобный принцип теплового распределения будет продолжительным до того момента, пока температуры этих двух тел не выровняются. В итоге такого процесса, будет наблюдаться передача от одного тела к другому конкретного количества тепла, энтропия при этом (у первого) снизится на величину, более меньшую, сравнительно с увеличением у второго тела (не принимающего теплоту).
Вследствие подобного самопроизвольного процесса, энтропия системы из двух тел окажется большей, чем сумма энтропий этих тел до начала процесса. Другими словами, самопроизвольный процесс теплопередачи от тела с высокой температурой телу с более низкой спровоцировал увеличение энтропии системы из данных двух тел.
Это создает еще одну формулировку второго закона термодинамики: в условиях прохождения в изолированной системе самопроизвольных процессов, наблюдается возрастание энтропии. Другими словами, энтропия подобной системы стремится к своему максимуму, поскольку самопроизвольные процессы теплопередачи всегда будут происходить при перепадах температур.
Суть термодинамики замкнутых систем
В природе не существует термодинамических систем замкнутого типа. Термодинамические процессы обязательно будут сопровождаться фазовыми переходами вещества, по той причине, что даже у гелия – (наиболее инертного из газов) присутствует в нормальных условиях 0,08196% молекул, пребывающих в состоянии динамического равновесия с атомами. То есть коэффициент конденсации не равен единичному значению.
Неравновесность системы определяется за счет градиента частоты ее осцилляторов, сама система стремится к равновесию (равенство частот). Распространение энергии происходит исключительно от большей частоты к меньшей. Обратный процесс допускается через третье тело, которое испытывает в этот момент фазовый переход.
Теплопроводность является энергопроводностью, когда осцилляторы, обладающие большей частотой, производят передачу ее осцилляторам с меньшей, что происходит за счет конвективного перемешивания.
Несмотря на равенство такого пути по своей протяженности половине расстояния до Луны, он оказывается при этом совершенно не затратным. Это объясняется тем фактом, что в объеме глобулы осциллятор оказывается единственным телом, перемещающимся в истинном вакууме. Наряду с тем, перемещение глобулы в отношении соседних сопровождается определенным трением и по этой причине представляет собой процесс, энергетически затратный.
Коэффициент энергопередачи (теплопередачи) в естественных условиях, например, при конвекции, у стенки будет пропорциональным частоте осцилляторов пристенного слоя, ее шероховатости, критическому расстоянию непосредственного взаимодействия осцилляторов и также обратно пропорциональным объему глобул газа вдали от стенки.
Таким образом, механизм возникновения конвективного тока газа будет логично представлять в таком формате: допустим, что одна глобула на дне получит приращение частоты и энергии. Ее объем при этом будет возрастающим, плотность станет меньше, и тогда произойдет ее всплытие с заталкиванием соседствующих глобул (на ее месте при этом окажется другая глобула, которая далее направится вверх ровно следом за первой). Таким способом появляется элементарный восходящий конвекционный ток.
Уравнение первого закона термодинамики для закрытых систем
Подставив в общее уравнение первого закона термодинамики
выражения для элементарного количества теплоты dq = Tds и элементарной работы расширения dl = pdu, получим уравнение первого закона термодинамики для равновесных термодинамических процессов в закрытой термодинамической системе:
Если система совершает только работу расширения, то будет получено основное уравнение термодинамики:
При предыдущем рассмотрении было установлено, что ни теплота, ни работа не являются функциями состояния системы, то есть они зависят от вида термодинамического процесса. Является ли функцией процесса внутренняя энергия или же эта величина обладает иными свойствами?
Для ответа на этот вопрос рассмотрим круговой термодинамический процесс (цикл) и укажем еще одну формулировку первого закона термодинамики.
Уравнение первого закона термодинамики для цикла записывается следующим образом:
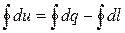
А еще одна формулировка первого закона термодинамики звучит так: вечный двигатель первого рода не существует, то есть такой двигатель, который давал бы полезную работу без затраты энергии извне. Это означает, что окружающая среда, получив определенное количество энергии за цикл в форме работы, должна отдать такое же количество энергии в форме теплоты:
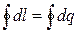
Тогда уравнение первого закона термодинамики для цикла может быть записано в виде:
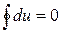
Эта форма записи указывает на то, что при осуществлении кругового термодинамического процесса (цикла) система возвращается в исходное состояние и внутренняя энергия системы остается без изменений. Таким образом, внутренняя энергия является функцией состояния системы, то есть таким же термодинамическим параметром, как, например, удельный объем, температура, давление, и изменение внутренней энергии не зависит от вида термодинамического процесса.
Следовательно, величины, упоминавшиеся до сих пор в связи с анализом энергетических взаимодействий системы, могут быть разделены на две группы: функции состояния (термодинамические параметры) и функции процесса.
Для определения изменения любой функции состояния в результате осуществления термодинамического процесса достаточно найти разность между конечным и начальным значениями анализируемой функции состояния. Например,
— изменение внутренней энергии
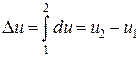
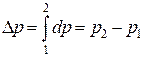
Для функций процесса dq и dl такого понятия как «изменение при осуществлении термодинамического процесса» не существует. Эти величины представляют собой лишь бесконечно малые количества передаваемой системе (или системой в окружающую среду) энергии в форме теплоты или работы. И для вычисления интегралов от этих величин необходимо знать уравнения процессов:
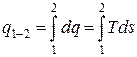
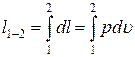
Итак, первый закон термодинамики для закрытых систем может быть записан в дифференциальной и интегральной формах:
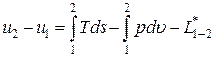
Если система совершает только работу расширения, то эти уравнения будут записаны следующим образом:
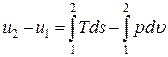
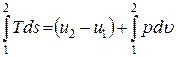
http://spravochnick.ru/fizika/termodinamika/termodinamika_zamknutyh_sistem/
http://helpiks.org/6-237.html
