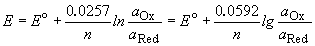Уравнение зависимости эдс от температуры в гальваническом элементе
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.1 Электрические потенциалы на фазовых границах
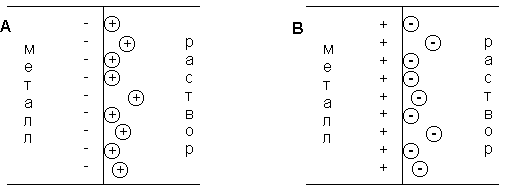
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.12а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая:
Рис. 3.12 Схема двойного электрического слоя на границе электрод-раствор
1. С Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО4 2- (рис. 3.12b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
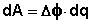
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
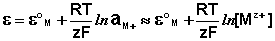
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
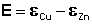
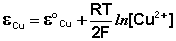
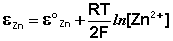
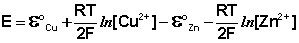
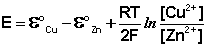
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
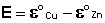
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] 2+ ] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
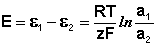
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright © С. И. Левченков, 1996 — 2005.
Уравнение зависимости эдс от температуры в гальваническом элементе
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
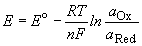
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
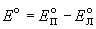
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
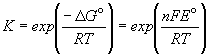
Константа равновесия реакции, протекающей в элементе Даниэля, равна
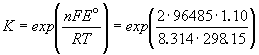
Зная температурный коэффициент ЭДС 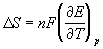




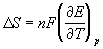
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электрод
Электродная реакция
E o , В
PbSO4 + 2H2O
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В

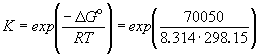
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 

Отсюда, полагая 
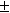
Пример 12-3. 

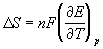



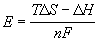
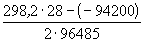
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Определение термодинамических характеристик электрохимических цепей
Лабораторная работа № 1
Определение термодинамических характеристик электрохимических цепей.
Система, состоящая из двух электродов, помещенных в раствор электролита, которая при соединении электродов вне электролита каким-либо металлическим проводником создает во внешней цепи электрический ток, называется гальваническим (или электрохимическим) элементом.
Условная запись (схема) гальванического элемента
Для описания гальванических элементов применяется условная запись, в соответствии с которой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо двумя вертикальными линиями, когда считают, что на границе растворов нет скачка потенциала, либо пунктирной линией, когда таким скачком пренебречь нельзя. Так, медно-цинковый элемент может быть записан следующим образом:
где знаки + и – указывают полярность электродов; c1 и c2 – концентрации растворов.
При большой разнице между c1 и c2, когда нельзя пренебречь скачком потенциала на границе двух растворов, этот элемент записывают в другом виде:
(-)Zn½ZnSO4
В тех же случаях, когда хотят указать только участвующие в электродных реакциях ионы, запись упрощают:
Для обратимо работающего гальванического элемента ток всегда должен идти слева направо, а на концах быть один и тот же металл.
Устройство медно-цинкового гальванического элемента (элемента Даниэля-Якоби) показано на рисунке.
Рисунок — Медно-цинковый элемент (элемент Даниэля-Якоби):
1 – пористая диафрагма; 2 – цилиндрический электрод из листового цинка; 3 – медный электрод.
При замыкании электродов через внешнюю цепь на медном электроде пойдет процесс восстановления меди:
а на цинковом электроде – процесс окисления цинка:
Электроны, остающиеся на электроде при реакции окисления, будут перетекать во внешней цепи от цинка к меди, где будут участвовать в процессе восстановления меди. В растворе при работе гальванического элемента ток будет переноситься ионами меди и цинка, движущимися к цинковому электроду, и сульфат-ионами, движущимися к медному электроду.
Равновесные потенциалы медного и цинкового электродов связаны с активностями ионов меди и цинка в растворе уравнением Нернста:
Электродвижущая сила (ЭДС) гальванического элемента. Стандартная ЭДС
Разность равновесных потенциалов электродов гальванического элемента называется электродвижущей силой этого элемента. Для элемента Даниэля-Якоби это можно выразить:

где 
Стандартная ЭДС обратимо работающего гальванического элемента равна разности стандартных потенциалов отдельных электродов гальванического элемента, причем, так как ЭДС всегда положительная величина, от положительного потенциала отнимается отрицательный потенциал.
Вывод уравнения Нернста для гальванического элемента
Если в электрохимической системе обратимо и изотермически протекает следующая реакция:

при 
и обратимая ЭДС ( ЕP, T) системы определяется как:
В то же время изменение энергия Гиббса реакции определяется формулой:
и так как 
где 
В состоянии равновесия при данных давлении и температуре 
Если активности всех компонентов равны единице (аi=1), то 


где Ка — константа равновесия реакции. Из этого следует, что:
Если аi = 1, то 
где Е0 — стандартная ЭДС. Полученное после подстановки уравнение называется уравнением Нернста:


Обратимые и необратимые гальванические элементы
Гальванические элементы могут быть обратимыми и необратимыми. Гальванический элемент является обратимым, если токообразующая реакция в элементе может быть обращена в противоположном направлении при приложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно малую величину. Примером обратимых гальванических элементов может служить элемент Даниэля-Якоби (если пренебречь переходом ионов через границу растворов):
В этом элементе при его работе будет иметь место реакция:
Zn + CuSO4 ® Cu + ZnSO4
Если к элементу приложить внешнюю ЭДС, противоположно направленную относительно ЭДС элемента, то в нем будет идти реакция:
Cu + ZnSO4 ® CuSO4+ Zn,
т. е. в отличие от токообразующей реакции в элементе медь начнет растворяться, а цинк – выделяться из раствора.
Примером необратимого элемента может служить цепь:
В этом элементе при его работе будет идти процесс:
Zn + CuSO4 ® ZnSO4+Cu
Если приложить к нему внешнюю противоположно направленную ЭДС, то будет происходить процесс растворения меди на медном электроде и ее выделение на цинковом, т. е. этот процесс не будет обратным процессу при работе такого гальванического элемента.
Термодинамические характеристики гальванического элемента
Работа какого-либо обратимого процесса при определенных ограничениях, налагаемых на условия осуществления процесса, например при постоянстве температуры и давления, будет максимальной полезной работой, поэтому термодинамический расчет ЭДС возможен только в случае обратимых гальванических элементов. Зависимость максимальной полезной работы химической реакции в гальваническом элементе от температуры можно связать с уравнениями Гиббса-Гельмгольца:
Максимальная полезная работа электрохимической реакции равна
Подставляя в уравнения Гиббса-Гельмгольца вместо DG и DF их значения, выраженные через ЭДС, можно получить эти уравнения в форме, связывающей ЭДС с тепловым эффектом реакции и температурой:
где ¶Е/¶T – температурный коэффициент, который показывает во сколько раз изменяется ЭДС при увеличении температуры на 1 К.
Или, учитывая, что — DН=Qp – тепловой эффект реакции при постоянном давлении, а — DU=Qv — тепловой эффект реакции при постоянном объеме, можно получить уравнения Томсона, являющиеся частным случаем уравнений Гиббса-Гельмгольца:
В том случае, когда ЭДС гальванического элемента не зависит от температуры, т. е. (¶Е/¶T)р=0 или (¶Е/¶T)v=0, эти уравнения переходят в:
Если ¶Е/¶T > 0, то 
http://www.chem.msu.su/rus/teaching/eremin/12.html
http://pandia.ru/text/80/353/3320.php