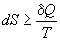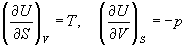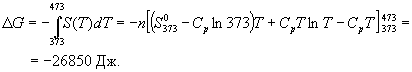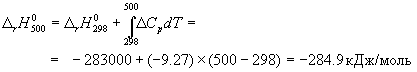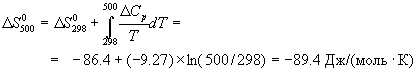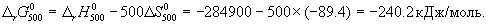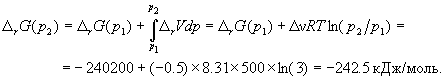Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
- Если ΔН о Т о Т > 0, то ΔG о Т
- Если ΔН о Т > 0, ΔS о Т о Т > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔН о Т о Т о Т о /ΔS о (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔН о Т > 0, ΔS о Т > 0, то ΔG о Т ΔН о / ΔS о (процесс идет при высокой температуре за счет энтропийного фактора).
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Объяснить знак и величину ΔS о .
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔG о f,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| S о 298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
Энергия Гиббса. Энергия Гельмгольца. Направление процесса.
Чтобы дать ответ на вопрос о возможности протекания той или иной реакции, о ее направлении и глубине необходимо снова воспользоваться II – законом термодинамики, который может быть сформулирован следующим образом: любой самопроизвольно протекающий процесс, а также и химическая реакция, идет в том направлении, которое сопровождается уменьшением свободной энергии в системе (при постоянных температуре и давлении) или энергии Гельмгольца (при постоянных температуре и объеме).
Свободная энергия или Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы.
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы.
При протекании химических реакций единовременно совершаются два направления: стремление простых частиц объединиться в более сложные, а также стремление сложных частиц к распаду на более простые.
Они не зависят друг от друга и их величины противоположны, и процесс идет в сторону той реакции, при которой изменение величины больше. Разность между этими величинами определяет свободную энергию реакции (при постоянных температуре и давлении). Ее изменение в реакции определяется разностью сумм энергий Гиббса конечных продуктов реакции и исходных веществ:
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией следующим выражением:
Здесь изменение энергии Гиббса учитывает одновременно изменение энергетического запаса системы и степень ее беспорядка (самопроизвольность протекания процесса).
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
- Если ΔG отрицательно (ΔG 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Энтальпийный и энтропийный факторы и направление процесса
Выясним, как функция свободной энергии зависит от изменений энтропии и энтальпии идущего процесса. Вернемся к выражению, связывающему энергию Гиббса с энтальпией и энтропией:
Без энтропийных факторов все экзотермические реакции (ΔH˂0) должны были быть самопроизвольными. Но энтропийный фактор, который определяется величиной – TΔS, может привести к росту или, наоборот, к падению способности самопроизвольного протекания.
Так, при ΔS>0, член – TΔS вносит отрицательный вклад в общую величину ΔG, следовательно он повышает возможность реакции протекать самопроизвольно.
А при при ΔS 0 Изменение энергии Гиббса. Для удобства принято сравнивать значения ΔG при стандартных условиях – концентрации равны 1 моль/л, парциальное давление газообразных веществ равно 101,3 кПа, температура 298,15 К. Тогда свободную энергию обозначают через ΔG 0 , на основе значений которой можно вычислить изменение энергии Гиббса химической реакции: Величина ΔG 0 р-ции позволяет определить, будет ли данная реакция, находящаяся в стандартных условиях, протекать самопроизвольно в прямом или обратном направлении. Аналогично теплоте образования, энергии Гиббса образования простых веществ равны нулю. Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением: Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением: ΔA — величина, которая не зависит от пути, а зависит только от исходного и конечного состояния системы, т.е. ΔA также, как и другие рассмотренные термодинамические величины, является функцией состояния. Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых А уменьшается. Таким образом, при ΔA 0 – в обратном направлении, а при ΔA=0 система находится в состоянии равновесия. Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия: Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура. Если K>>1, т.е. реакция идет в прямом направлении, то ΔG 0 ˂˂0. Если K 0 >>0 Если K=1, то ΔG 0 =0 В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG 0 можно связать с ЭДС гальванического элемента следующим соотношением: ΔG 0 =-nFE 0 , где nF – количество прошедшего электричества E 0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии. При самопроизвольном протекании процесса, его ΔG 0. Порог реакционной способности веществ для большинства реакций имеет значение ΔG 0 ≈41 кДж/моль. То есть, если ΔG 0 0 >+41 кДж/моль, то процесс неосуществим в любых реальных и стандартных условиях. Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала: В скобках указаны термодинамические параметры, которые получили название естественных переменных для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле. Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала. Это уравнение можно записать в четырех эквивалентных формах: Эти уравнения записаны в упрощенном виде — только для закрытых систем, в которых совершается только механическая работа. Зная любой из четырех потенциалов как функцию естественных переменных, можно с помощью основного уравнения термодинамики найти все другие термодинамические функции и параметры системы (см. пример 5-1). Другой важный смысл термодинамических потенциалов состоит в том, что они позволяют предсказывать направление термодинамических процессов. Так, например, если процесс происходит при постоянных температуре и давлении, то неравенство, выражающее второй закон термодинамики: эквивалентно неравенству dGp,T 0 (мы учли, что при постоянном давлении Qp = dH), где знак равенства относится к обратимым процессам, а неравенства — к необратимым. Таким образом, при необратимых процессах, протекающих при постоянных температуре и давлении, энергия Гиббса всегда уменьшается. Минимум энергии Гиббса достигается при равновесии. Аналогично, любой термодинамический потенциал в необратимых процессах при постоянстве естественных переменных уменьшается и достигает минимума при равновесии: Потенциал Естественные Условие само-произвольности Условия S = const, V = const dU 2 U > 0 S = const, p = const dH 2 H > 0 T = const, V = const dF 2 F > 0 T = const, p = const dG 2 G > 0 Наибольшее значение в конкретных термодинамических расчетах имеют два последние потенциала — энергия Гельмгольца F и энергия Гиббса G , т.к. их естественные переменные наиболее удобны для химии. Другое (устаревшее) название этих функций — изохорно-изотермический и изобарно-изотермический потенциалы. Они имеют дополнительный физико-химический смысл. Уменьшение энергии Гельмгольца в каком-либо процессе при T = const, V = const равно максимальной механической работе, которую может совершить система в этом процессе: Таким образом, энергия F равна той части внутренней энергии (U = F + TS), которая может превратиться в работу. Аналогично, уменьшение энергии Гиббса в каком-либо процессе при T = const, p = const равно максимальной полезной (т.е., немеханической) работе, которую может совершить система в этом процессе: Зависимость энергии Гельмгольца (Гиббса) от объема (давления) вытекает из основного уравнения термодинамики (5.3), (5.4): Зависимость этих функций от температуры можно описать с помощью основного уравнения термодинамики: или с помощью уравнения Гиббса-Гельмгольца: Расчет изменения функций F и G в химических реакциях можно проводить разными способами. Рассмотрим два из них на примере энергии Гиббса. 1) По определению, G = H — TS. Если продукты реакции и исходные вещества находятся при одинаковой температуре, то стандартное изменение энергии Гиббса в химической реакции равно: где тепловой эффект можно рассчитать с помощью стандартных энтальпий образования, а стандартное изменение энтропии — по абсолютным энтропиям участников реакции. 2) Аналогично тепловому эффекту реакции, изменение энергии Гиббса можно рассчитать, используя энергии Гиббса образования веществ: В термодинамических таблицах обычно приводят абсолютные энтропии и значения термодинамических функций образования соединений из простых веществ при температуре 298 К и давлении 1 бар (стандартное состояние). Для расчета rG и rF при других условиях используют соотношения (5.5) — (5.7). Все термодинамические потенциалы являются функциями состояния. Это свойство позволяет найти некоторые полезные соотношения между частными производными, которые называют соотношениями Максвелла. Рассмотрим выражение (5.1) для внутренней энергии. Т.к. dU — полный дифференциал, частные производные внутренней энергии по естественным переменным равны: Если продифференцировать первое тождество по объему, а второе — по энтропии, то получатся перекрестные вторые частные производные внутренней энергии, которые равны друг другу: Три другие соотношения получаются при перекрестном дифференцировании уравнений (5.2) — (5.4). ПРИМЕРЫ Пример 5-1. Внутренняя энергия некоторой системы известна как функция энтропии и объема, U(S,V). Найдите температуру и теплоемкость этой системы. Решение. Из основного уравнения термодинамики (5.1) следует, что температура — это частная производная внутренней энергии по энтропии: Изохорная теплоемкость определяет скорость изменения энтропии с температурой: Воспользовавшись свойствами частных производных, можно выразить производную энтропии по температуре через вторую производную внутренней энергии: Пример 5-2. Используя основное уравнение термодинамики, найдите зависимость энтальпии от давления при постоянной температуре: а) для произвольной системы; б) для идеального газа. Решение. а) Если основное уравнение в форме (5.2) поделить на dp при постоянной температуре, получим: Производную энтропии по давлению можно выразить с помощью соотношения Максвелла для энергии Гиббса (5.13): б) Для идеального газа V(T) = nRT / p. Подставляя эту функцию в последнее тождество, получим: Энтальпия идеального газа не зависит от давления. Пример 5-3. Выразите производные Решение. Основное уравнение термодинамики (5.1) можно переписать в виде: представив энтропию как функцию внутренней энергии и объема. Коэффициенты при dU и dV равны соответствующим частным производным: Пример 5-4. Два моля гелия (идеальный газ, мольная теплоемкость Cp = 5/2 R) нагревают от 100 о С до 200 о С при p = 1 атм. Вычислите изменение энергии Гиббса в этом процессе, если известно значение энтропии гелия, Решение. Изменение энергии Гиббса при нагревании от 373 до 473 К можно найти, проинтегрировав частную производную по температуре (5.6): Зависимость энтропии от температуры при постоянном давлении определяется изобарной темлоемкостью: Интегрирование этого выражения от 373 К до T дает: Подставляя это выражение в интеграл от энтропии, находим: Процесс нагревания не обязан быть самопроизвольным, т.к. уменьшение энергии Гиббса служит критерием самопроизвольного протекания процесса только при T = const и p = const. Ответ. G = -26850 Дж. Пример 5-5. Рассчитайте изменение энергии Гиббса в реакции при температуре 500 K и парциальных давлениях 3 бар. Будет ли эта реакция самопроизвольной при данных условиях? Газы считать идеальными. Необходимые данные возьмите из справочника. Решение. Термодинамические данные при температуре 298 К и стандартном давлении 1 бар сведем в таблицу: Вещество Энтальпия образования Энтропия Теплоемкость Реакция CO + ЅO2 = Примем, что Cp = const. Изменения термодинамических функций в результате реакции рассчитаны как разность функций реагентов и продуктов: f = f(CO2) — f(CO) — Ѕ f(O2). Стандартный тепловой эффект реакции при 500 К можно рассчитать по уравнению Кирхгофа в интегральной форме (3.8): Стандартное изменение энтропии в реакции при 500 К можно рассчитать по формуле (4.9): Стандартное изменение энергии Гиббса при 500 К: Для расчета изменения энергии Гиббса при парциальных давлениях 3 атм необходимо проинтегрировать формулу (5.5) и использовать условие идеальности газов ( V = n RT / p, n — изменение числа молей газов в реакции): Эта реакция может протекать самопроизвольно при данных условиях. Ответ. G = -242.5 кДж/моль. ЗАДАЧИ 5-1. Выразите внутреннюю энергию как функцию переменных G, T, p. 5-2. Используя основное уравнение термодинамики, найдите зависимость внутренней энергии от объема при постоянной температуре: а) для произвольной системы; б) для идеального газа. 5-3. Известно, что внутренняя энергия некоторого вещества не зависит от его объема. Как зависит давление вещества от температуры? Ответ обоснуйте. 5-4. Выразите производные 5-5. Напишите выражение для бесконечно малого изменения энтропии как функции внутренней энергии и объема. Найдите частные производные энтропии по этим переменным и составьте соответствующее уравнение Максвелла. 5-6. Для некоторого вещества известно уравнение состояния p(V, T). Как изменяется теплоемкость Cv с изменением объема? Решите задачу: а) в общем виде; б) для какого-либо конкретного уравнения состояния (кроме идеального газа). 5-7. Докажите тождество: 5-8. Энергия Гельмгольца одного моля некоторого вещества записывается следующим образом: где a, b, c, d — константы. Найдите давление, энтропию и теплоемкость CV этого тела. Дайте физическую интерпретацию константам a, b, d. 5-9. Нарисуйте график зависимости энергии Гиббса индивидуального вещества от температуры в интервале от 0 до T > Tкип. 5-10. Для некоторой системы известна энергия Гиббса: 5-11. Зависимость мольной энергии Гельмгольца некоторой системы от температуры и объема имеет вид: где a, b, c, d — константы. Выведите уравнение состояния p(V,T) для этой системы. Найдите зависимость внутренней энергии от объема и температуры U(V,T). Каков физический смысл постоянных a, b, c? 5-12. Найдите зависимость мольной внутренней энергии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля) где B(T) — известная функция температуры. 5-13. Для некоторого вещества зависимость теплоемкости от температуры имеет вид: CV = aT 3 при температуре 0 — 10 К. Найдите зависимость энергии Гельмгольца, энтропии и внутренней энергии от температуры в этом диапазоне. 5-14. Для некоторого вещества зависимость внутренней энергии от температуры имеет вид: U = aT 4 + U0 при температуре 0 — 10 К. Найдите зависимость энергии Гельмгольца, энтропии и теплоемкости CV от температуры в этом диапазоне. 5-15. Выведите соотношение между теплоемкостями: 5-16. Исходя из тождества 5-17. Один моль газа Ван-дер-Ваальса изотермически расширяется от объема V1 до объема V2 при температуре T. Найдите U, H, S, F и G для этого процесса. 5-18. Вычислите изменение H, U, F, G, S при одновременном охлаждении от 2000 К до 200 К и расширении от 0.5 м 3 до 1.35 м 3 0.7 молей азота (CV = 5/2 R). Энтропия газа в исходном состоянии равна 150 Дж/(моль . К), газ можно считать идеальным. 5-19. Вычислите изменение энергии Гиббса при сжатии от 1 атм до 3 атм при 298 К: а) одного моля жидкой воды; б) одного моля водяного пара (идеальный газ). 5-20. Изменение энергии Гиббса в результате испарения воды при 95 о С и 1 атм равно 546 Дж/моль. Рассчитайте энтропию паров воды при 100 о С, если энтропия жидкой воды равна 87.0 Дж/(моль . К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при 95 о С? 5-21*. Давление над одним молем твердой меди при температуре 25 о С увеличили от 1 до 1000 атм. Найти U, H, S, F. Медь считать несжимаемой, плотность 8.96 г/см 3 , изобарический коэффициент теплового расширения 5-22. Вычислите стандартную энергию Гиббса образования ( 5-23. Рассчитайте G o при 25 о С для химической реакции: Стандартные значения энтальпии образования и абсолютной энтропии при 25 о С равны: fH o (HСl) = -22.1 ккал/моль, fH o (H2O(ж)) = -68.3 ккал/моль; S o (HCl) = 44.6 кал/(моль . K), S o (O2) = 49.0 кал/(моль . K), S o (Сl2) = 53.3 кал/(моль . K), S o (H2O(ж)) = 16.7 кал/(моль . K). 5-24. Рассчитайте G o при 25 о С для химической реакции: Стандартные значения энтальпии образования и абсолютной энтропии при 25 о С равны: fH o (СO2) = -94.1 ккал/моль, fH o (СH4) = -17.9 ккал/моль, fH o (H2O(ж)) = -68.3 ккал/моль; S o (СO2) = 51.1 кал/(моль . K), S o (H2) = 31.2 кал/(моль . K), S o (СH4) = 44.5 кал/(моль . K), S o (H2O(ж)) = 16.7 кал/(моль . K). 5-25. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 300 о С для химической реакции: Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными. 5-26. Найдите энергию Гиббса образования NH3 при температурах 298 и 400 K, если известны следующие данные: NH3 35.7 Считать, что теплоемкости в указанном интервале температур постоянны. 5-27. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 60 о С для химической реакции: Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными. 5-28. Рассчитайте стандартные энергии Гиббса и Гельмгольца G o и F o при 700 о С для химической реакции: Может ли эта реакция протекать самопроизвольно при данной температуре? Теплоемкости веществ считать постоянными. Сервер создается при поддержке Российского фонда фундаментальных исследований http://zadachi-po-khimii.ru/obshaya-himiya/energiya-gibbsa-energiya-gelmgolca-napravlenie-processa.html http://www.chem.msu.su/rus/teaching/eremin1/1-5.htmlВсегда ˂0 Реакция самопроизвольна при любых температурах, обратная реакция всегда несамопроизвольна >0 ˂0 Всегда >0 Реакция несамопроизвольна при любых температурах, обратная реакция самопроизвольна ˂0 ˂0 При низких температурах ˂0, при высоких температурах >0 Реакция самопроизвольна при низких температурах, обратная реакция становится самопроизвольной при высоких температурах >0 >0 При низких температурах >0, при высоких температурах ˂0 Реакция несамопроизвольна при низких температурах, но при высоких температурах становится самопроизвольной Уравнение зависимости энергии гиббса от температуры
переменные
равновесия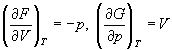
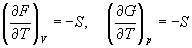
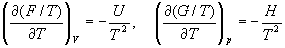
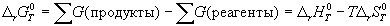

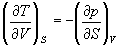
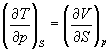
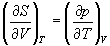
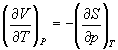
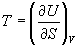
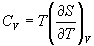
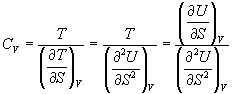
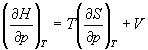
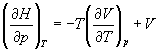
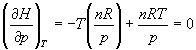
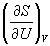
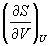
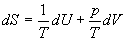
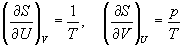
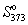
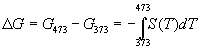
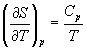
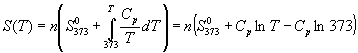
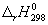
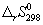
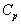
= CO2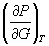
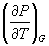
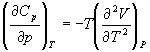
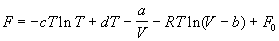
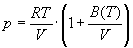
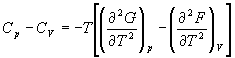
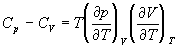
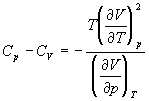
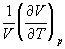
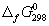
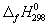
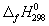
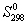
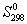
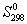
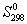
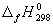
Cp,298, Дж/(моль . К) 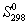
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору