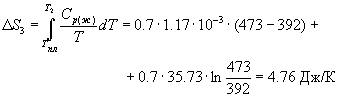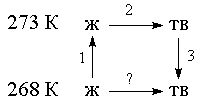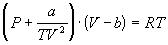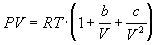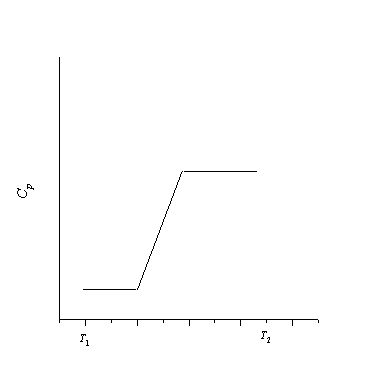Уравнение зависимости энтропии от температуры
Второй закон термодинамики устанавливает критерии необратимости термодинамических процессов. Известно много формулировок второго закона, которые эквивалентны друг другу. Мы приведем здесь только одну формулировку, связанную с энтропией.
Существует функция состояния — энтропия S, которая обладает следующим свойством:
, (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.
Для изолированных систем второй закон утверждает: dS і 0, (4.2) т.е. энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0,
d 2 S -23 Дж/К — постоянная Больцмана (k = R / NA), W — так называемая термодинамическая вероятность, т.е. число микросостояний, которые соответствуют данному макросостоянию системы (см. гл. 10). Формулу (4.4) называют формулой Больцмана.
С точки зрения строгой статистической термодинамики энтропию вводят следующим образом:
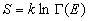
где G (E) — фазовый объем, занятый микроканоническим ансамблем с энергией E.
Термодинамическое определение энтропии основано на рассмотрении обратимых процессов:
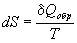
Это определение позволяет представить элементарную теплоту в такой же форме, как и различные виды работы:
Qобр = TdS, (4.7)
где температура играет роль обобщенной силы, а энтропия — обобщенной (тепловой) координаты.
Расчет изменения энтропии для различных процессов
Термодинамические расчеты изменения энтропии основаны на определении (4.6) и на свойствах частных производных энтропии по термодинамическим параметрам:
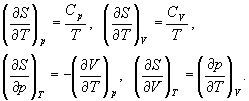
Последние два тождества представляют собой соотношения Максвелла (вывод см. в гл. 5).
1) Нагревание или охлаждение при постоянном давлении.
Количество теплоты, необходимое для изменения температуры системы, выражают с помощью теплоемкости: Qобр = Cp dT.
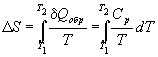
Если теплоемкость не зависит от температуры в интервале от T1 до T2, то уравнение (4.8) можно проинтегрировать:
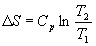
Если изменение температуры происходит при постоянном объеме, то в формулах (4.9) и (4.10) Cp надо заменить на CV.
2) Изотермическое расширение или сжатие.
Для расчета энтропии в этом случае надо знать уравнение состояния системы. Расчет основан на использовании соотношения Максвелла:
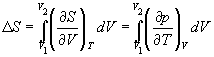
В частности, для изотермического расширения идеального газа (p = nRT / V)
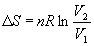
Этот же результат можно получить, если использовать выражение для теплоты изотермического обратимого расширения идеального газа: Qобр = nRT ln(V2/V1).
3) Фазовые переходы.
При обратимом фазовом переходе температура остается постоянной, а теплота фазового перехода при постоянном давлении равна Hфп, поэтому изменение энтропии равно:
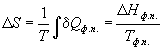
При плавлении и кипении теплота поглощается, поэтому энтропия в этих процессах возрастает: Sтв о С при давлении 1 атм. Мольная теплоемкость серы равна:
Температура плавления моноклинной серы 119 о С, удельная теплота плавления 45.2 Дж/г.
Решение. Общее изменение энтропии складывается из трех составляющих: 1) нагревание твердой серы от 25 до 119 о С, 2) плавление, 3) нагревание жидкой серы от 119 до 200 о С.
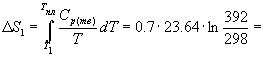
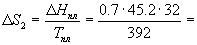
S = S1 + S2 + S3 = 11.88 Дж/К.
Пример 4-3. Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются изотермически от объема V1 до объема V2: а) обратимо; б) против внешнего давления p.
Решение. а) Изменение энтропии газа при обратимом изотермическом расширении можно найти с помощью термодинамического определения энтропии с расчетом теплоты расширения по первому закону:
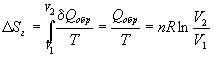
Так как расширение обратимое, то общее изменение энтропии Вселенной равно 0, поэтому изменение энтропии окружающей среды равно изменению энтропии газа с обратным знаком:
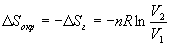
б) Энтропия — функция состояния, поэтому изменение энтропии системы не зависит от того, как совершался процесс — обратимо или необратимо. Изменение энтропии газа при необратимом расширении против внешнего давления будет таким же, как и при обратимом расширении. Другое дело — энтропия окружающей среды, которую можно найти, рассчитав с помощью первого закона теплоту, переданную системе:
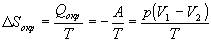
В этом выводе мы использовали тот факт, что U = 0 (температура постоянна). Работа, совершаемая системой против постоянного внешнего давления равна: A = p(V2—V1), а теплота, принятая окружающей средой, равна работе, совершенной системой, с обратным знаком.
Общее изменение энтропии газа и окружающей среды больше 0:
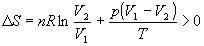
как и полагается для необратимого процесса.
Пример 4-4. Рассчитайте изменение энтропии 1000 г воды в результате ее замерзания при -5 О С. Теплота плавления льда при 0 о С равна 6008 Дж/моль. Теплоемкости льда и воды равны 34.7 и 75.3 Дж/(моль . К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс — самопроизвольный.
Решение. Необратимый процесс замерзания воды при температуре -5 О С можно представить в виде последовательности обратимых процессов: 1) нагревание воды от
-5 О С до температуры замерзания (0 О С); 2) замерзание воды при 0 О С; 3) охлаждение льда от 0 до -5 О С:
Изменение энтропии в первом и третьем процессах (при изменении температуры) рассчитывается по формуле (4.9):
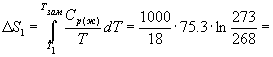
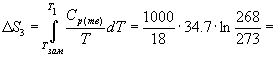
Изменение энтропии во втором процессе рассчитывается как для обычного фазового перехода (4.13). Необходимо только иметь в виду, что теплота при замерзании выделяется:
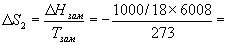
Т.к. энтропия — функция состояния, общее изменение энтропии равно сумме по этим трем процессам:
S = S1 + S2 + S3 = -1181 Дж/К.
Энтропия при замерзании убывает, хотя процесс самопроизвольный. Это связано с тем, что в окружающую среду выделяется теплота и энтропия окружающей среды увеличивается, причем это увеличение больше, чем 1181 Дж/К, поэтому энтропия Вселенной при замерзании воды возрастает, как и полагается в необратимом процессе.
ЗАДАЧИ
4-1. Приведите пример термодинамического процесса, который может быть проведен как обратимо, так и необратимо. Рассчитайте изменение энтропии системы и окружающей среды в обоих случаях.
4-2. Проверьте неравенство Клаузиуса для циклического процесса, представленного в задаче 2.14.
4-3. Рассчитайте мольную энтропию неона при 500 К, если при 298 К и том же объеме энтропия неона равна 146.2 Дж/(моль . К).
4-4. Рассчитайте изменение энтропии при нагревании 11.2 л азота от 0 до 50 о С и одновременном уменьшении давления от 1 атм до 0.01 атм.
4-5. Один моль гелия при 100 о С и 1 атм смешивают с 0.5 моль неона при 0 о С и 1 атм. Определите изменение энтропии, если конечное давление равно 1 атм.
4-6. Рассчитайте изменение энтропии при образовании 1 м 3 воздуха из азота и кислорода (20 об.%) при температуре 25 о С и давлении 1 атм.
4-7. Три моля идеального одноатомного газа (CV = 3.0 кал/(моль . К)), находящегося при T1 = 350 K и P1 = 5.0 атм, обратимо и адиабатически расширяются до давления P2 = 1.0 атм. Рассчитайте конечные температуру и объем, а также совершенную работу и изменение внутренней энергии, энтальпии и энтропии в этом процессе.
4-8. Рассчитайте изменение энтропии при нагревании 0.4 моль хлорида натрия от 20 до 850 о С. Мольная теплоемкость хлорида натрия равна:
Температура плавления хлорида натрия 800 о С, теплота плавления 31.0 кДж/моль.
4-9. Рассчитайте изменение энтропии при смешении 5 кг воды при 80 о С с 10 кг воды при 20 о С. Удельную теплоемкость воды принять равной: Cp(H2O) = 4.184 Дж/(г . К).
4-10. Рассчитайте изменение энтропии при добавлении 200 г льда, находящегося при температуре 0 о С, к 200 г воды (90 о С) в изолированном сосуде. Теплота плавления льда равна 6.0 кДж/моль.
4-11. Для некоторого твердого тела найдена зависимость коэффициента расширения от давления в интервале давлений от p1 до p2:
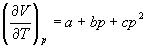
Насколько уменьшится энтропия этого тела при сжатии от p1 до p2?
4-12. Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются изотермически от давления p1 до давления p2: а) обратимо; б) против внешнего давления p 0 С и давлении 2 атм.
4-14. Нарисуйте график зависимости стандартной энтропии воды от температуры в интервале от 0 до 400 К.
4-15. Запишите энтропию одного моля идеального газа как функцию температуры и давления (теплоемкость считать постоянной).
4-16. Определите зависимость энтропии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля):
4-17. Определите зависимость энтропии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля):
4-18. Один моль газа описывается уравнением состояния
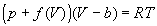
где f(V) — некоторая функция, которая не зависит от температуры. Рассчитайте изменение энтропии газа при его необратимом изотермическом расширении от объема V1 до объема V2.
4-19. Рассчитайте изменение энтропии 1000 г метанола в результате его замерзания при -105 О С. Теплота плавления твердого метанола при -98 о С (т.пл.) равна 3160 Дж/моль. Теплоемкости твердого и жидкого метанола равны 55.6 и 81.6 Дж/(моль . К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс — самопроизвольный.
4-20. Теплоемкость некоторого вещества в интервале температур от T1 до T2 изменяется следующим образом:
Постройте график зависимости энтропии вещества от температуры в этом интервале температур.
4-21. Пользуясь справочными данными, приведите пример самопроизвольной химической реакции, для которой стандартное изменение энтропии меньше 0.
4-22. Пользуясь справочными данными, рассчитайте стандартное изменение энтропии в реакции H2(г) + ЅO2(г) = H2O(г) а) при 25 о С; б) при 300 о С.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
- Если ΔН о Т о Т > 0, то ΔG о Т
- Если ΔН о Т > 0, ΔS о Т о Т > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔН о Т о Т о Т о /ΔS о (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔН о Т > 0, ΔS о Т > 0, то ΔG о Т ΔН о / ΔS о (процесс идет при высокой температуре за счет энтропийного фактора).
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Объяснить знак и величину ΔS о .
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔG о f,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| S о 298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
Энтропия идеального газа
В этой статье мы расскажем, что такое энтропия идеального газа и в чем заключается ее физический смысл. Начнем с определения.
Энтропия – это функция состояния системы ( S ) с дифференциалом в бесконечном обратимом процессе, равным d S = δ Q T .
Параметр δ Q обозначает элементарное тепло, которое сообщается системе. Соответственно, T – это общая температура системы.
Если у системы в обратимом процессе изменяется знак энтропии, то это говорит о смене направления обмена теплом. Основная формула дает нам возможность найти, на сколько изменилась величина энтропии. Важно подчеркнуть, что она будет верной только в том случае, если процесс будет обратим.
В чем состоит физический смысл энтропии
Свойства идеального газа таковы, что с их помощью удобно пояснять физический смысл энтропии. Допустим, у нас есть один моль некоторого газа, для которого мы можем записать первое правило термодинамики (в дифференциальной форме):
δ Q = d U + p d V .
Выполним деление левой и правой части выражения на температуру. У нас получится, что:
δ Q T = d U T + p d V T = c μ V d T T + p d V T .
Здесь c μ V = i 2 R . С помощью уравнения Менделеева-Клайперона мы можем выразить из него p T и получить:
p V = R T → p T = R V .
Подставляем это в исходное выражение:
δ Q T = c м V d T T + R d V V = d c м V ln T + R ln V .
Правая часть уравнения у нас получилась полностью дифференциальной, значит, и слева тоже должен быть полный дифференциал. Назовем его d S . С помощью одной из приведенных выше формул вычислим ∆ S в изотермическом процессе. Если температура остается постоянной, то и внутренняя энергия системы также остается прежней. Получаем следующее:
d S = R d ln V → ∫ ( 1 ) ( 2 ) d S = R ∫ ( 1 ) ( 2 ) d ln V = S 2 — S 1 = R ln V 2 V 1 .
Нам известно, что объем, занимаемый газом в равновесном состоянии, связан с количеством пространственных микросостояний частиц формулой Г 0 = N ! N — n ! ( Г 0 – общее количество микросостояний, N – количество ячеек, в которые помещены частица системы, n – общее количество частиц). Поскольку исходный объем идеального газа равен одному молю, то n = N A . Выведем формулу объемов V 1 и V 2 из выражения выше. Она будет иметь следующий вид:
Г 01 = N 1 ! N 1 — N A ! , Г 02 = N 2 ! N 2 — N A ! .
Здесь N 1 = V 1 l 3 , N 1 = V 2 l 3 , l = 10 — 10 м .
Для дальнейших преобразований нам потребуется формула Стирлинга (для больших n , n ! ≈ N 2 N 1 N A = V 2 V 1 N A ):
Г 02 Г 01 ≈ N 2 N 1 N A = V 2 V 1 N A .
Берем логарифм от этого выражения и получаем:
ln V 2 V 1 = 1 N A ln Г 02 Г 01 .
Таким образом, S 2 — S 1 = R ln V 2 V 1 = R N A ln Г 02 Г 01 = k ln Г 02 — k ln Г 01 .
Здесь параметр k обозначает постоянную Больцмана.
Формула Больцмана
Сам вид формулы энтропии говорит нам о том, что она может быть определена через логарифм числа микросостояний, образующих макросостояние, рассматриваемое как S = k ln Г .
Выведенное выше равенство называется формулой Больцмана. Она позволяет сделать вывод, что чем больше упорядоченность системы, тем меньше в ней микросостояний, с помощью которых достигается макросостояние. Поэтому энтропия является мерой упорядоченности системы. Максимальная энтропия достигается в состоянии упорядоченности.
Энтропия является аддитивной величиной. При S = c o n s t процесс называется изоэнтропийным. Если система является физически однородной, то ее энтропия выражается как функция двух независимых параметров состояния (масса считается постоянной).
Условие: есть идеальный газ, в котором происходит изотермическое расширение, при этом объем меняется от V 1 до V 1 . При этом температура системы в первом процессе равна T 1 , а во втором T 2 , причем вторая температура меньше, чем первая. Определите, как будет меняться значение энтропии.
Зная основное определение энтропии и обратимость процессов в идеальном газе, мы можем использовать формулу для вычисления ∆ S при постоянной температуре.
∆ S = ∫ ( 1 ) ( 2 ) δ Q T = 1 T ∫ ( 1 ) ( 2 ) δ Q .
Идеальный газ в физике – это понятие, подразумевающее, что мы можем пренебречь взаимодействием между его молекулами. Если V = c o n s t , то работа идеального газа равна 0 .
Обратимся к первому правилу термодинамики, зная, что при постоянной температуре d U = 0 :
Выражаем давление из уравнения Менделеева-Клайперона:
p V = ν R T → p = v R T V .
Подставляем в исходную формулу и получаем:
∆ S = 1 T ∫ ( 1 ) ( 2 ) н R T V d V = R T н T ∫ ( 1 ) ( 2 ) d V V = v R ln V 2 V 1
Ответ: поскольку не существует зависимости энтропии от температуры в изотермическом процессе, то в заданных условиях оба процесса будут иметь одинаковую энтропию.
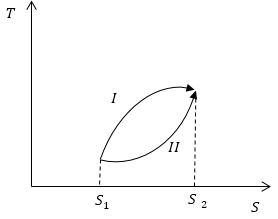
Условие: на рисунке схематично обозначены обратимые процессы. Сопоставьте, какие количества теплоты будут поглощаться системой в ходе обеих процессов.
Данная задача решается на основе определения энтропии для обратимых процессов.
Выражаем показатель δ Q из уравнения, выведенного ранее, и получаем:
Для определения объема подведенного к системе тепла нам нужно проинтегрировать выражение:
∆ Q = ∫ S 1 S 2 T d S .
Теперь, используя геометрическое свойство интеграла (по площади) и рисунок, мы можем подытожить, что площадь, ограниченная кривой процесса, изоэнтропами, перпендикулярными S , и осью S , больше площади для процесса 2 , значит, Q I > Q I I .
Ответ: в первом процессе поглощается большее количество теплоты, чем в во втором.
http://chemege.ru/entropy-gibbs-energy/
http://zaochnik.com/spravochnik/fizika/termodinamika/entropija-idealnogo-gaza/
 , (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.
, (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.