Химия, Биология, подготовка к ГИА и ЕГЭ
Ионные реакции — реакции между ионами в растворе
Давайте разберем основные ионные химические реакции неорганической и некоторые реакции органической химии.
Очень часто в различных заданиях по химии просят написать не только химические уравнения в молекулярной форме, но и в ионной (полные и сокращенные). Как уже было замечено, ионные химические реакции идут в растворах. Зачастую, вещества распадаются на ионы именно в воде.
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2Na + +2OH — +2H + + SO -2 = 2Na + + SO4 -2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
OH — + H + = H2O — сокращенное ионное уравнение реакции
По результатам этого сокращения одинаковых ионов видно, какие ионы образовали то, что нерастворимо или малорастворимо — газообразные продукты или реагенты, осадки или малодиссоциирующие вещества.
Не раскладывают на ионы в ионных химических реакциях вещества:
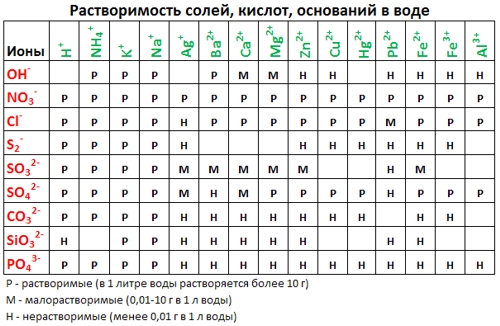
1. нерастворимые в воде соединения (или малорастворимые) (см. ТАБЛИЦЫ );
Сa 2+ + 2NO3 — + 2Na + +2OH — = Ca(OH)2 + 2Na + +2NO3 — — полное ионное уравнение реакции
Сa 2+ + 2OH — = Ca(OH)2 — сокращенное ионное уравнение реакции
2. газообразные вещества, например, O2, Cl2, NO и т.д.:
2Na + + S -2 + 2H + +2Cl — = 2Na + + 2Cl — + H2S — полное ионное уравнение реакции
S -2 + 2H + = H2S — сокращенное ионное уравнение реакции
3. малодиссоциирующие вещества (H2O, NH4OH);
OH — + H + = H2O — сокращенное ионное уравнение реакции
4. оксиды (все: и образованные металлами, и неметаллами);
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
2Ag + + 2NO3 — + 2Na + + 2OH — = Ag2O + 2NO3 — + 2Na + + H2O — полное ионное уравнение реакции
2Ag + + 2OH — = Ag2O + H2O — сокращенное ионное уравнение реакции
5. органические вещества (органические кислоты относят к малодиссоциирующим веществам)
CH3COOH + Na + + OH — = CH3COO — + Na + + H2O — полное ионное уравнение реакции
CH3COOH + OH — = CH3COO — + H2O — сокращенное ионное уравнение реакции
Зачастую ионные химические реакции — это реакции обмена .
Если все участвующие в реакции вещества находятся в виде ионов, то связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Отличительной особенностью химических реакций ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
- в ЕГЭ это вопрос А23 — Реакции ионного обмена
- в ГИА (ОГЭ) это А8— Реакции ионного обмена
Составление уравнений реакций ионного обмена
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный урок продолжает тему «Реакции ионного обмена». Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
Как составлять уравнения ионных реакций
Знания, необходимые для составления уравнений ионных реакций:
- умение отличать электролит от неэлектролита;
- умение составлять уравнения диссоциации электролитов;
- умение устанавливать значение зарядов ионов.
Таблица растворимости:
Таблица электрохимического ряда напряжений металлов:
В ионных уравнениях химические формулы веществ записывают в двух видах — в виде ионов, либо в виде молекул. Возникает естественный вопрос, — когда то или иное вещество надо записывать в виде иона или молекулы?
В виде ионов записывают формулы следующих веществ:
- сильные кислоты: H2SO4, HNO3, HI. ;
- сильные основания: KOH, NaOH, Ba(OH)2. ;
- растворимые в воде соли: KNO3, BaCl2, NaBr.
В виде молекул записывают формулы следующих веществ:
В случае, если среди продуктов реакции имеются нерастворимые или малорастворимые вещества (осадок), возле таких веществ ставят стрелку вниз (↓). Газообразные и летучие соединения соответственно обозначаются стрелкой, направленной вверх (↑).
Алгоритм составления уравнения ионных реакций
- Записать уравнение в молекулярной форме:
- В тех случаях, когда реакция идет не до конца, у продуктов реакции, выпадающих в осадок или выделяющихся в виде газа, ставят стрелку:
- Записывают уравнение в ионном виде для тех веществ, которые диссоциируют на ионы, с указанием их зарядов:
- Определяют наличие одинаковых ионов в левой и правой части уравнения — это ионы, не принимающие участия в реакции, поэтому, их можно убрать, такая форма записи ионного уравнения называется сокращенной:
- ионы водорода и металлов имеют положительный заряд;
- ионы гидроксония и кислотных остатков — отрицательный заряд;
- как правило, заряд иона численно равен валентности атома.
Составление молекулярных уравнений по ионным
Теперь рассмотрим обратную задачу — как составить молекулярное уравнение, если известно сокращенное ионное уравнение.
- Дано сокращенное ионное уравнение взаимодействия между фосфором и хлором:
- По таблице Растворимостей (см. выше) подбираем соответствующие вещества, содержащие нужный катион и анион — хлорид натрия (NaCl) и нитрат свинца (II) (Pb(NO3)2);
- Пишем формулы выбранных веществ, которые должны прореагировать:
- Пишем формулы получившихся в результате реакции веществ:
- Осталось расставить стехиометрические коэффициенты, чтобы уравнять кол-во вещества в левой и правой части уравнения:
Реакции обмена в водных растворах электролитов могут протекать до конца (необратимые реакции)) или же одновременно протекать в противоположных направлениях (обратимые реакции).
Условия протекания необратимых реакций:
- образование осадка;
- выделение газа;
- образование малодиссоциирующего вещества (например, воды).
В случае, если в растворе нет ионов, способных связаться между собой, реакция является обратимой, т.е., не протекает до конца.
Пример необратимой реакции с выпадением осадка был приведен выше — взаимодействие хлорида натрия и нитрата свинца (II).
Пример необратимой реакции с выделением газа — взаимодействие карбоната натрия и соляной кислоты:
Пример необратимой реакции с образованием воды — взаимодействие гидроксида калия и азотной кислоты:
Пример обратимой реакции взаимодействия слабого электролита (CH3COOH) и нерастворимого основания (Cu(OH)2):
Если в реакцию вступают сильные электролиты, не дающие в результате взаимодействия малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают — в растворе образуется смесь ионов, которые никак не взаимодействуют друг с другом:
Левая и правая части уравнения содержат абсолютные одинаковые ионы, которые можно сократить, поэтому никакой реакции не происходит.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/sostavlenie-uravneniy-reaktsiy-ionnogo-obmena
http://prosto-o-slognom.ru/chimia/04_uravnenie_ionnoj_reaktsii.html