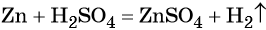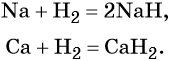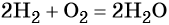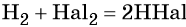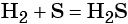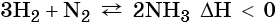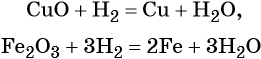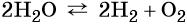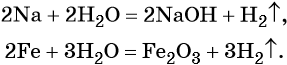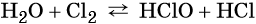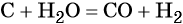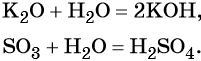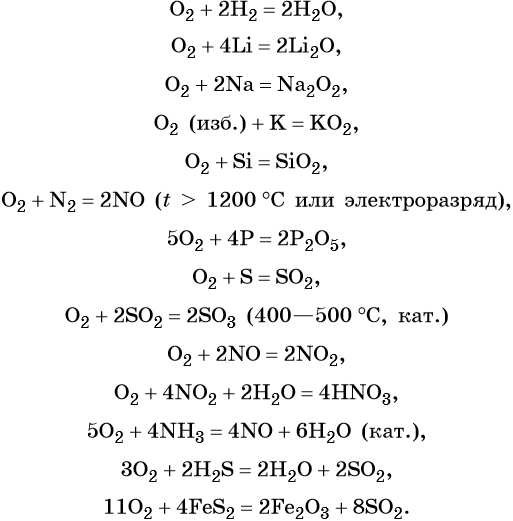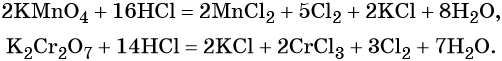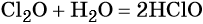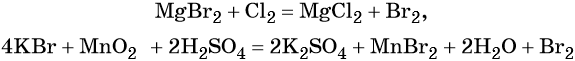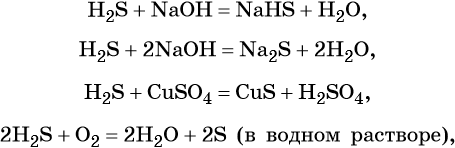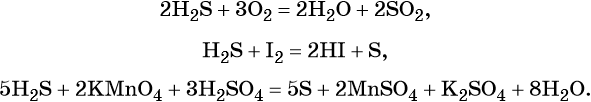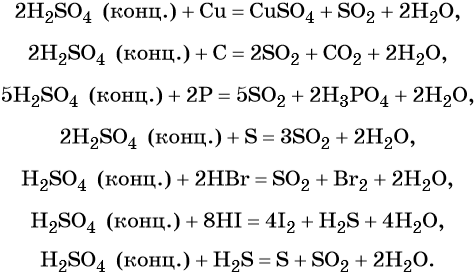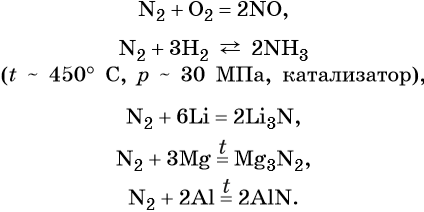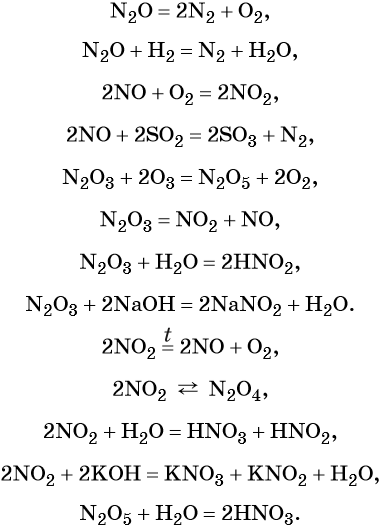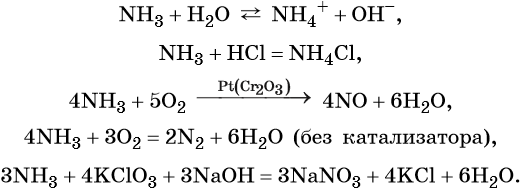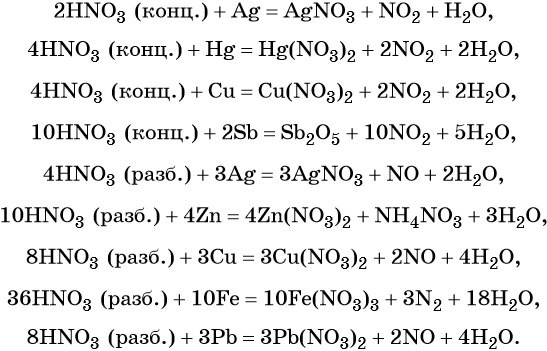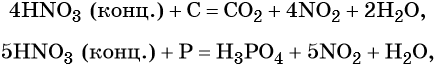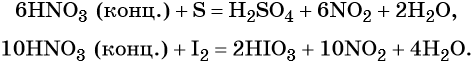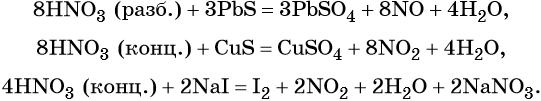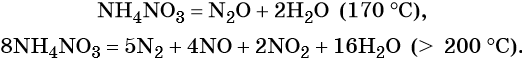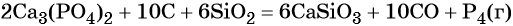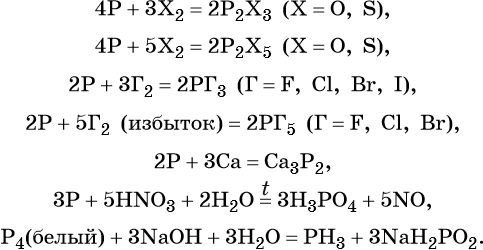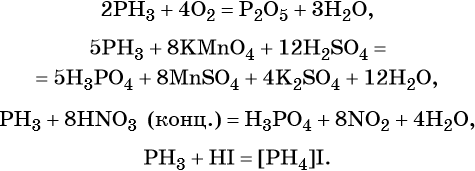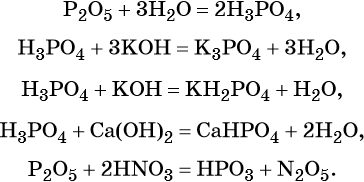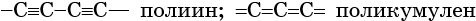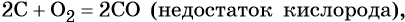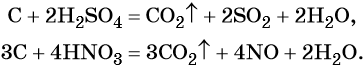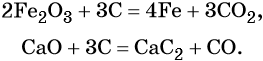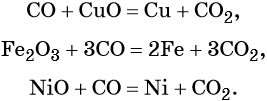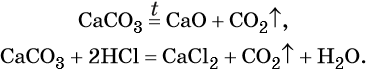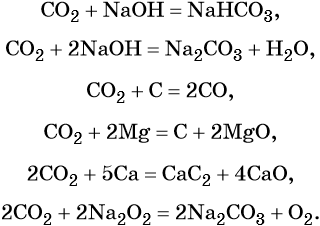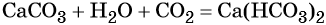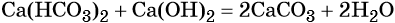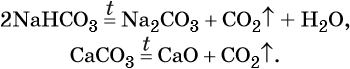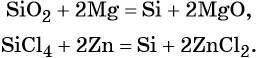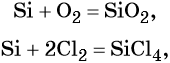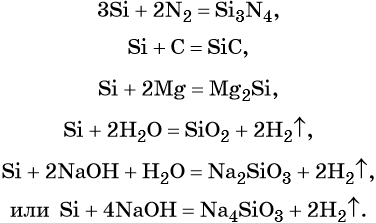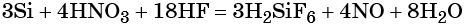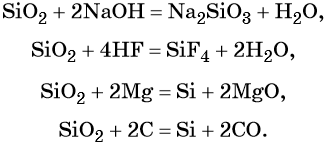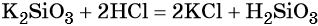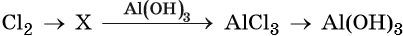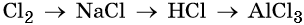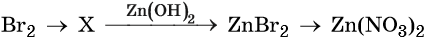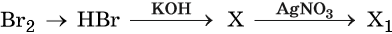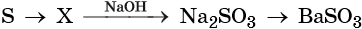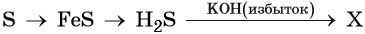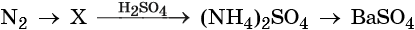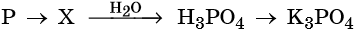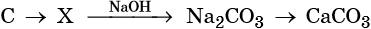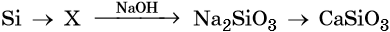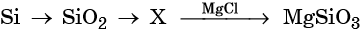Химические свойства неметаллов
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом.
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например , водород взаимодействует с оксидом кремния:
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
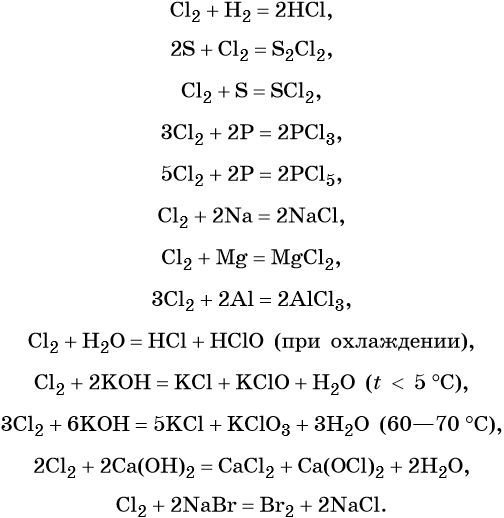
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлорную кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами .
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например , железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например , азотная кислота окисляет серу до серной кислоты:
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
Соединения хлора, например , бертолетова соль , также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например , сера реагирует с гидроксидом натрия:
При взаимодействии с перегретым паром сера диспропорционирует:
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами .
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000 о С или действие электрического разряда) азот реагирует с серой , фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например , литий реагирует с азотом с образованием нитрида лития:
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например , азот окисляет гидрид лития:
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами .
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например , кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например , азотная кислота окисляет фосфор до фосфорной кислоты:
Серная кислота также окисляет фосфор:
Соединения хлора, например , бертолетова соль , также окисляют фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например , оксид серебра (I) :
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например , фосфор реагирует с гидроксидом калия:
Или с гидроксидом кальция:
Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами , и с неметаллами .
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором .
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов . При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например , углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например , углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями , в которых содержатся неметаллы с высокой степенью окисления.
Например , углерод восстанавливает сульфат натрия до сульфида натрия:
Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Водород
Химический элемент водород занимает особое положение в периодической системе Д.И. Менделеева. По числу валентных электронов, способности образовывать в растворах гидратный ион H + он сходен с щелочными металлами, и его следует поместить в I группу. По числу электронов, необходимых для завершения внешней электронной оболочки, значению энергии ионизации, способности проявлять отрицательную степень окисления, малому атомному радиусу водород следует поместить в VII группу периодической системы. Таким образом, размещение водорода в той или иной группе периодической системы в значительной мере условно, но в большинстве случаев его помещают в VII группу.
Электронная формула водорода 1s 1 . Единственный валентный электрон находится непосредственно в сфере действия атомного ядра. Простота электронной конфигурации водорода отнюдь не означает, что химические свойства этого элемента просты. Напротив, химия водорода во многом отличается от химии других элементов. Водород в своих соединениях способен проявлять степени окисления +1 и –1.
Существует большое количество методов получения водорода. В лаборатории его получают взаимодействием некоторых металлов с кислотами, например:
Водород можно получить электролизом водных растворов серной кислоты или щелочей. При этом происходит процесс выделения водорода на катоде и кислорода на аноде.
В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива и коксового газа.
Простое вещество водород, H2, представляет собой горючий газ без цвета и запаха. Температура кипения –252,8 °C. Водород в 14,5 раза легче воздуха, мало растворим в воде.
Молекула водорода устойчива, обладает большой прочностью. Из-за высокой энергии диссоциации распад молекул H2 на атомы происходит в заметной степени лишь при температуре выше 2000 °C.
Для водорода возможны положительная и отрицательная степени окисления, поэтому в химических реакциях водород может проявлять как окислительные, так и восстановительные свойства. В тех случаях, когда водород выступает в качестве окислителя, он ведёт себя подобно галогенам, образуя аналогичные галогенидам гидриды (гидридами называют группу химических соединений водорода с металлами и менее электроотрицательными, чем он, элементами):
По окислительной активности водород существенно уступает галогенам. Поэтому ионный характер проявляют лишь гидриды щелочных и щёлочноземельных металлов. Ионные, а также комплексные гидриды, например, являются сильными восстановителями. Их широко используют в химических синтезах.
В большинстве реакций водород ведёт себя как восстановитель. При нормальных условиях водород не взаимодействует с кислородом, однако при поджигании реакция протекает со взрывом:
Смесь двух объёмов водорода с одним объёмом кислорода называют гремучим газом. При контролируемом горении происходит выделение большого количества тепла, и температура водородно-кислородного пламени достигает 3000 °С.
Реакция с галогенами протекает в зависимости от природы галогена по-разному:
С фтором такая реакция идёт со взрывом даже при низких температурах. С хлором на свету реакция также протекает со взрывом. С бромом реакция идёт значительно медленнее, а с йодом не доходит до конца даже при высокой температуре. Механизм этих реакций радикальный.
При повышенной температуре водород взаимодействует с элементами VI группы — серой, селеном, теллуром, например:
Очень важной является реакция водорода с азотом. Эта реакция обратима. Для смещения равновесия в сторону образования аммиака используют повышенное давление. В промышленности данный процесс осуществляют при температуре 450—500 °С, давлении 30 МПа, в присутствии различных катализаторов:
Водород восстанавливает многие металлы из оксидов, например:
Данную реакцию используют для получения некоторых чистых металлов.
Огромную роль играют реакции гидрирования органических соединений, которые широко используют как в лабораторной практике, так и в промышленном органическом синтезе.
Сокращение природных источников углеводородного сырья, загрязнение окружающей среды продуктами сгорания топлива повышают интерес к водороду как к экологически чистому топливу. Вероятно, водород будет играть важную роль в энергетике будущего.
В настоящее время водород широко применяют в промышленности для синтеза аммиака, метанола, гидрогенизации твёрдого и жидкого топлива, в органическом синтезе, для сварки и резки металлов и т. д.
Вода H2O, оксид водорода, является важнейшим химическим соединением. При нормальных условиях вода — бесцветная жидкость, без запаха и вкуса. Вода — самое распространённое вещество на поверхности Земли. В человеческом организме содержится 63—68 % воды.
Вода является стабильным соединением, её разложение на кислород и водород происходит лишь под действием постоянного электрического тока или при температуре около 2000 °C:
Вода непосредственно взаимодействует с металлами, стоящими в ряду стандартных электронных потенциалов до водорода. Продуктами реакции в зависимости от природы металла могут быть соответствующие гидроксиды и оксиды. Скорость реакции в зависимости от природы металла также изменяется в широких пределах. Так, натрий вступает в реакцию с водой уже при комнатной температуре, реакция сопровождается выделением большого количества тепла; железо реагирует с водой при температуре 800 °С.
Вода может вступать в реакцию со многими неметаллами, так, при обычных условиях вода обратимо взаимодействует с хлором:
При повышенной температуре вода взаимодействует с углем с образованием так называемого синтез-газа — смеси оксида углерода (II) и водорода:
При обычных условиях вода реагирует со многими основными и кислотными оксидами с образованием оснований и кислот соответственно:
Реакция идёт до конца, если соответствующее основание или кислота растворимы в воде.
Кислород
Химический элемент кислород расположен во 2-м периоде VIA подгруппе. Его электронная формула 1s 2 2s 2 2p 4 . Простое вещество кислород — газ без цвета и запаха, мало растворим в воде. Сильный окислитель. Его характерные химические свойства:
Реакции простых и сложных веществ с кислородом часто сопровождаются выделением тепла и света. Такие реакции называют реакциями горения.
Кислород широко используется практически во всех областях химической промышленности: для производства чугуна и стали, производства азотной и серной кислоты. Огромное количество кислорода потребляется в процессах тепловой энергетики.
В последние годы обострилась проблема сохранения запасов кислорода в атмосфере. До настоящего времени единственным источником, пополняющим запасы атмосферного кислорода, является жизнедеятельность зелёных растений.
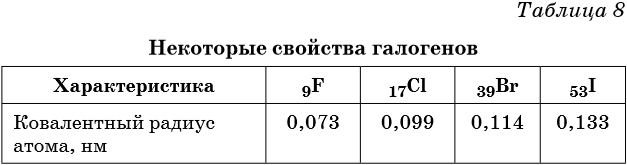
Галогены
В VIIА группе находятся фтор, хлор, бром, йод и астат. Эти элементы называют также галогенами (в переводе — рождающие соли).
На внешнем энергетическом уровне всех этих элементов находятся 7 электронов (конфигурации ns 2 np 5 ), наиболее характерные степени окисления –1, +1, +5 и +7 (кроме фтора).
Атомы всех галогенов образуют простые вещества состава Hal2.
Галогены являются типичными неметаллами. При переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства падают, происходит уменьшение окислительных и увеличение восстановительных свойств.
Физические свойства галогенов приведены в таблице 8.
В химическом отношении галогены весьма активны. Их реакционная способность убывает с увеличением порядкового номера. Некоторые характерные для них реакции приведены ниже на примере хлора:
Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI.
Галогенводородные кислоты (за исключением HF) способны реагировать с такими сильными окислителями, как KMnO4, MnO2, K2Cr2O7, CrO3 и другими, с образованием галогенов:
Галогены образуют ряд оксидов, например, для хлора известны кислотные оксиды состава Cl2O, ClO2, ClO3, Cl2O7. Все эти соединения получают косвенными методами. Они являются сильными окислителями и взрывоопасными веществами.
Наиболее устойчивым из оксидов хлора является Cl2O7. Оксиды хлора легко реагируют с водой, образуя кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4, например:
В промышленности бром получают при вытеснении хлором из бромидов, а в лабораторной практике — окислением бромидов:
Простое вещество бром является сильным окислителем, легко вступает в реакции со многими простыми веществами, образуя бромиды; вытесняет йод из йодидов.
Простое вещество йод, I2, представляет собой чёрные с металлическим блеском кристаллы, которые возгоняются, т. е. переходят в пар, минуя жидкое состояние. Йод мало растворим в воде, но довольно хорошо растворяется в некоторых органических растворителях (спирт, бензол и т. д.).
Йод является довольно сильным окислителем, способным к окислению ряда металлов и некоторых неметаллов.
Химический элемент сера расположен в 3-м периоде VIA подгруппе. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 4 . Простое вещество сера — неметалл жёлтого цвета. Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Её характерные химические свойства:
Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
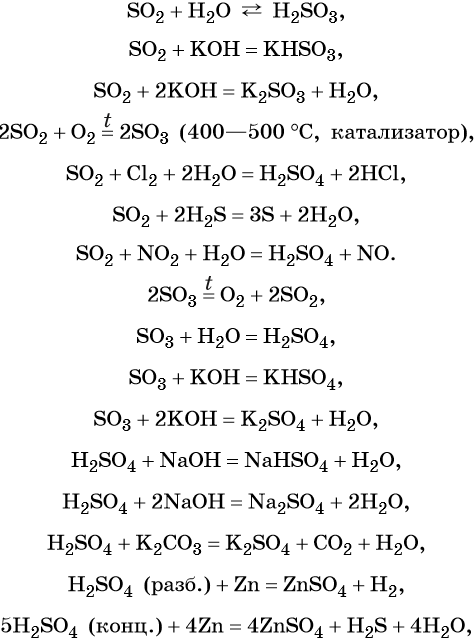
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует слабая, существующая только в растворе сернистая кислота H2SO3; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции:
Серная кислота в больших количествах производится в промышленности. Все промышленные методы производства серной кислоты основаны на первоначальном получении оксида серы (IV), его окислении в оксид серы (VI) и взаимодействии последнего с водой.
Химический элемент азот — находится во 2-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 3 . В своих соединениях азот проявляет степени окисления –3, –2, +1,+2, +3, +4, +5.
Простое вещество азот — газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.
Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO, являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе реакции диспропорционирования.
Химические свойства оксидов азота:
Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; температура кипения –33,7 °C, температура плавления –77,8 °C. Аммиак хорошо растворим в воде (700 объёмов NH3 на 1 объём воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:
Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это слабая кислота, её соли называют нитритами.
Кроме того, азот образует очень сильную азотную кислоту HNO3. Особенностью азотной кислоты является то, что при её окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония, например:
В реакциях с неметаллами концентрированная азотная кислота ведёт себя как сильный окислитель:
Также азотная кислота способна окислять сульфиды, йодиды и т. д.:
Подчеркнём ещё раз. Запись уравнений окислительно-восстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
Соли азотной кислоты называют нитратами. Все нитраты хорошо растворимы в воде. Нитраты термически нестабильны и при нагревании легко разлагаются.
Особые случаи разложения нитрата аммония:
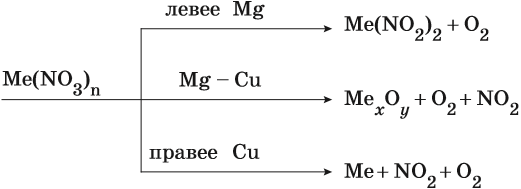
Общие закономерности термического разложения нитратов:
Фосфор
Химический элемент фосфор расположен в 3-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 3 .
Простое вещество фосфор существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Чёрный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углём и песком при 1500 °C:
В приведённые ниже реакции вступают любые модификации фосфора, если нет особых оговорок:
Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:
Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трёхосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений:
Углерод
Химический элемент углерод расположен во 2-м периоде, главной подгруппе IV группы периодической системы Д.И. Менделеева, его электронная формула 1s 2 2s 2 2p 2 , наиболее характерные степени окисления –4, +2, +4.
Для углерода известны стабильные аллотропные модификации (графит, алмаз, аллотропия строения), в виде которых он встречается в природе, а также полученные лабораторным путём карбин и фуллерены.
Алмаз — кристаллическое вещество с атомной координационной кубической решёткой. Каждый атом углерода в алмазе находится в состоянии sp 3 -гибридизации и образует равноценные прочные связи с четырьмя соседними атомами углерода. Это обуславливает исключительную твёрдость алмаза и отсутствие в обычных условиях электропроводности.
В графите атомы углерода находятся в состоянии sp 2 -гибридизации. Атомы углерода объединены в бесконечные слои из шестичленных колец, стабилизированные ω-связью, делокализованные в пределах всего слоя. Этим объясняется металлический блеск и электрическая проводимость графита. Углеродные слои объединены в кристаллическую решётку в основном за счёт межмолекулярных сил. Прочность химических связей в плоскости макромолекулы значительно больше, чем между слоями, поэтому графит довольно мягок, легко расслаивается и химически несколько активнее алмаза.
В состав древесного угля, сажи и кокса входят очень мелкие кристаллы графита с очень большой поверхностью, которые называют аморфным углеродом.
В карбине атом углерода находится в состоянии sp-гибридизации. Его кристаллическая решётка построена из прямолинейных цепочек двух видов:
Карбин представляет собой порошок чёрного цвета с плотностью 1,9—2,0 г/см 3 , является полупроводником.
Аллотропные модификации углерода могут переходить друг в друга при определённых условиях. Так, при нагревании без доступа воздуха при температуре 1750 °С алмаз переходит в графит.
В нормальных условиях углерод весьма инертен, однако при высоких температурах он вступает в реакции с различными веществами, причём самой реакционноспособной формой является аморфный углерод, менее активен графит, а самый инертный — алмаз.
Реакции, характерные для углерода:
Углерод устойчив к действию кислот и щелочей. Только горячие концентрированные азотная и серная кислоты могут окислить его до оксида углерода (IV):
Углерод восстанавливает многие металлы из их оксидов. При этом в зависимости от природы металла образуются либо чистые металлы (оксиды железа, кадмия, меди, свинца), либо соответствующие карбиды (оксиды кальция, ванадия, тантала), например:
Углерод образует два оксида: CO и CO2.
Оксид углерода (II) CO (угарный газ) представляет собой бесцветный газ без запаха, плохо растворимый в воде. Это соединение является сильным восстановителем. Он горит на воздухе с выделением большого количества теплоты, благодаря чему CO является хорошим газообразным топливом.
Оксид углерода (II) восстанавливает многие металлы из их оксидов:
Оксид углерода (II) является несолеобразующим оксидом, с водой и щелочами он не реагирует.
Оксид углерода (IV) CO2 (углекислый газ) представляет собой бесцветный, без запаха, негорючий газ, малорастворимый в воде. В технике его обычно получают термическим разложением CaCO3, а в лабораторной практике — действием на CaCO3 соляной кислоты:
Оксид углерода (IV) является кислотным оксидом. Его характерные химические свойства:
Оксиду углерода (IV) соответствует очень слабая двухосновная угольная кислота H2CO3, которая не существует в чистом виде. Она образует два ряда солей: средние — карбонаты, например карбонат кальция CaCO3, и кислые — гидрокарбонаты, например Ca(HCO3)2 — гидрокарбонат кальция.
Карбонаты переходят в гидрокарбонаты под действием избытка углекислого газа в водной среде:
Гидрокарбонат кальция превращается в карбонат под действием гидроксида кальция:
Гидрокарбонаты и карбонаты разлагаются при нагревании:
Кремний
Химический элемент кремний находится в 3-м периоде IVА группе периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 2 , наиболее характерные степени окисления –4, +4.
Кремний получают восстановлением его оксида магнием или углеродом в электрических печах, а кремний высокой чистоты — восстановлением SiCl4 цинком или водородом, например:
Кремний может существовать в кристаллической или аморфной форме. В обычных условиях кремний довольно устойчив, причём аморфный кремний более реакционноспособен, чем кристаллический. Для кремния наиболее устойчива степень окисления +4.
Реакции, характерные для кремния:
Кремний не реагирует с кислотами (за исключением HF), пассивируется кислотами-окислителями, но хорошо растворяется в смеси плавиковой и азотной кислот, что можно описать уравнением:
Оксид кремния (IV), SiO2 (кремнезём), в природе встречается в основном в виде минерала кварца. В химическом отношении довольно устойчив, проявляет свойства кислотного оксида.
Свойства оксида кремния (IV):
Кремний образует кислоты переменного содержания SiO2 и H2O. Соединение состава H2SiO3 в чистом виде не выделено, но для упрощения допускается его запись в уравнениях реакций:
Тренировочные задания
1. Водород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом
2) серой и хромом
3) оксидом углерода (II) и соляной кислотой
4) азотом и натрием
2. Верны ли следующие утверждения о водороде?
А. Перекись водорода можно получить сжиганием водорода в избытке кислорода.
Б. Реакция между водородом и серой идёт без катализатора.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Кислород при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) фосфором и цинком
3) оксидом кремния (IV) и хлором
4) хлоридом калия и серой
4. Верны ли следующие утверждения о кислороде?
А. Кислород не реагирует с хлором.
Б. Реакция кислорода с серой даёт SO2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Фтор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) аргоном и азотной кислотой
3) оксидом углерода (IV) и неоном
4) водой и натрием
6. Верны ли следующие утверждения о фторе?
А. Реакция избытка фтора с фосфором приводит к PF5.
Б. Фтор реагирует с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Хлор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и железом
2) фосфором и серной кислотой
3) оксидом кремния (IV) и неоном
4) бромидом калия и серой
8. Верны ли следующие утверждения о хлоре?
А. Пары хлора легче воздуха.
Б. В заимодействие хлора с кислородом приводит к оксиду хлора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Бром при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) фосфором и железом
2) фосфором и серной кислотой
3) оксидом кремния (IV) и хлором
4) бромидом калия и серой
10. Верны ли следующие утверждения о броме?
А. Бром не вступает в реакцию с водородом.
Б. Бром вытесняет хлор из хлоридов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Йод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) гелием и железом
2) фосфором и кальцием
3) оксидом кремния (IV) и хлором
4) хлоридом калия и серой
12. Верны ли следующие утверждения о йоде?
А. Раствор йода обладает бактерицидными свойствами.
Б. Йод реагирует с хлоридом кальция.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Сера при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и железом
2) фосфором и оксидом цинком
3) оксидом кремния (IV) и хлором
4) хлоридом калия и бромидом натрия
14. Верны ли следующие утверждения о сере?
А. При сплавлении серы и кальция образуется CaS.
Б. При реакции серы с кислородом образуется SO2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Азот при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) литием и хлоридом кальция
2) хлором и оксидом кальция
3) оксидом кремния (IV) и хлором
4) литием и кальцием
16. Верны ли следующие утверждения об азоте?
А. В промышленности реакцию азота и водорода осуществляют под высоким давлением в присутствии катализатора.
Б. При взаимодействии азота и натрия образуется Na3N.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Фосфор при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) натрием и сульфидом кальция
2) хлором и кислородом
3) оксидом углерода (IV) и серой
4) серой и оксидом цинка
18. Верны ли следующие утверждения о фосфоре?
А. Реакция фосфора с хлором идёт только в присутствии катализатора.
Б. При реакции фосфора с избытком серы образуются только P2S3.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Углерод при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кальцием и сульфатом бария
2) хлором и неоном
3) оксидом фосфора (V) и серой
4) серой и гидроксидом цинка
20. Верны ли следующие утверждения об углероде?
А. При взаимодействии углерода с натрием образуется карбид состава Na2C2.
Б. Углерод реагирует с оксидом кальция с образованием CaC2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Кремний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и гидроксидом натрия
2) хлором и неоном
3) оксидом фосфора (V) и серой
4) серой и гидроксидом цинка
22. Верны ли следующие утверждения о кремнии?
А. При взаимодействии кремния с углеродом образуется карбид состава SiC.
Б. Кремний реагирует с магнием с образованием Mg2Si.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
25. Установите соответствие между реагирующими веществами и продуктами реакций.
26. Установите соответствие между реагирующими веществами и продуктами реакций.
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Cl2 + Fe →
Б) Cl2 + Cr →
В) Cl2 (изб.) + P →
28. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaClO3 + NaCl + H2O
2) NaCl + NaClO + H2O
3) NaClO3 + NaCl
4) NaCl + Br2
5) NaClBr
29. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaClI
2) NaBrO + NaBr
3) NaBrO3 + NaBr + H2O
4) NaBrO + NaBr + H2O
5) NaBr + I2
30. Установите соответствие между реагирующими веществами и продуктами реакций.
ПРОДУКТЫ РЕАКЦИИ
1) NaBr + NaBrO3 + H2O
2) NaBr + NaBrO + H2O
3) I Br
4) H2SO4 + HBr
5) HBr + SO3
31. Установите соответствие между реагирующими веществами и продуктами реакций.
32. Установите соответствие между реагирующими веществами и продуктами реакций.
33. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) S + Na →
Б) S + HI →
В) S + NaOH →
34. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) S + Cl2 (недост.) →
Б) S + HNO3 (конц.) →
В) S + O2 →+
35. Установите соответствие между реагирующими веществами и продуктами реакций.
36. Установите соответствие между реагирующими веществами и продуктами реакций.
37. Установите соответствие между реагирующими веществами и продуктами реакций.
38. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) P + Br2 (недост.) →
Б) P + Li
В) P + HNO3 (конц.) →
39. Установите соответствие между реагирующими веществами и продуктами реакций.
40. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) C + H2O →
Б) C + HNO3 →
В) C + S →
41. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Si + O2 →
Б) Si + S →
В) S i + Mg →
42. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Si + Cl2 →
Б) Si + C →
В) Si + NaOH →
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
51. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
52. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
53. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
54. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
2.3 Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Видеоурок: Свойства неметаллов
Лекция: Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния


Двухатомные молекулы Н2 достаточно легки, подвижны и неполярны. Межмолекулярное взаимодействие — дисперсионное. Именно поэтому водород достаточно плохо растворяется в жидкостях. Водород возможен во всех агрегатных состояниях. Н2 в обычных условиях — это газ, без цвета, запаха и вкуса. При t ок. −253 o C сжижается и превращается в бесветную, легкую и текучую жидкость. А при t ок. −259 o C затвердевает, образуя снегоподобную массу.
Энергия связи атомных ядер довольно велика, равна 434 кДж. Поэтому, химические реакции с участием водорода, обычно протекают при нагревании или освещении. При обычных условиях реакция возможна только с очень активными металлами и только с одним неметаллом — фтором.
Взаимодействие с другими элементами:
1. С кислородом образует гремучий газ. Реакция взрывоопасная:
- O2 + 2H2 → 2H2О.
2. С щелочными и щелочноземельными металлами образует гидриды:
- Ca + H2 → CaH2.
В данных реакциях проявляет окислительные свойства. С оксидами металлов проявляет восстановительные св ойства, вытесняя металл:
- CuО + Н2 → Cu + Н2 О.
3. Соединения с галогенами образуют галогеноводороды, водные растворы которых являются кислотами:
- водный р-р хлороводорода HCl — соляная кислота;
- водный р-р фтороводорода HF — плавиковая кислота;
- водный р-р бромоводорода HBr — бромоводородная кислота;
- водный р-р иодоводорода HI — иодоводородная кислота;
- водный р-р а статоводорода HAt — астатоводородная кислота.
4. С азотом при нагревании, давлении и в присутстсвии катализатора (Fe), образуя аммиак:
- 3Н2 + N2 → 2NH 3 .
5. С серой при нагревании, образуя сероводород. Это обратимая реакция:
- Н2 + S → H2S .
6. С углеродом, образуя метан:
- 2Н2 + С → СН4.

Вы можете повторить характеристику галогенов, которую мы рассматривали на уроке 1.2.4 Общая характеристика неметаллов IVA – VIIA групп.
На данном уроке рассмотрим химические свойства и взаимодействие галогенов с другими элементами. Все галогены являются окислителями. Окислительные свойства уменьшаются при перемещении от фтора вниз по группе. Все галогены обладают двухатомными молекулами.
Фтор. Наиболее сильным окислителем является фтор. Он легко вступает в реакцию со всеми металлами и со многими неметаллами. И не образует фторидов лишь с тремя инертными газами: гелием, неоном и аргоном. При обычных условиях и даже при низких t фтор реагирует с водородом с воспламенением и со взрывом, образуется фтороводород : Н2 + F2 → 2HF . При реакции фтора с водой, последняя начинает гореть: 2F2 + 2H2O → 4HF + O 2 . Со фтором непосредственно не реагируют азот (N), кислород (O), алмаз, углекислый и угарный газы. Во всех соединениях фтор проявляет только одну степень окисления –1.







Фосфор проявляет как окислительные, так и восстановительные свойства. Во взаимодействии с металлами, ведет себя как окислитель и образует фосфиды: 2P + 3Ca → Ca3P 2 . С неметаллами реагирует, как восстановитель: 2P + 3Cl2 → 2PCl 3 . С водородом не реагирует. С водой диспропорционирует, образуя фосфорноватистую кислоту: 4Р + 6Н2О → РН3 + 3Н3РО 2 . Под действием сильный окислителей превращается в фосфорную кислоту: 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O .

Углерод достаточно широко применяется в деятельности человека. Применяться в виде кокса в металлургии для восстановления металлов.
При высоких температурах, элемент реагирует со многими металлами. При взаимодействии с металлами образуются силициды. В силицидах щелочных и щелочноземельных металлов химическая связь носит ионно-ковалентный характер. Состав данных химический соединений является постоянным. Так же состав соответствует степени окисления кремния (-4): Na4Si, Mg2Si. Следовательно, кремний проявляет окислительные свойства.
Кремний не способен взаимодействовать с водородом. Но, несмотря на это, его соединения с водородом всё же существуют. Например: SiH4 (моносилан). С галогенами кремний образует тетрагалогениды: газообразный SiF4, жидкие SiCl4 и SiBr4 и твердый SiI4. С серой кремний образует дисульфид кремния SiS2. С углеродом кремний образует карбид кремния.
http://himi4ka.ru/ogje-2018-po-himii/urok-14-himicheskie-svojstva-prostyh-veshhestv-nemetallov-vodoroda-kisloroda-galogenov-sery-azota-fosfora-ugleroda-kremnija.html
http://cknow.ru/knowbase/766-23-harakternye-himicheskie-svoystva-prostyh-veschestv-nemetallov-vodoroda-galogenov-kisloroda-sery-azota-fosfora-ugleroda-kremniya.html