Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация: решение задач
Теоретический материал приведен на страницах:
Освежим в памяти основные моменты, которые необходимы при решении задач.
Степень диссоциации (α) — отношение кол-ва молекул, которые распались на ионы (N’), к общему кол-ву растворенных молекул (N):
| α = N’/N |
- α=0 — диссоциация отсутствует;
- α=0-3% — слабые электролиты — слабые кислоты (H2SO3, H2S, H2SiO3), слабые основания;
- α=3%-30% — средние электролиты;
- α=30%-100% — сильные электролиты — соли, сильные кислоты (HCl, HBr, HNO3, H2SO4(разб.)), некоторые основания (LiOH, KOH, NaOH);
- α=100% — полная диссоциация.
Степень диссоциации зависит от концентрации раствора.
Константа диссоциации электролита (K) — количественная характеристика диссоциации — отношение произведений концентрации ионов, образованных при диссоциации, к концентрации исходных частиц. Для электролита АВ, который диссоциирует по уравнению АВ↔A — +B + :
| K = ([A — ][B + ]):[AB] |
Константра диссоциации не зависит от концентрации веществ и может колебаться в очень ширком диапазоне — от 10 -16 до 10 15 .
Степень и константа диссоциации связаны между собой соотношением, называемым Законом разведения Оствальда:
| K = ([A — ][B + ]):[AB] = C(α 2 :(1-α)) |
Для слабых электролитов:
| K ≈ α 2 C α ≈ √(K/C) |
Диссоциация воды и её константа диссоциации:
| H2O ↔ H + +OH — K = ([OH — ][H + ]):[H2O] |
Поскольку вода является очень слабым электролитом, то концентрация [H2O] является практически неизменной, поэтому, остаётся постоянной и константа диссоциации воды (ионное произведение воды):
| Kω = [OH — ][H + ] = 10 -14 (при 25°C) |
Для чистой воды:
| [OH — ]=[H + ] = √10 -14 = 10 -7 моль/л |
На практике пользуются водородным показателем pH=-lg[H + ]:
- pH=7 — нейтральная среда;
- pH 7 — щелочная среда.
Диссоциация кислот и оснований
Константа диссоциации одноосновных кислот (Ka-кислотный тип диссоциации; А — -кислотный остаток):
| Kа = ([А — ][H + ]):[HА] |
Многоосновные кислоты диссоциируют в несколько стадий, у каждой из которых своя константа диссоциации.
Константа диссоциации оснований обозначается Kb.
Диссоциация малорастворимых веществ
Константа диссоциации малорастворимых веществ называется произведением растворимости (ПР).
| AgClтв=Ag + +Cl — K = ([Аg + ][Cl — ]):[AgClтв] ПР(AgCl) = [Аg + ][Cl — ] = const |
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
Взаимодействие солей с водой с образованием кислой и основной соли называется гидролизом.
Примеры решения задач
Пример 1 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода (H + ) с гидроксид-ионом (OH — ).
- ион водорода реагирует с гидроксид-ионом с образованием молекулы воды (реакция нейтрализации):
- ионы водорода образуются при диссоциации сильных кислот (HCl);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 2 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода с карбонат-ионом.
- карбонат-ионы реагируют с ионами водорода с образованием гидрокарбонат-ионов (реакция протекает при недостатке ионов водорода):
- второй вариант данной реакции — образование неустойчивой угольной кислоты, распадающейся на воду и оксид углерода (протекает при избытке ионов водорода):
- Молекулярные уравнения реакций:
Пример 3 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона серебра с гидроксид-ионом.
- ион серебра реагирует с гидроксид-ионом с образованием неустойчивого соединения гидроксида серебра, распадающегося на воду и оксид серебра:
- ионы серебра образуются при диссоциации растворимых солей серебра (AgNO3);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 4 . При взаимодействии каких растворов получится карбонат кальция (CaCO3)?
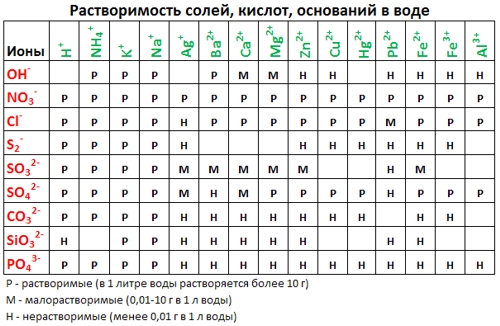
Из таблицы растворимости видно, что карбонат кальция нерастворим в воде.
- Сокращенное ионное уравнение для получения CaCO3 будет иметь следующий вид:
- Для решения задачи подойдет любое растворимое соединение кальция, которое будет диссоциировать с образованием ионов Ca 2+ , например, хлорид или нитрат кальция — CaCl2 или Ca(NO3)2;
- В качестве донора ионов CO3 2- сойдет любой растворимый в воде карбонат, например, Na2CO3 или K2CO3;
- Один из вариантов молекулярного уравнения:
Пример 5 . Растворы каких солей нужны для получения:
Пример 6 . Какие вещества образуются при взаимодействии растворов сульфата натрия (Na2SO4) и хлорида бария (BaCl2)?
- Из таблицы растворимости видно, что обе соли растворимы в воде:
- При слиянии растворов образуются катионы натрия и бария и анионы хлора и оксида серы. Из таблицы растворимости видно, что нерастворимую в воде соль даст сочетание Ba 2+ и SO4 2- :
- Уравнение реакции будет иметь вид:
Пример 7 . Какая соль выпадет в осадок при взаимодействии нитрата серебра (AgNO3) и хлорида кальция (CaCl2)? Написать уравнение реакции.
Пример 8 . Каким образом можно очистить поваренную соль (NaCl) от сульфата натрия (Na2SO4)?
Идея решения задачи заключается в добавлении в раствор поваренной соли и сульфата натрия вещества, способного распадаться на ионы, которые свяжут ионы оксида серы в нерастворимую соль, высвободив тем самым ионы натрия.
Роль связывающего вещества выполнит хлорид кальция CaCl2.
После того, как CaSO4↓ выпадет в осадок, полученный раствор необходимо будет отфильтровать, после чего в фильтрате будет присутствовать чистая поваренная соль.
Пример 9 . Написать молекулярное и ионное уравнение реакции хлорида алюминия с нитратом серебра.
- Молекулярное уравнение:
- Полное ионное уравнение:
- Сокращенное ионное уравнение:
Пример 10 . Рассчитать концентрацию ионов, образующихся при смешении 1 литра 0,25М раствора BaCl2 и 1 литра 0,5М раствора Na2SO4, после выпадения BaSO4 в осадок.
- Молекулярное уравнение реакции:
- Сокращенное ионное уравнение:
- Рассчитаем исходные кол-ва ионов:
- (Ba 2+ ) в обменной реакции присутствует в недостатке, поэтому, в реакцию вступает не 0,5, а только 0,25 SO4 2- ;
- Объем полученного раствора 1+1=2 литра;
- Рассчитаем молярные концентрации ионов:
Пример 11 . Рассчитать pH водного раствора 0,1М HCl; 0,1M NaOH.
- HCl — сильная кислота, диссоциирует полностью, уравнение диссоциации:
- NaOH — сильное основание, диссоциирует полностью, уравнение диссоциации:
Пример 12 . Рассчитать концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л (K=1,7·10 -5 ).
- Формула равновесия, установленного в водном растворе аммиака:
- Обозначим через x равновесную концентрацию [OH — ]; тогда [NH4 + ]=x; [NH3]=1,5-x:
Пример 13 . Какое кол-во осадка образуется при смешении 250 мл растворов нитрита лития (концентрация 0,3 моль/л) и фторида натрия (0,2 моль/л), если произведение растворимости фторида лития ПР(LiF)=1,5·10 -3 .
- Уравнение реакции:
- Рассчитаем исходные кол-ва ионов:
- Объем раствора равен 0,25+0,25=0,5 л
- Если обозначить через x моль кол-во выпавшего осадка LiF, тогда произведение концентрации ионов в растворе будет равно:
- Масса выпавшего осадка:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
Н 3 РО 4 ↔ Н + + Н 2 РО — 4 (первая ступень) – дигидроортофосфат ион
Н 2 РО — 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH — )
Щёлочи – это основания, растворимые в воде (основания щелочных и щелочноземельных металлов) : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2 , а также NН 4 ОН
Примеры уравнений диссоциации щелочей:
NH 4 OH ↔ NH + 4 + OH —
Многокислотные основания диссоциируют ступенчато:
Ba(ОН) 2 → Bа(ОН) + + OH — (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH — (вторая ступень)
Диссоциация амфотерных оснований (амфолитов)
Амфолиты — это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы (OH — )
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
2ОН — + Zn 2+ + 2Н 2 О ↔ Zn(ОН) 2 + 2Н 2 О ↔ [Zn(ОН) 4 ] 2- + 2Н +
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO 4 → K + + HSO — 4
HSO — 4 ↔ H + + SO 2- 4
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
MgOHCl → MgOH + + Cl —
MgOH + ↔ Mg 2+ + OH —
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH) 2 , CaCl 2 , Zn(NO 3 ) 2 , Ba(OH) 2 , K 2 SO 4 , H 2 SiO 3 , FeI 3 , NiCl 2 , H 3 PO 4 , Ca(OH) 2 , Na 2 CO 3 , Na 3 PO 4 , HNO 3 , KOH, Ba(OH) 2 , H 2 SO 3 , Ca(NO 3 ) 2 , Ca 3 (PO 4 ) 2 , H 2 S, NaOH, HBr
http://prosto-o-slognom.ru/chimia_primery/007-elektroliticheskaya_dissotsiatsiya.html
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-8-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B9-%D0%B8-%D1%81%D0%BE%D0%BB%D0%B5%D0%B9