Составление электронных уравнений анодного и катодного процессов происходящих при коррозии
Решение задач на коррозию металлов
Задание 287.
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Магний имеет более электроотрицательный стандартный электродный потенциал (-2,36 В), чем никель (-0,24 В), поэтому он является анодом, никель – катодом.
Анодный процесс – окисление металла: Mе 0 — 2 
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Mg — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Mg 0 — 2 
Катодный процесс: в кислой среде: 2Н + + 2 
Продуктом коррозии будет газообразный водород соединение магния с кислотным остатком (соль).
При коррозии пары Mg — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление магния:
Анодный процесс: Mg 0 — 2 
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2 
в нейтральной или в щелочной среде: 1/2O 2 + H 2 O + 2 
Так как ионы Mg 2+ с гидроксид-ионами ОН — образуют нерастворимый гидроксид, то продуктом коррозии будет Mg(OH)2.
Задание 288.
В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
Решение:
а) При помещении цинковой пластинки в раствор хлороводородной (соляной) кислоты происходит реакция замещения:
Через некоторое время цинковая пластинка в растворе разбавленной соляной кислоте пассивируется оксидной плёнкой, образующейся при взаимодействии цинка с кислородом растворённым в воде по схеме: Zn + 1/2 O2 = ZnO, поэтому коррозия цинка вскоре замедлится.
б) При помещении цинковой пластинки, частично покрытой медью, в раствор соляной кислоты образуется гальваническая пара Zn — Cu, в которой цинк будет анодом, а медь – катодом. Происходит это так, потому что цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (+0-,34 В).
Анодный процесс: Zn 0 — 2 
Катодный процесс: в кислой среде: 2Н + + 2 
Ионы цинка Zn 2+ с ионами хлора Cl — будут давать соль ZnCl2 – сильный электролит, а водород будет интенсивно выделяться в виде пузырьков газа. Этот процесс будет бурно протекать до тех пор пока не закончится приход ионов водорода Н + соляной кислоты или пока полностью не растворится цинковая пластинка. Ионно-молекулярное уравнение коррозии:
Zn 0 + 2H + = Zn 2+ + H2О↑
Молекулярная форма уравнения:
Задание 289.
Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
Решение:
Химически чистое железо более стойко к коррозии, потому что с кислородом образует на поверхности оксидную плёнку, которая препятствует дальнейшему разрушению металла. Техническое железо содержит примеси различных металлов и неметаллов, которые образуют различные гальванические пары железо — примесь. Железо, имея отрицательный стандартный электродный потенциал (-0,44 В) со многими примесями, потенциал которых значительно положительнее, является анодом, а примеси – катодом:
Анодный процесс: Fe 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 
в нейтральной или в щелочной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом атмосферной коррозии железа будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
Коррозионные гальванические элементы и электродные реакции
Электрохимической коррозией называется самопроизвольное разруше- ние металла под действием электрического тока, возникающего вследствие
 |
работы короткозамкнутых гальванических элементов на поверхности метал- ла при ее электрохимической неоднородности.
Рис. 2.7 Схема гальванического элемента
Рассмотрим работу обыкновенного гальванического элемента, состав- ленного из цинкового и медного электродов, погруженных в растворы со- лей их ионов с активностью 1г-ион/л (рис. 2.7):
До замыкания электродов на цинке и меди устанавливаются равновес- ные потенциалы:
Zn – 2е =↔ Zn2+, Е0 = – 0,76 В; Сu – 2е =↔ Cu2+, Е0 = + 0,337 В;
При замыкании электродов за счет разности потенциалов в цепи потечет ток. Цинк, как более активный металл, будет растворяться (Zn – 2е ↔® Zn2+) и посылать электроны во внешнюю цепь. На меди будет происходить процесс присоединения этих электронов катионами меди из раствора (Сu2+ + 2е ®↔ Cu). Эффективность такого гальванического элемента определяется разностью потенциалов электродов. Электрод (в данном случае цинковый), имеющий более отрицательный потенциал, называется анодом. Анодный процесс – это процесс окисления. Электрод (в данном случае медный), имеющий более положительный потенциал, называется катодом. Катодный процесс – это процесс восстановления.
|
Стандартную ЭДС такого элемента можно рассчитать по значениям энергии Гиббса: E0 = –ΔÄG0 /2F. По справочнику термодинамических вели- чин, стандартная энергия Гиббса реакции элемента Даниэля – Якоби равна:
ΔÄG0Т = –212,3 кДж/моль = –212,3 кВт·с/моль;
F = 96 500 Кл = 96 500 А·с/моль;

Таким образом, причиной появления тока в гальваническом элементе является разность потенциалов металлов.
На поверхности любого металла, находящегося в электролите, также возникают короткозамкнутые гальванические элементы, для работы кото- рых, очевидно, требуется разделение поверхности на катодные и анодные участки, характеризующиеся различными значениями потенциалов. В связи с этим принято говорить об электрохимической гетерогенности, т. е. неодно- родности поверхности. Причины возникновения электрохимической неодно- родности могут быть различными:
— неоднородность металлической фазы – наличие макро- или микровк- лючений, различная концентрация твердого раствора, неодинаковая степень обработки поверхности металла и т. д.;
— неоднородность защитных пленок на поверхности металла – наличие несплошных окисных пленок, пористость защитных пленок, неравномерное распределение на поверхности продуктов коррозии (соли и гидроксиды);
— неоднородность внутренних напряжений в металле;
— неоднородность жидкой фазы – различие в концентрациях собствен- ных ионов металла в электролите, различных солей, ионов водорода, кисло- рода и других окислителей;
— неоднородность физических условий – различие температур на уча- стках поверхности металла, неравномерное распределение внешнего элек- трического поля, неодинаковая освещенность поверхности металла и др.
 |
Рис. 2.8 Схема работы коррозионного микрогальванического элемента
При работе коррозионного микрогальванического элемента (рис. 2.8) одновременно протекают анодный и катодный процессы. Анодный процесс – переход ионов металла в раствор в виде гидратированных ионов и образова- ние некомпенсированных электронов на анодных участках:
Образовавшиеся некомпенсированные электроны перетекают по метал- лу от анодных участков к катодным. Катодный процесс – ассимиляция элек- тронов какими-либо ионами или молекулами, находящимися в растворе (де- поляризаторами), и способными к восстановлению на катодных участках: D
В табл. 2.4 приведены некоторые катодные реакции и их стандартные окислительно-восстановительные потенциалы.
| Электродная реакция | рН | Е0, В |
| H+ + e = 1/2H2 | 0,000 | |
| Fe3+ + e = Fe2+ | +0,771 | |
| O2 + 4H+ + 4e = 2H2O | +1,229 | |
| H2O2 + 2H+ + 2e = 2H2O | +1,776 | |
| O2 + 2H+ + 4e = 2OH- | +0,815 | |
| O2 + 2H2O + 4e = 4OH- | +0,401 |
Наибольшее значение в большинстве случаев электрохимической кор- розии металлов имеют следующие катодные реакции:
кислородная деполяризация О2 + 2Н2О + 4е = 4ОН-;
водородная деполяризация H+ + e = 1/2 H2.
Рис. 2.9 Диаграмма равновесия водородного и кислородного электродов при различных значениях рН среды
На рис. 2.9 представлена диаграмма, позволяющая определить возмож- ность протекания коррозии с водородной или кислородной деполяризацией. На диаграмме приведены линии электрохимического равновесия воды с про- дуктами ее восстановления (линия 1) или окисления (линия 2). Область, за- ключенная между этими линиями, является областью устойчивости воды. При потенциалах, лежащих вне этой области, вода термодинамически неус- тойчива: при потенциалах, лежащих положительнее линии 2, вода окисляет- ся, а отрицательнее линии 1 – восстанавливается. Линия 1 соответствует равновесию:
H+ + e = ½H2 (в кислой среде), (2.9)
H2O + e = ½H2 + OH- (в щелочной среде). (2.10)
Линия 2 соответствует равновесию:
O2 + 4e + 2H2O = 4OH- (2.11)
Исходя из уравнения (2.9) и учитывая, что стандартный потенциал во- дородного электрода принят равным нулю, а отрицательное значение деся- тичного логарифма активности ионов водорода есть величина рН, можно за- писать:
Из уравнения следует, что при изменении рН на единицу потенциал во- дородного электрода уменьшается на 0,059 мВ. Потенциал кислородного
электрода положительнее водородного электрода на 1,23 В, т.е.
В кислой среде (рН = 0) потенциалы водородного и кислородного элек- тродов будут иметь значения:
В нейтральной среде (рН = 7) потенциалы водородного и кислородного электродов будут иметь значения:
Таким образом, учитывая конкретные анодную и катодную реакции, можно определить возможность протекания коррозии и тип катодной депо- ляризации.
На диаграмме отмечены значения стандартных потенциалов некоторых металлов. Те металлы, потенциалы которых располагаются выше линии рав- новесия водородного или кислородного электрода, могут корродировать со- ответственно с водородной или кислородной деполяризацией. Металлы, по- тенциалы которых ниже линии равновесия кислородного электрода, корро- дировать не должны. Они будут корродировать только в том случае, если в растворе будет находиться какой – либо другой деполяризатор, потенциал восстановления которого будет положительнее потенциалов этих металлов.
В реальных условиях, вследствие гетерогенности поверхности металла, короткозамкнутые двухэлектродные гальванические элементы встречаются крайне редко. Поверхность корродирующего металла представляет собой многоэлектродный, т. е. состоящий из нескольких, отличающихся друг от друга по потенциалам электродов, гальванический элемент. Если в двухэлек- тродном элементе распределение катодных и анодных участков вполне оп- ределенное, то в многоэлектродном элементе это распределение зависит от многих факторов. Электрод с наиболее отрицательным потенциалом будет анодом, а с наиболее положительным – катодом. Тип электродов с промежу- точными потенциалами зависит от значения электродных потенциалов с крайними значениями, площади электродов, их поляризуемости и от сопро- тивления проводников, соединяющих электроды. Например, в трехэлектрод- ном элементе
цинковый электрод является анодом, медный – катодом. Тип железного электрода зависит от его положения. Если железный электрод находится вблизи анода, то он является катодом, если ближе к катоду – анодом. Если один электрод (например катод) имеет сравнительно большую поверхность
по сравнению с другими электродами, т. е. в процессе работы он мало поля- ризуется, то остальные электроды, как правило, превращаются в электроды противоположного знака (аноды).
Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n + , OH — и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H + ½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что 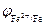
анод (Fe): Fe 0 ® Fe 2+ + 2ē
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe 0 + 2H + ® Fe 2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 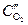
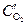
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 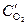
катод (Cu( 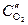
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al 0 ® Al 3+ + 3ē
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:

Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 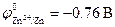
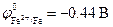
анод (Zn): Zn 0 ® Zn 2+ + 2ē
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
http://zdamsam.ru/a23713.html
http://helpiks.org/9-5176.html