Электролитическая диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т.е. как сильные электролиты (первичная диссоциация).
Пример 2.9. Первичная диссоциация комплексных соединений.
комплексная соль катионного типа:
комплексная соль анионного типа:
Комплексные частицы, или комплексы (молекулыили ионы), в свою очередь,диссоциируют лишь частично (aдис 2+ ⇄ [Cu(NH3)3] 2+ + NH3 ; (К1)
Прочность комплекса обычно характеризуют полной константой равновесия его диссоциации.Константа суммарной реакции диссоциации комплекса называется константой нестойкости КН. Она равна произведению констант диссоциации отдельных ступеней. Например, для суммарного уравнения для всех 4-х ступеней
константа нестойкости равна:
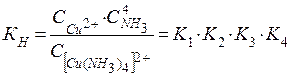
В общем виде для диссоциации комплекса [ MХn] Z :
[ MХ] Z ⇄ 
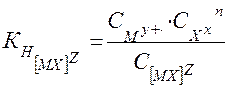
где z – заряд комплекса; n – заряд комплексообразователя; m – заряд лиганда.
Из приведенного уравнения легко определить концентрацию ионов комплексообразователя, образующихся при диссоциации комплекса, если принять, что активности ионов равны концентрациям, и в растворе нет избытка лигандов.
Чем меньше КН, тем прочнее комплекс.
Константа процесса, обратного диссоциации комплекса, т.е. процесса образования комплекса, называется константой устойчивости комплекса (Ку):
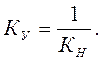
Чем больше значение Ку, тем устойчивее комплексная частица.
Значения констант нестойкости некоторых комплексных ионов приведены в табл.12.
Константы нестойкости комплексных ионов при 298 К
| Комплексный ион | КН | Комплексный ион | КН |
| [AgCl2] — | 1,76 ∙10 -5 | [Hg(NH3)4] 2+ | 5,3∙10 -20 |
| [Ag(NH3)2] + | 9,3∙10 -8 | [Co(NH3)4] 2+ | 2,8∙10 -6 |
| [ Ag(CN)2] — | 8∙10 -22 | [Fe(CN)6] 4- | 1,1∙10 -24 |
| [AgBr2] | 7,8∙ 10 -8 | [Fe(CN)6] 3- | 1∙10 -31 |
| [Cu(NH3)4] 2+ | 2,14∙10 -13 | [Zn(NH3 )4] 2+ | 3,46∙10 -10 |
| [Cu(CN)4] 2- | 9,6 ∙10 -29 | [Zn(OH)4] 2- | 3,6∙10 -16 |
| [Cd(NH3)4] 2 + | 7,56∙10 -8 | [Ni(NH3)4] 2 + | 1,12∙10 -8 |
| [Cd(CN)4] 2- | 1,41∙10 -19 | [Ni(CN)4] 2 — | 1,8∙10 -14 |
| [HgCl4] 2 — | 8,5∙10 -16 | [PbBr4] 2- | 1,1∙10 -3 |
| [Hg(NH3)4] 2 + | 5,4∙10 -20 | [CuCl4] 2 — | 6,4∙10 -6 |
| [HgBr4] 2 — | 1,1∙10 -21 | [CdI4] 2 — | 8,1∙10 -7 |
| [Hg(CN)4] 2- | 4,0∙10 -42 | [Co(NH3)6] 2 + | 7,8∙10 -6 |
| [HgI4] 2 — | 1,48∙10 -30 | [Co(NH3)6] 3+ | 7,1∙10 -36 |
Задача 2.2.Рассчитайте концентрацию ионов Ag + в 0,02 М растворе Na[Ag(CN)2] а) в отсутствии избытка лиганда; б) при наличии избытка ионов (СN) — при их концентрации в растворе NaCN 0,5 М.
а) Уравнение первичной диссоциации комплексной соли как сильного электролита:
Na[Ag(CN)2] 
Уравнение суммарной диссоциации комплекса:
[Ag(CN)2] + ⇄ Ag + + 2 (CN ) — , а КН = 8∙10 -22 (см. табл.12).
Обозначим через x концентрацию Ag + . Тогда равновесная концентрация лиганда согласно уравнению равна 2 x, а равновесная концентрация недиссоциированного комплексного иона – (0,02 – х). Так как значение Кн очень мало, величиной х по сравнению с 0,02 можно пренебречь. С учетом этого запишем выражение для Кн:
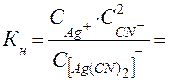

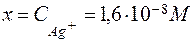
б) Концентрацию Ag + рассчитываем аналогично, но концентрацию лиганда (CN) — принимаем равной 0,5 М:
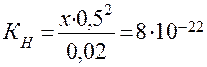
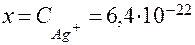
Таким образом, в 0,5 М растворе NaCN концентрация ионов Ag + почти на 14 порядков ниже, чем концентрация ионов [H + ] в воде.
Контрольное задание N 2
В соответствии с номером Вашего варианта и данными табл. 6 письменно ответьте на следующие вопросы.
Вопрос 1. Напишите уравнение первичной диссоциации комплексной соли ХY в водном растворе; укажите внутреннюю и внешнюю сферы.
Вопрос 2. Напишите уравнения ступенчатой диссоциации и суммарной диссоциации комплексной части соли XY.
Вопрос 3. Рассчитайте концентрацию ионов комплексообразователя в растворе соли XY c концентрацией СXY моль/л: а) в отсутствие избытка лиганда; б) при избытке лиганда с концентрацией 0,1 моль/л.
Диссоциация комплексных соединений
Константа нестойкости
В водных растворах комплексные соединения диссоциируют в две стадии. Первая стадия протекает по типу сильных электролитов, т.е. идет процесс полной диссоциации на внутреннюю и внешнюю сферу:
По второй стадии комплексный ион диссоциирует как слабый электролит обратимо, ступенчато и для каждой ступени есть своя ступенчатая константа:
[AgCN] ÛAg + + CN — К2
Суммарный процесс диссоциации комплексного иона можно представить схемой: [Ag(CN)2] — Û Ag + + 2CN — Кн
К равновесному процессу диссоциации комплексного иона применим закон действующих масс. Общая константа диссоциации комплексного иона запишется:

Практически пользуются общей константой, называемой константой нестойкости Кн, которая равна произведению промежуточных ступенчатых констант диссоциации комплексного иона Кн = К1×К2.
Константой нестойкости называется отношение произведения концентраций продуктов диссоциации комплексного иона в соответствующих степенях к равновесной концентрации неионизированных комплексных ионов. Причем чем меньше константа нестойкости, тем прочнее комплексный ион.
Величина, обратная константе нестойкости, называется константой устойчивости, или константой образования, Куст. = 1/Кн.
Значения констант нестойкости комплексных ионов и их показатели даются в справочниках (см. список рекомендуемой литературы), некоторые приведены в табл. IV. Показатель константы нестойкости равен десятичному логарифму константы, взятому с обратным знаком: рКн = -lgКн
Следует обратить внимание, что сравнивать прочность комплексов по величинам констант нестойкости можно только для однотипных комплексных ионов, т.е. дающих при диссоциации одинаковое число ионов. Например:
т.к. константа нестойкости цианида намного меньше, чем аммиаката, то можно говорить о его большей прочности:
Из двух аммиаков прочнее комплексный ион меди, т.к. его константа нестойкости меньше.
Зная величины констант нестойкости можно рассчитать концентрации ионов, входящих в состав внутренней сферы, судить о возможном направлении реакции при открытии ионов, о выборе реагентов для разрушения комплексных ионов.
Решение типовых задач
Задача 1. Вычислить равновесную концентрацию иона меди Cu 2+ и степень диссоциации комплексного иона в 0,01 М растворе [Cu(NH3)4]SO4, Кн = 9,3×10 -13 .
Решение. Запишем уравнение диссоциации комплексного иона:
Обозначим равновесную концентрацию иона меди [Cu 2+ ] = х моль/л, тогда равновесные концентрации остальных частиц равны [NH3] = 4x моль/л, [Cu(NH3) 



256х 5 = 9,3×10 -14 ;

получаем [Cu 2+ ] = 8,2×10 — 4 моль/л.



Задача 2.В каком из 0,1 молярных растворов комплексных солей дицианоаргентата (1) калия и хлорида диамминсеребра (1) концентрация ионов серебра больше и во сколько раз?
Решение. Запишем уравнения диссоциации комплексных ионов [Ag(NH3)2] + и [Ag(CN)2] — :
На основании этих равновесий запишем выражения констант нестойкости:


По таблице IV находим величины констант нестойкости: Кн / = 5,8×10 -8 , Кн // = 1,4×10 -20 . Сравнивая константы, т.к. комплексные ионы однотипные, делаем вывод, что концентрация ионов серебра в дицианоаргентате калия меньше, чем в хлориде диамминсеребра.
Для того, чтобы ответить на вопрос «во сколько раз концентрация ионов серебра в одном растворе больше, чем в другом?», можно провести последовательные вычисления концентрации ионов серебра для каждого из комплексных ионов, как в задаче 1.
Рассмотрим 2-ой путь решения.
Все обозначения и преобразования сделаем, как в задаче 1, обозначив для аммиаката концентрации одним штрихом, а для цианида – двумя штрихами:


0,1 — х / ≈ 0,1 и 0,1 — х // ≈ 0,1, т.к. степени диссоциации комплексных ионов малы.


Выразим х / и х // : 

Разделив х / на х // , получим: 





Задача 3. Вычислите равновесную концентрацию ионов ртути в 0,1 М растворе K2[HgJ4], содержащем 0,01 М KJ, Кн = 1,48×10 — 30 .
Решение. Запишем уравнение процесса диссоциации комплексного иона [HgJ4] 2 — :
[HgJ4] 2 — Û Hg 2+ + 4J —
константа нестойкости ионов ртути равна: 
Выражение для концентрации ионов ртути запишется:

Подставим равновесные концентрации комплексного иона [HgJ4 — 2 ] = 0,1 моль/л и ионов иода [J — ] = 0,01 моль/л, пренебрегая той малой частью, которая образуется при диссоциации комплексного иона, в выражение (1) и проведем вычисление концентрации ионов ртути в растворе:
[Hg 2+ ] = 
Задача 4. Произойдет ли разрушение комплекса, если к 0,02 М раствору K2[HgJ4] прилить равный объем 0,02 М раствора нитрата свинца?
Решение. Комплексный ион будет разрушаться, если будет выполняться условие [Pb 2+ ] × [J — ] 2 ≥ ПР (PbJ2). При этом ионы иода будут связываться в осадок, что вызовет смещение равновесия диссоциации комплексного иона вправо до полного его разрушения. Найдем концентрацию [Pb 2+ ] и [HgJ4] — 2 в растворе после смешивания. Концентрации уменьшаются в 2 раза и соответственно равны: [Pb 2+ ] = 0,01 моль/л, [HgJ4 -2 ] = 0,01 моль/л. Комплексный ион [HgJ4] — 2 диссоциирует по уравнению: [HgJ4] — 2 Û Hg 2+ + 4J —
константа нестойкости равна: 
обозначив концентрацию распавшихся комплексных ионов через х моль/л, тогда равновесные концентрации ионов будут равны: [Hg 2+ ] = х моль/л; [J — ] = 4х моль/л;
[HgJ4 2- ] = (0,01-х) ≈ 0,01 моль/л, т.к. х — 30 ; 256х 5 = 1,48 × 10 — 32 ;

Т.к. за х мы обозначили концентрацию продиссоциировавшей части комплексного иона, то [J — ] = 4х = 4×1,4×10 — 7 = 5,6×10 — 7 (моль/л). Находим произведение концентраций ионов свинца и йода в растворе:
[Pb 2+ ] × [J — ] 2 = 10 -2 × (5,6×10 — 7 ) 2 = 31,4×10 — 16 = 3,1×10 — 15 .
По таблице II находим произведение растворимости йодида свинца: ПР(PbJ2) = 1,1×10 — 9 . Так как 3,1×10 — 15 — 9 , то осадок не выпадает и комплексный ион не разрушается.
Задача 5. Вычислить растворимость бромида серебра (в моль/л) в 1 М растворе аммиака.
Решение. При растворении бромида серебра в растворе аммиака протекают следующие процессы: AgBr↓ Û Ag + + Br —
Суммарное уравнение процесса растворения:
Для данного процесса запишем константу равновесия:
Умножив числитель и знаменатель на равновесную концентрацию ионов серебра [Ag + ], получим после преобразований:

Вычислим Кр, взяв из таблиц значения ПР и Кн:

Обозначим равновесную концентрацию ионов брома [Br — ] = Р моль/л (т.к. она равна растворимости бромида серебра), тогда [Ag(NH3)2 + ] = Р моль/л, а равновесная концентрация аммиака 1-2Р ≈ 1, т.к. Р — 3 (моль/л).
Задача 6.Сколько миллилитров 1М раствора аммиака следует взять для полного растворения 0,1 г бромида серебра?
Решение. Растворимость бромида серебра вычисляем, как в задаче 5.

Вычислив количество вещества бромида серебра:

рассчитываем объем 1М раствора аммиака:

Задача 7. Сколько моль/л аммиака необходимо добавить к 0,02 М раствору нитрата серебра, чтобы понизить равновесную концентрацию ионов серебра до 1×10 — 7 моль/л?
Решение. Запишем общую схему диссоциации комплексного иона: [Ag (NH3)2] + Û Ag + + 2NH3.
Константа нестойкости его запишется: 
По условию концентрация ионов серебра [Ag + ] = 1×10 — 7 моль/л, а исходная концентрация ионов серебра в растворе AgNO3 равна [Ag + ]исх. = 
[Ag (NH3)2 + ] = [Ag + ]исх. — [Ag + ] = 2×10 — 2 — 1×10 — 7 ≈ 2×10 — 2 (моль/л).
Находим равновесную концентрацию аммиака:


Т.к. часть аммиака расходуется на образование комплекса и равна удвоенной концентрации ионов серебра, то общая концентрация аммиака равна:
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
http://megaobuchalka.ru/2/12697.html
http://studarium.ru/article/159









