Пособие–памятка по теме:«Электролитическая диссоциация» (9 класс).
методическая разработка по химии (9 класс) на тему
Пособие – памятка по теме:«Электролитическая диссоциация» (9 класс) включает краткие сведения по теории электролитической диссоциации С.А. Аррениуса, а также содержит определение понятий электролитическая диссоциация, сильные и слабые электролиты, ионные реакции в растворах электролитов и условия их протекания. Приведенные примеры, образцы и алгоритмы позволяют учащимся быстрее осваивать задания на воспроизведение материала темы и переходить к заданиям более высокого уровня сложности.
Скачать:
| Вложение | Размер |
|---|---|
| posobie_po_teme_elektroliticheskaya_dissociaciya.doc | 60 КБ |
Предварительный просмотр:
Электролитическая диссоциация – распад электролитов в водных растворах на ионы.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД), С.А. Аррениус:
- Электролиты в водных растворах диссоциируют на ионы: положительные (катионы) и отрицательные (анионы). Перешедшие в раствор ионы окружены молекулами воды – гидратированы.
- Сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов (раствор в целом электронейтрален)
- Процесс электролитической диссоциации обратимый. Наряду с диссоциацией происходит обратный процесс – ассоциация ионов.
Процесс диссоциации записывают в виде уравнений (уравнений электролитической диссоциации):
KCl = K + + Cl — ; Al 2 (SO 4 ) 3 = 2Al 3+ + 3SO 4 2- ; H 3 PO 4 ↔ H + + H 2 PO 4 —
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Сила электролита определяется степенью диссоциации ά. На степень диссоциации влияют: виды связей в веществе, природа растворителя, концентрация раствора (с уменьшением концентрации ά увеличивается), температура ( с ростом t ά увеличивается, т.к. диссоциация — процесс эндотермический).
Сильные электролиты диссоциированы практически нацело. В растворе нет молекул, есть только ионы.
сильные кислоты (не все кислоты!)- HNO 3 — азотная; HCl — соляная; H 2 SO 4 -серная; HBr- бромоводородная; HI- иодоводородная
сильные основания (все щелочи) – LiOH — гидроксид лития; NaOH — гидроксид натрия; KOH — гидроксид калия; Ca(OH) 2 – гидроксид кальция; Ba(OH) 2 – гидроксид бария
все растворимые соли
Неперечисленные вещества являются слабыми или средней силы электролитами или неэлектролитами .
Н 2 О – очень слабый электролит.
Кислоты, основания и соли в свете ТЭД
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода
HNO 3 = Н + + NO 3 — H 2 SO 4 = 2Н + + SO 4 2- сероводородная кислота Н 2 S ↔ Н + + НS —
Знак обратимости ↔ используется в уравнениях диссоциации
слабых и средней силы электролитов
Основания – это электролиты, диссоциирующие в растворах с образованием гидроксид — ионов (ОН — )
KOH = K + + OH — Ba(OH) 2 = Ba 2+ + 2OH —
Соли – это электролиты, диссоциирующие в растворах с образованием катионов металлов и анионов кислотных остатков
К 3 РО 4 = 3K + + PO 4 2- Al 2 (SO4) 3 = 2Al 3+ + 3SO 4 2-
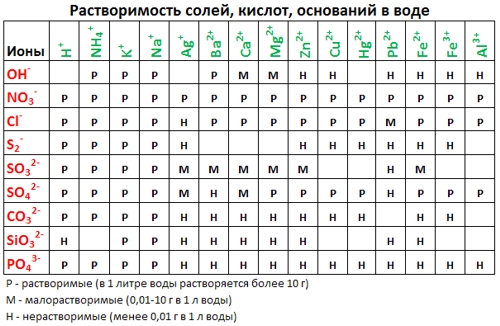
Формулы и заряды катионов металлов и анионов кислотных остатков есть в
таблице растворимости кислот, оснований, солей !
1.Электролиты в водных растворах диссоциируют:
- кислота = катионы водорода + анион кислотного остатка HCl = H + + Cl —
- основание = катион металла и гидроксид-анионы NaOH = Na + + OH —
- соль = катионы металла + анионы кислотного остатка КCl = К + + Cl —
2. Индекс в формуле вещества становится коэффициентом перед формулой иона в уравнении диссоциации
Na 2 CO 3 = 2 Na + + CO 3 2- FeCl 3 = Fe 3+ 3 Cl —
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с участием растворов электролитов, являются реакциями между ионами. Их принято записывать с помощью ионных уравнений.
Правила составления ионных уравнений:
- Напишите молекулярное уравнение (не забудьте про коэффициенты). По таблице растворимости определите растворимость всех веществ и запишите над формулами
Na 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2NaCl
- Перепишите это уравнение, записывая сильные электролиты как сумму соответствующих ионов, а слабые электролиты, нерастворимые и газообразные вещества – в молекулярной форме. Получите полное ионное уравнение
2Na + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2Na + + 2Cl —
- «Сократите» одинаковые ионы (выделены курсивом) в левой и правой части уравнения и запишите сокращенное ионно-молекулярное уравнение, отражающее суть процесса (показывает участвующие в реакции частицы и продукты реакции)
Ba 2+ + SO 4 2- = BaSO 4 ↓
Реакции в растворах могут протекать: 1) необратимо ; 2) обратимо ; 3) практически не идут
Реакции идут до конца (необратимо) , если концентрация
ионов в растворе уменьшается за счет связывания их c образованием:
А) нерастворимых и малорастворимых веществ
KCl + AgNO 3 = AgCl↓ + KCl
K + + Cl — + Ag + + NO 3 — = AgCl↓ + K + + NO 3 —
2H 3 PO 4 + 3BaCl 2 = Ba 3 (PO 4 ) 2 ↓ + 6HCl ( H 3 PO 4 – не сильный электролит, H 3 PO 4 ↔Н + + H 2 PO 4 — .
Иногда H 3 PO 4 записывают в недиссоциированном виде)
Вариант 1. 2 H 3 PO 4 + 3Ba 2+ + 6Cl — = Ba 3 (PO 4 ) 2 ↓ + 6H + + 6Cl —
2 H 3 PO 4 + 3Ba 2+ = Ba 3 (PO 4 ) 2 ↓ + 6H +
Вариант 2. 2H + + 2H 2 PO 4 — + 3Ba 2+ + 6Cl — = Ba 3 (PO 4 ) 2 ↓ + 6H + + 6Cl —
2H 2 PO 4 — + 3Ba 2+ = Ba 3 (PO 4 ) 2 ↓ + 4H +
K 2 S + 2HCl = 2KCl + H 2 S↑ (↑ — газ)
2K + + S 2- + 2H + + 2Cl — = 2K + + 2Cl — + H 2 S↑
2H + + S 2- = H 2 S↑
Газ получается также при образовании нестойких: угольной кислоты H 2 CO 3 = H 2 O + CO 2 ↑
сернистой кислоты H 2 SO 3 = H 2 O + SO 2 ↑
гидроксида аммония NH 4 OH = H 2 O + NH 3 ↑
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 ↑ + H 2 O
2Na + + CO 3 2- + 2H + + 2Cl — = 2Na + + 2Cl — + CO 2 ↑ + H 2 O
CO 3 2- + 2H + = CO 2 ↑ + H 2 O
В) слабых электролитов (обычно воды):
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2OH — + 2H + + 2Cl — = Ba 2+ + 2Cl — + 2H 2 O
2H + + 2OH — = 2H 2 O
упростим коэффициенты H + + OH — = H 2 O
Пример реакции, которая не идет до конца :
2NaCl + Ba(NO 3 ) 2 = BaCl 2 + 2NaNO 3
2Na + +2Cl — + Ba 2+ + 2NO 3 — = Ba 2+ + 2Cl — + 2Na + + 2NO3 —
Все ионы «сокращаются» — нет ионов, связывающихся и образующих продукты реакции.
По теме: методические разработки, презентации и конспекты
Разработка урока по теме Электролитическая диссоциация 11 класс
Урок Электролитическая диссоциация с использованием ИКТ, с рабочим листом для учащихся.
прооверочная работа по теме «Электролитическая диссоциация» 8 класс
проверочная работа по теме «Электролитическая диссоциация» в 8 классе.
Урок химии в 9 классе по теме «Электролитическая диссоциация»
Урок химии в 9 классе по теме «электролитическая диссоциация».
Тестовая контрольная работа по теме: «Электролитическая диссоциация», 9 класс
Работа состоит из заданий разного уровня сложности, составленных в соответствии с требованиями и спецификацией государственной итоговой аттестации. Имеются задания части С, предполагающие свобод.
Контрольная работа по теме «Электролитическая диссоциация» 9 класс
Данная контрольная работа проводится после изучения темы «Электролитическая диссоциация». Работа тестовая на два варианта. Содержит задания, аналогичные заданиям ГИА.
Урок по теме «Электролитическая диссоциация» (8 класс)
Теория электролитической диссоциации является очередной теоретической платформой. Она способствует развитию учения о периодичности, вносит дополнительные представления в систему знаний о строении веще.
Урок по теме «Электролитическая диссоциация» (8 класс)
Теория электролитической диссоциации является очередной теоретической платформой. Она способствует развитию учения о периодичности, вносит дополнительные представления в систему знаний о строении веще.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация: решение задач
Теоретический материал приведен на страницах:
Освежим в памяти основные моменты, которые необходимы при решении задач.
Степень диссоциации (α) — отношение кол-ва молекул, которые распались на ионы (N’), к общему кол-ву растворенных молекул (N):
| α = N’/N |
- α=0 — диссоциация отсутствует;
- α=0-3% — слабые электролиты — слабые кислоты (H2SO3, H2S, H2SiO3), слабые основания;
- α=3%-30% — средние электролиты;
- α=30%-100% — сильные электролиты — соли, сильные кислоты (HCl, HBr, HNO3, H2SO4(разб.)), некоторые основания (LiOH, KOH, NaOH);
- α=100% — полная диссоциация.
Степень диссоциации зависит от концентрации раствора.
Константа диссоциации электролита (K) — количественная характеристика диссоциации — отношение произведений концентрации ионов, образованных при диссоциации, к концентрации исходных частиц. Для электролита АВ, который диссоциирует по уравнению АВ↔A — +B + :
| K = ([A — ][B + ]):[AB] |
Константра диссоциации не зависит от концентрации веществ и может колебаться в очень ширком диапазоне — от 10 -16 до 10 15 .
Степень и константа диссоциации связаны между собой соотношением, называемым Законом разведения Оствальда:
| K = ([A — ][B + ]):[AB] = C(α 2 :(1-α)) |
Для слабых электролитов:
| K ≈ α 2 C α ≈ √(K/C) |
Диссоциация воды и её константа диссоциации:
| H2O ↔ H + +OH — K = ([OH — ][H + ]):[H2O] |
Поскольку вода является очень слабым электролитом, то концентрация [H2O] является практически неизменной, поэтому, остаётся постоянной и константа диссоциации воды (ионное произведение воды):
| Kω = [OH — ][H + ] = 10 -14 (при 25°C) |
Для чистой воды:
| [OH — ]=[H + ] = √10 -14 = 10 -7 моль/л |
На практике пользуются водородным показателем pH=-lg[H + ]:
- pH=7 — нейтральная среда;
- pH 7 — щелочная среда.
Диссоциация кислот и оснований
Константа диссоциации одноосновных кислот (Ka-кислотный тип диссоциации; А — -кислотный остаток):
| Kа = ([А — ][H + ]):[HА] |
Многоосновные кислоты диссоциируют в несколько стадий, у каждой из которых своя константа диссоциации.
Константа диссоциации оснований обозначается Kb.
Диссоциация малорастворимых веществ
Константа диссоциации малорастворимых веществ называется произведением растворимости (ПР).
| AgClтв=Ag + +Cl — K = ([Аg + ][Cl — ]):[AgClтв] ПР(AgCl) = [Аg + ][Cl — ] = const |
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
Взаимодействие солей с водой с образованием кислой и основной соли называется гидролизом.
Примеры решения задач
Пример 1 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода (H + ) с гидроксид-ионом (OH — ).
- ион водорода реагирует с гидроксид-ионом с образованием молекулы воды (реакция нейтрализации):
- ионы водорода образуются при диссоциации сильных кислот (HCl);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 2 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода с карбонат-ионом.
- карбонат-ионы реагируют с ионами водорода с образованием гидрокарбонат-ионов (реакция протекает при недостатке ионов водорода):
- второй вариант данной реакции — образование неустойчивой угольной кислоты, распадающейся на воду и оксид углерода (протекает при избытке ионов водорода):
- Молекулярные уравнения реакций:
Пример 3 . Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона серебра с гидроксид-ионом.
- ион серебра реагирует с гидроксид-ионом с образованием неустойчивого соединения гидроксида серебра, распадающегося на воду и оксид серебра:
- ионы серебра образуются при диссоциации растворимых солей серебра (AgNO3);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
Пример 4 . При взаимодействии каких растворов получится карбонат кальция (CaCO3)?
Из таблицы растворимости видно, что карбонат кальция нерастворим в воде.
- Сокращенное ионное уравнение для получения CaCO3 будет иметь следующий вид:
- Для решения задачи подойдет любое растворимое соединение кальция, которое будет диссоциировать с образованием ионов Ca 2+ , например, хлорид или нитрат кальция — CaCl2 или Ca(NO3)2;
- В качестве донора ионов CO3 2- сойдет любой растворимый в воде карбонат, например, Na2CO3 или K2CO3;
- Один из вариантов молекулярного уравнения:
Пример 5 . Растворы каких солей нужны для получения:
Пример 6 . Какие вещества образуются при взаимодействии растворов сульфата натрия (Na2SO4) и хлорида бария (BaCl2)?
- Из таблицы растворимости видно, что обе соли растворимы в воде:
- При слиянии растворов образуются катионы натрия и бария и анионы хлора и оксида серы. Из таблицы растворимости видно, что нерастворимую в воде соль даст сочетание Ba 2+ и SO4 2- :
- Уравнение реакции будет иметь вид:
Пример 7 . Какая соль выпадет в осадок при взаимодействии нитрата серебра (AgNO3) и хлорида кальция (CaCl2)? Написать уравнение реакции.
Пример 8 . Каким образом можно очистить поваренную соль (NaCl) от сульфата натрия (Na2SO4)?
Идея решения задачи заключается в добавлении в раствор поваренной соли и сульфата натрия вещества, способного распадаться на ионы, которые свяжут ионы оксида серы в нерастворимую соль, высвободив тем самым ионы натрия.
Роль связывающего вещества выполнит хлорид кальция CaCl2.
После того, как CaSO4↓ выпадет в осадок, полученный раствор необходимо будет отфильтровать, после чего в фильтрате будет присутствовать чистая поваренная соль.
Пример 9 . Написать молекулярное и ионное уравнение реакции хлорида алюминия с нитратом серебра.
- Молекулярное уравнение:
- Полное ионное уравнение:
- Сокращенное ионное уравнение:
Пример 10 . Рассчитать концентрацию ионов, образующихся при смешении 1 литра 0,25М раствора BaCl2 и 1 литра 0,5М раствора Na2SO4, после выпадения BaSO4 в осадок.
- Молекулярное уравнение реакции:
- Сокращенное ионное уравнение:
- Рассчитаем исходные кол-ва ионов:
- (Ba 2+ ) в обменной реакции присутствует в недостатке, поэтому, в реакцию вступает не 0,5, а только 0,25 SO4 2- ;
- Объем полученного раствора 1+1=2 литра;
- Рассчитаем молярные концентрации ионов:
Пример 11 . Рассчитать pH водного раствора 0,1М HCl; 0,1M NaOH.
- HCl — сильная кислота, диссоциирует полностью, уравнение диссоциации:
- NaOH — сильное основание, диссоциирует полностью, уравнение диссоциации:
Пример 12 . Рассчитать концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л (K=1,7·10 -5 ).
- Формула равновесия, установленного в водном растворе аммиака:
- Обозначим через x равновесную концентрацию [OH — ]; тогда [NH4 + ]=x; [NH3]=1,5-x:
Пример 13 . Какое кол-во осадка образуется при смешении 250 мл растворов нитрита лития (концентрация 0,3 моль/л) и фторида натрия (0,2 моль/л), если произведение растворимости фторида лития ПР(LiF)=1,5·10 -3 .
- Уравнение реакции:
- Рассчитаем исходные кол-ва ионов:
- Объем раствора равен 0,25+0,25=0,5 л
- Если обозначить через x моль кол-во выпавшего осадка LiF, тогда произведение концентрации ионов в растворе будет равно:
- Масса выпавшего осадка:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://studarium.ru/article/159
http://prosto-o-slognom.ru/chimia_primery/007-elektroliticheskaya_dissotsiatsiya.html