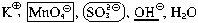
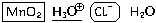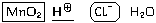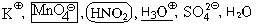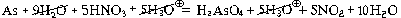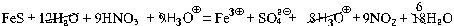Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
«Метод полуреакций, или электронно-ионного баланса»
Разделы: Химия
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:
Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР – методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой – восстанавливается, т.е. понижает валентность. Поэтому реакция невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между 
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция между 
Рассмотрим другой пример. Возможно ли взаимодействие между ионами 
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут выступать только в роли окислителя. Делают вывод: реакция между ионами 

Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того, при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов
Уравнивание осуществляется за счет ионов
и молекул воды.
- В щелочной среде ни в левой, ни в правой части не должно быть ионов
. Уравнивание осуществляется за счет ионов
и молекул воды.
- В нейтральной среде ни ионов
, ни
в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион 
Полуреакция восстановления:
Ионы 
Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов 






В результате получаем:
После этого можно объединить ионы в формулы реальных веществ:
Рассмотрим другой пример.
Задача. Закончить уравнение реакции 
Ион 
Полуреакция восстановления:
Если ион 
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
, ни
в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
- Перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
— его удвоенный коэффициент:
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции:
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
- Если ион
будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
- Оформляем уравнение ОВР, протекающей в щелочной среде:
- Добавляем недостающие катионы и анионы.
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором 
Составляем схему реакции:

Следовательно, схема полуреакции восстановления имеет вид:
Схема полуреакции окисления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
, ни
в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов. Перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
его удвоенный коэффициент. Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Составляем ионное уравнение:
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
Ион 

Используем правила оформления уравнений ОВР, протекающих в кислотной среде.

Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй – воду, в третий – концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. – М.:Дрофа,2005.
Уравнения электронно ионного баланса с кислотой
Особенностью ОВР в растворах (в частности, в водных) является возможность участия в этих реакциях растворителя (воды), а также продуктов автопротолиза растворителя (в случае воды – ионов оксония и гидроксид-ионов). В случае водных растворов это приводит к возможности протекания между одними и теми же исходными веществами разных реакций в разных средах: кислотной, нейтральной или щелочной. Так, между KMnO4 и KNO2 в растворе в зависимости от реакции среды могут протекать следующие химические реакции:
2MnO4 




2MnO4 



2MnO4 




Если известны все исходные вещества и продукты реакции, то, составляя уравнения таких реакций, можно пользоваться методом электронного баланса. Если же участники реакции не очевидны, то удобнее использовать метод электронно-ионного баланса (другое название – метод полуреакций). Использование этого (более сложного) метода оправдано еще и тем, что коэффициенты в уравнениях ОВР, протекающих в растворах, бывают довольно большими,(известна, например, реакция между тремя неорганическими веществами, сумма коэффициентов в уравнении которой равна 8600) и их подбор методом электронного баланса оказывается очень трудоемким.
Рассмотрим метод электронно-ионного баланса на примере реакции диоксида марганца с соляной кислотой (реакция используется в лабораториях для получения хлора).
1. Запишем, какие реально существующие вещества и частицы имеются в нашей химической системе до начала реакции. Составляя этот перечень, обратим внимание на то, что
- из нерастворимых веществ в нашей системе присутствует только MnO2,
- соляная кислота – кислота сильная, и в растворе нет молекул HCl,
- вода (соляная кислота – раствор хлороводорода в воде), наоборот, практически полностью состоит из молекул..
MnO2, H3O 

2. Для наглядности выделим окислитель (в данном случае MnO2), взяв его формулу в прямоугольную рамочку, и восстановитель (в данном случае Cl 
3. Запишем уравнение полуреакции восстановления окислителя. Эта операция разделяется на два этапа. На первом – добиваемся материального баланса (в правой и левой частях уравнения полуреакции – одинаковые атомы в равных количествах), а на втором этапе – зарядового (заряд в правой части уравнения равен заряду в левой).
Известно, что все соединения марганца в кислотной среде, восстанавливаясь, превращаются в ионы марганца(2
MnO2 Mn 2
В левой части схемы полуреакции присутствуют два » лишних» атома кислорода в степени окисления –II, которые в реакции не меняют своей степени окисления. Поскольку ион O 2A , являясь очень сильным основанием, в водном растворе существовать не может, атомы кислорода в кислотной среде могут быть связаны ионами оксония с образованием молекул воды:
MnO2 + 4H3O 

На этом этапе мы достигли материального баланса. Однако заряд в левой части схемы полуреакции не равен заряду в правой части (+4 е и +2 е). Для уравнивания зарядов прибавим в левой части полуреакции 2 электрона. Уравнение полуреакции окислителя готово:
MnO2 + 4H3O 

4. Запишем уравнение полуреакции восстановителя. При этом можно пользоваться следующим правилом: восстановитель обычно окисляется до ближайшей устойчивой в данных условиях степени окисления. Для хлора такой ближайшей степенью окисления будет ноль, следовательно, образуется газообразный хлор:
Cl 
Материальный баланс достигается в этом случае очень просто:
2Cl 
Для уравнивания заряда отнимем в левой части полуреакции два электрона:
2Cl 
5. Запишем теперь оба уравнения полуреакций в виде системы уравнений
MnO2 + 4H3O 

2Cl 
В данном случае число отданных электронов равно числу принятых.
6. Если сложить эти два уравнения (в данном случае не домножая на дополнительные множители), то электроны сократятся, и мы получим ионное уравнение реакции.
MnO2 + 4H3O 


7. Для написания молекулярного уравнения нам придется вернуться к самому началу наших рассуждений и вспомнить, что источником ионов оксония в нашей системе были только молекулы хлороводорода. Следовательно, четыре иона оксония образовались из четырех молекул HCl, а ионы марганца при удалении воды свяжутся с хлоридными ионами, образовав хлорид марганца(II):
MnO2 + 4HCl = MnCl2 +2H2O + Cl2
Два » лишних» хлорид-иона, добавленные нами в левой части уравнения, пошли на образование одной формульной единицы хлорида марганца(II). Четыре из шести образовавшихся молекул воды » входили в состав» ионов оксония и поэтому в молекулярном уравнении не учитываются.
Таким образом, алгоритм составления уравнения ОВР методом электронно-ионного баланса таков:
- Составить перечень веществ и частиц, присутствующих в системе до начала реакции.
- Найти среди них окислитель и восстановитель; определить реакцию среды.
- Составить уравнение полуреакции окислителя.
- Составить уравнение полуреакции восстановителя.
- Уравнять число принятых и отданных электронов.
- Составить ионное уравнение.
- Составить молекулярное уравнение.
Составляя этим методом уравнений ОВР, необходимо учитывать следующие основные правила:
1) при составлении уравнений полуреакций можно использовать только те вещества и частицы, которые присутствуют в данной системе;
2) продуктами полуреакций могут быть только те вещества и частицы, которые устойчивы в данной системе;
3) при составлении уравнения полуреакции окислителя нельзя использовать частицы восстановителя и наоборот, при составлении уравнения полуреакции восстановителя нельзя использовать частицы окислителя.
В рамках так называемой » теории электролитической диссоциации» (устаревшая, но все еще широко применяемая в учебной литературе теория, не учитывающая существование немолекулярных веществ и предполагающая самостоятельное сущесвование ионов водорода), вместо H3O 

MnO2 + 4H 

2Cl 
MnO2 + 4H 



MnO2 + 4HCl = MnCl2 +2H2O + Cl2
Как вы уже знаете, в кислотной, нейтральной или щелочной среде ОВР одних и тех же окислителей и восстановителей часто протекают с образованием различных продуктов реакции. Рассмотрим подробнее окислительно-восстановительные свойства соединений марганца, проявляемые ими в разных условиях.
При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту. Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
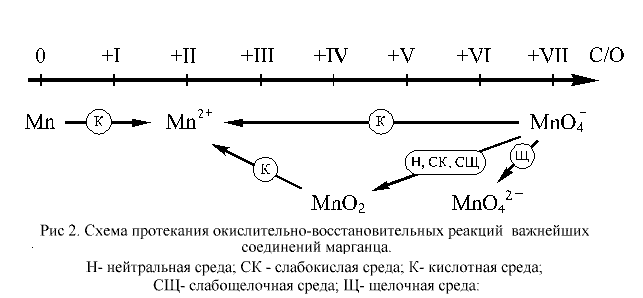
Для марганца известны соединения, в которых он проявляет все возможные степени окисления: от нуля до +VII. В ОВР, протекающих в растворах, чаще всего участвуют соединения марганца в степенях окисления +II, +IV, +VII и, отчасти, +VI. Соединения марганца(II) проявляют слабо выраженные восстановительные свойства. Соединения, содержащие марганец в степенях окисления +IV, +VI и +VII, – более или менее сильные окислители. Наиболее сильными окислителями являются соединения марганца в степени окисления +VII. Металлический марганец – довольно активный восстановитель.
Условия протекания окислительно-восстановительных превращений для соединений марганца можно представить в виде схемы, приведенной на рисунке 2.
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO4, в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной. Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании диоксида серы через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронно-ионного баланса.
1 и 2.
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO4 
3 – 5. В кислотной среде ион MnO4 


| 2 | MnO4  + 8H3O + 8H3O  + 5e – = Mn 2 + 5e – = Mn 2  + 12H2O + 12H2O |
| 5 | SO2 + 6H2O – 2e – = SO4 2  + 4H3O + 4H3O  |
6. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO4 


7. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь. Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при добавлении раствора азотистой кислоты к подкисленному раствору перманганата калия.
1 – 2.
3 – 5. Азотистая кислота – кислота слабая, поэтому в растворе она присутствует в основном в виде молекул. Она легко окисляется при добавлении сильных окислителей. При этом степень окисления азота повышается до ближайшей устойчивой, то есть до +V (устойчивый в газовой фазе диоксид азота в воде диспропорционирует). Единственная частица, содержащая атом азота(V) и устойчивая в водном растворе – нитрат-ион.
| 2 | MnO4  + 8H3O+ 5e – = Mn 2 + 8H3O+ 5e – = Mn 2  + 12H2O + 12H2O |
| 5 | HNO2 + 4H2O – 2e – = NO3  + 3H3O+ + 3H3O+ |
6. Ионное уравнение
2MnO4 


7. При переходе от ионного уравнения к молекулярному первое приходится удваивать, так как одна молекула серной кислоты образует два иона оксония.
Это уравнение можно записать и по-другому:
Оба уравнения правильные, так как отражают процесс, протекающий в растворе. При удалении воды кристаллизоваться будут все четыре соли [MnSO4, Mn(NO3)2, K2SO4, KNO3] причем в соотношении, определяемом их растворимостью, а не коэффициентами в каком-либо из уравнений.
Пример 3. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 – 2.
3 – 5. Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная, и перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания » лишних» атомов кислорода(–II) могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода(–II), превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
| 2 | 6 | MnO4  + 2H2O + 3e – = MnO2 + 4OH + 2H2O + 3e – = MnO2 + 4OH  |
| 1 | 3 | 2NH3 + 6H2O – 6e – = N2 + 6H3O  |
6. 2MnO4 


Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – » ионы водорода» , что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
2MnO4 

После приведения подобных членов получаем ионное уравнение:
2MnO4 


7. 2KMnO4 + 2NH3 = 2MnO2 + 2KOH + N2 
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.
| 2 | MnO4  + e – = MnO4 2 + e – = MnO4 2  |
| 1 | SO3 2  + 2OH + 2OH  – 2e – = SO4 2 – 2e – = SO4 2  + H2O + H2O |
2MnO4 




2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
Источником » недостающего» атома кислорода(–II) в щелочной среде могут быть только два гидроксидных иона, при попытке использовать молекулу воды или один гидроксидный ион образуются свободные ионы оксония, что в щелочной среде невозможно.
Диоксид марганца MnO2 в кислотной среде, как вы уже знаете, также проявляет свойства сильного окислителя, например, окисляет не только хлорид-ион до хлора, но и нитрит-ион до нитрат-иона, йодид-ион до йода и т. д. В свою очередь сам диоксид марганца получается при взаимодействии перманганата калия с растворами солей марганца(II) по реакции конмутации
2MnO4 

А устойчивый только в сильно щелочных растворах манганат калия K2MnO4 уже при незначительном подкислении и даже при разбавлении раствора водой диспропорционирует:
3MnO4 2 

Очень сильным окислителем является оксид марганца(VII). Это кислотный оксид (при обычных условиях жидкость), активно реагирующий с водой
и поглощающий ее из воздуха. Он легко окисляет аммиак (до N2), сероводород (до SO2), сульфиды (до сульфатов), монооксид углерода и органические вещества (до CO2), сам при этом восстанавливаясь до MnO2.
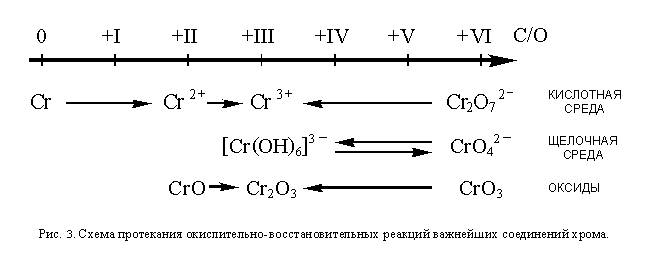
Как и марганец, хром также образует, соединения, в которых проявляет самые разнообразные степени окисления. Соединения хрома в низших степенях окисления являются восстановителями, а в высших – окислителями. Более или менее устойчивыми являются степени окисления О, +II, +III, и +VI (из них самая устойчивая +III). Как и для марганца, условия протекания окислительно-восстановительных превращений соединений хрома можно изобразить в виде схемы (см рис. 3).
В отличие от перманганат-иона, устойчивого как в кислотной, так и в щелочной среде, хромат-ион устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции
2CrO4 2 


Дихромат-ион, в свою очередь, устойчив только в кислотной и, отчасти, в нейтральной среде, а в щелочной превращается в хромат-ион:
Cr2O7 2 


Поэтому в кислотной среде протекают окислительно-восстановительные процессы только с участием иона Cr2O7 2 

Как и металлический марганец, хром проявляет восстановительные свойства, легко окисляясь ионами оксония (без доступа кислорода – до Cr 2 





Кристаллический триоксид хрома – очень сильный окислитель. Как и оксид марганца(VII), это кислотный оксид, легко реагирующий с водой с образованием хромовой кислоты H2CrO4. Следовательно, в ОВР он может вступать только в твердом виде. В частности, органические вещества при соприкосновении с CrO3 окисляются до углекислого газа, сероводород – до SO2, аммиак – до азота.
Составление уравнений ОВР с участием растворов соединений хрома полностью аналогично составлению уравнений реакций в случае соединений марганца, поэтому здесь приводятся лишь уравнения полуреакций ионов, содержащих хром:
Cr2O7 2 


CrO4 2 


[Cr(OH)6] 3 


Cr 2 
Азотная кислота и ее растворы – сильные окислители. Концентрированные растворы азотной кислоты окисляют большинство металлов (кроме золота, платины, тантала и некоторых других), многие неметаллы (бор, графит, серу, фосфор и др.) и многие сложные вещества (сероводород, сульфиды, низшие оксиды меди и железа, многие органические вещества и др.) С железом, алюминием, хромом и некоторыми другими металлами концентрированная азотная кислота реагирует с образованием плотных кислородсодержащих покрытий, препятствующих дальнейшему окислению металла; это явление называется » пассивацией» металла.
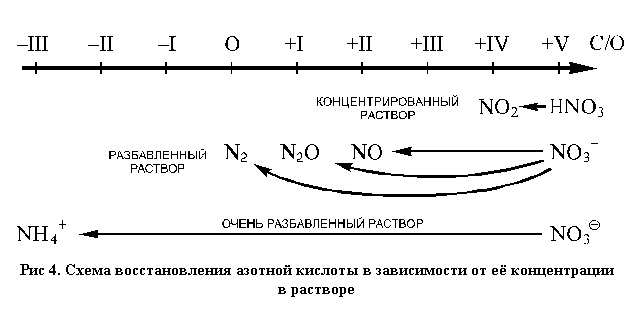
С уменьшением концентрации азотной кислоты (с разбавлением) ее окислительная активность уменьшается, что отчасти связано с уменьшением числа молекул HNO3 и увеличением числа ионов NO3 
При взаимодействии растворов азотной кислоты с восстановителями почти всегда образуются смеси продуктов, содержащих азот в различных степенях окисления (N2O помещен на схеме под степенью окисления +I условно, так как это усредненная степень окисления атомов азота в этом соединении. Истинные степени окисления здесь +I и +III. Также условно соединение это называется «оксид азота (I)» (см. рис. 4).
Однако во многих случаях можно выделить преимущественные направления реакций, то есть те реакции, продукты которых преобладают.
Так, в концентрированном растворе при спокойном протекании реакции (без взрыва или разброса веществ) азотная кислота восстанавливается до диоксида азота:
HNO3 + H3O 

По мере разбавления раствора в продуктах реакции появляется монооксид азота:
NO3 



При дальнейшем разбавлении могут протекать и два других процесса:
2NO3 



2NO3 



Три последние реакции в той или иной степени сопровождают друг друга. Соотношение газообразных продуктов зависит не только от концентрации кислоты и активности восстановителя, но и от температуры, которая во время реакции обычно не бывает постоянной. Поэтому преимущественное направление в каждом конкретном случае определяется экспериментально. Кроме того, в процессе реакции кислота расходуется, и ее концентрация понижается, что приводит к изменению соотношения продуктов реакции во времени. Тем не менее в подавляющем большинстве реакций разбавленная азотная кислота восстанавливается преимущественно до NO.
В очень разбавленных растворах азотная кислота проявляет окислительные свойства очень слабо и только по отношению к сильным восстановителям (магний, цинк, алюминий и подобные им металлы), при этом в растворе образуются ионы аммония:
NO3 





Вопреки распространенному мнению, во многих реакциях разбавленной азотной кислоты с металлами среди прочих газов выделяется и водород. Например, известно, что в реакциях с магнием или марганцем он образуется в количествах, вполне сопоставимых с количествами других выделяющихся газов. Однако ни при каких условиях водород не является единственным продуктом восстановления азотной кислоты.
Рассмотрим примеры реакций.
Пример 1. Составьте уравнение реакции концентрированной азотной кислоты с медью.
| 2 | HNO3 + H3O  + e – = NO2 + 2H2O + e – = NO2 + 2H2O |
| 1 | Cu – 2e – = Cu 2  |
Cu + 2HNO3 + 2H3O+ = Cu 2 

Так как источником ионов оксония является все та же азотная кислота, то в молекулярном уравнении записываем четыре молекулы HNO3, из которых две восстанавливаются, а две образуют нитратные ионы, идущие на связывание ионов меди. Окончательно получаем:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 
Пример 2. Составьте уравнение реакции концентрированной азотной кислоты с мышьяком.
| 5 | HNO3 + H3O  + e – = NO2 + 2H2O + e – = NO2 + 2H2O |
| 1 | As + 9H2O – 5e – = H3AsO4 + 5H3O  |
As + 5HNO3 = H3AsO4 + 5NO2 
В данном случае ионное уравнение совпадает с молекулярным.
Аналогично, с образованием соответствующих кислот, концентрированная азотная кислота реагирует с другими неметаллами, проявляющими восстановительные свойства (B, P, P4, S8 и др.)
Пример 3. Составьте уравнение реакции концентрированной азотной кислоты с сульфидом железа(II).
| 9 | HNO3 + H3O  + e – = NO2 + 2H2O + e – = NO2 + 2H2O |
| 1 | FeS + 12H2O – 9e – = Fe 3  + SO4 2 + SO4 2  + 8H3O + 8H3O  |
В молекулярном уравнении в этом случае будет присутствовать Fe2(SO4)3, поэтому для получения трех сульфат-ионов мы вынуждены коэффициенты в уравнении утроить:
3FeS + 30HNO3 = Fe2(SO4)3 + Fe(NO3)3 + 27NO2 
Пример 4. Составьте уравнение реакции разбавленной азотной кислоты с железом.
| 1 | NO3  + 4H3O + 4H3O  + 3e – = NO + 6H2O + 3e – = NO + 6H2O |
| 1 | Fe – 3e – = Fe 3  |
Fe + NO3 

Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Как уже отмечалось, NO в этом случае – не единственный продукт восстановления HNO3.
Пример 5. Составьте уравнение реакции разбавленной азотной кислоты с сероводородом.
Концентрированная азотная кислота окисляет газообразный сероводород (так же как и сульфиды) до сульфат-ионов, а разбавленная – только до серы:
| 2 | NO3  + 4H3O + 4H3O  + 3e – = NO + 6H2O + 3e – = NO + 6H2O |
| 3 | H2S + 2H2O – 2e – = S + 2H3O  |
2NO3 

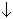
2HNO3 + 3H2S = 2NO + 4H2O + 3S
До серы окисляются разбавленной азотной кислотой и сульфиды (как растворимые, так и нерастворимые).
Пример 6. Составьте уравнение реакции, протекающей при взаимодействии магния с очень разбавленной азотной кислотой.
| 1 | 2 | NO3  + 10H3O + 10H3O  + 8e – = NH4 + 8e – = NH4  + 13H2O + 13H2O |
| 4 | 8 | Mg – 2e – = Mg 2  |
4Mg + NO3 


4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
В отличие от азотной кислоты, в которой при любых концентрациях атомами-окислителями являются атомы азота, в серной кислоте атомы серы являются окислителями только в концентрированных растворах (и, конечно, в безводной серной кислоте). Концентрированная серная кислота – сильный окислитель, по окислительной способности почти не уступающий концентрированной азотной кислоте, а в некоторых случаях даже превосходящий ее. Она реагирует, почти со всеми восстановителями, с которыми реагирует концентрированная азотная кислота. Концентрированной серной кислотой, как и азотной, часть металлов пассивируется.
Уравнение полуреакции восстановления серной кислоты в концентрированном растворе:
H2SO4 + 2H3O 

В случае взаимодействия с сильными восстановителями среди продуктов реакции могут встречаться сера и сероводород, но они будут образовываться только в случае бурно протекающей реакции, сопровождающейся обильным выделением газообразных продуктов. В обычных условиях и сера, и сероводород успевают прореагировать с концентрированной серной кислотой, окисляясь до диоксида серы.
В разбавленных растворах и сульфат-ион, и гидросульфат-ион окислительными свойствами (за счет атомов серы) не обладают. Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, то есть, она ведет себя так же, как и другие кислоты-» неокислители» (HCl, HBr, CH3COOH и т. п.). Уравнение полуреакции в этом случае:
2H3O 

Рассмотренные нами особенности окислительной активности азотной и серной кислот, в зависимости от их концентрации иллюстрируют общее правило: окислительные свойства окислителей в концентрированных растворах проявляются сильнее, чем в разбавленных. То же относится и к растворам восстановителей.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://urok.1sept.ru/articles/520408
http://www.chem.msu.ru/rus/school/zhukov/18.html


 Уравнивание осуществляется за счет ионов
Уравнивание осуществляется за счет ионов 









 ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед 






 будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде: