Уравнения химических реакций 10 класс габриелян
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества называют карбоновыми кислотами?
Карбоновыми кислотами называют органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом.
Приведите формулы и названия пяти представителей гомологического ряда предельных одноосновных карбоновых кислот.
Метановая (муравьиная) кислота H―COOH,
этановая (уксусная) кислота CH3―COOH,
пропановая (пропионовая) кислота CH3―CH2―COOH,
бутановая (маслянная) кислота CH3―CH2―CH2―COOH,
пентановая (валериановая) кислота CH3―CH2―CH2―CH2―COOH
Задание 2
Напишите формулы следующих кислот:
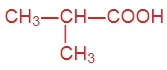 | 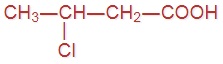 | 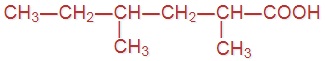 |
Задание 3
Молярная масса предельной одноосновной карбоновой кислоты равна 130 г/моль. Какова молекулярная формула этой кислоты. Дано:
Дано: M(CnH2n+1COOH)=130 г/моль
Найти: формула CnH2n+1COOH−?
Решение
По условию задачи M(CnH2n+1COOH)=130 г/моль, поэтому Mr(CnH2n+1COOH)=130
Mr(CnH2n+1COOH)=(n+1)•Ar(C)+(2n+2)•Ar(H)+2•Ar(O)=(n+1)•12+(2n+2)•1+2•16=12n+12+2n+2+32=14n+46
Составляем алгебраическое уравнение и решаем его:
14n+46=130
14n=130 — 46
14n=84
n=84 : 14
n=6, поэтому формула кислоты: C6H13COOH
Ответ: C6H13COOH
Задание 4
Какие признаки верно отражают свойства уксусной кислоты:
1) газообразное вещество;
2) без запаха;
3) с резким запахом;
4) плохо растворима в воде;
5) слабый электролит?
Задание 5
В пищевой промышленности уксусную кислоту используют как регулятор кислотности и консервант (код E260). Напишите структурные формулы предыдущего и последующего представителей данного гомологического ряда, имеющих коды E236 и E280 соответственно.
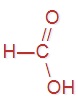 | 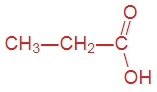 |
Напишите уравнение реакции получения каждой кислоты.
Во время кипячения спирта с окислителем спирт окисляется до карбоновой кислоты:
CH3OH + О2 t,кат. ⟶ HCOOH + H2O
C3H7OH + O2 t,кат. ⟶ C2H5COOH + H2O
Задание 6
В чём сходство и различие химических свойств неорганических и органических кислот? Ответ подтвердите уравнениями химических реакций.
Сходство.
1) Реагируют с активными металлами с образованием солей и выделением водорода:
Ca + 2HCl ⟶ CaCl2 + H2↑
Ca + 2CH3COOH ⟶ (CH3COO)2Ca + H2↑
2) Реагируют с оксидами металлов с образованием солей и воды:
MgO + 2HCl ⟶ MgCl2 + H2O
MgO + 2CH3COOH ⟶ (CH3COO)2Mg + H2O
3) Реагируют с основаниями с образованием солей и воды:
NaOH + HCl ⟶ NaCl + H2O
NaOH + CH3COOH ⟶ CH3COONa + H2O
4) Реагируют с солями, если в результате реакции выделяется газ, образуется осадок или слабый электролит:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑
Различие.
Карбоновые кислоты в присутствии концентрированной серной кислоты вступают во взаимодействие со спиртами, с образованием сложных эфиров (реакция этерификации):
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O (при H2SO4(конц.))
Задание 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этан ⟶ хлорэтан ⟶ этиловый спирт ⟶ уксусный альдегид ⟶ уксусная кислота ⟶ ацетат калия и этиловый эфир уксусной кислоты.
C2H6 + Cl2 ⟶ C2H5Cl + HCl
C2H5Cl + NaOH ⟶ C2H5OH + NaCl
2C2H5OH + O2 t,кат. ⟶ 2CH3CHO + 2H2O
2CH3CHO + O2 кат. ⟶ 2CH3COOH
CH3COOH + KOH ⟶ CH3COOK + H2O
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O (при ⇄H2SO4(конц.))
Задание 8
Достаточно ли 100 г 66%-ного раствора уксусной кислоты для растворения 30 г карбоната кальция? Какая масса ацетата кальция при этом получится?
Дано: m(раствора)=100 г, ω(CH3COOH)=66%, m(CaCO3)=30 г
Найти: m ((CH3COO)2Ca)—?
Решение
1. Рассчитываем массу уксусной кислоты в растворе:
m( CH3COOH )=ω( CH3COOH )•m(раствора):100%=66%•100 г:100%=66 г
2. Количество вещества рассчитываем по формуле: n=m/M, где M ― молярная масса.
M( CH3COOH )=60 г/моль, M(CaCO3)=100 г/моль
n( CH3COOH )=m( CH3COOH )/M( CH3COOH )=66 г : 60г/моль=1,1 моль
n( CaCO3 )=m( CaCO3 )/M( CaCO3 )=30 г : 100 г/моль=0,3 моль
3. Составим химическое уравнение:
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑
По уравнению реакции 1 моль карбоната кальция реагирует с 2 моль уксусной кислоты, поэтому с 0,3 моль карбоната кальция прореагирует в 2 раза больше количества вещества уксусной кислоты, то есть 0,6 моль. По условию задачи имеем 1,1 моль уксусной кислоты, следовательно кислота взята в избытке (её хватит), она реагирует не полностью, поэтому расчеты будем проводить по данным карбоната кальция.
По уравнению реакции количество вещества карбоната кальция и ацетата кальция одинаковое, поэтому:
n( (CH3COO)2Ca )=n( CH3COOH )=0,3 моль
4. Рассчитываем массу карбоната кальция количеством вещества 0,3 моль по формуле: m = n • M, где M ― молярная масса.
M ( (CH3COO)2Ca )=158 г/моль
m( (CH3COO)2Ca )=n ( (CH3COO)2Ca ) • M( (CH3COO)2Ca )=0,3 моль • 158 г/моль=47,4 г
Ответ: уксусной кислоты достаточно; получится 47,4 г ацетата кальция.
Задание 9
Почему жжение от ужаления муравья утихает, если потереть пострадавшее место нашатырным спиртом (водным раствором аммиака)?
Происходит нейтрализация муравьиной кислоты, которая вызывает жжение и содержится в составе жалящей жидкости, с аммиаком, содержашемся в составе нашатырного спирта:
HCOOH + NH3 ⟶ HCOONH4
Нашатырный спирт представляет собой водный раствор аммиака с массовой долей растворенного вещества 10%.
Задание 10
Докажите с помощью уравнений реакций, что муравьиная кислота может проявлять как свойства альдегидов, так и свойства кислот. Муравьиная кислота, в отличие от других карбоновых кислот, содержит альдегидную группу CНO, поэтому как и альдегиды, способна реагировать с аммиачным раствором оксида серебра (при этом происходит восстановление серебра) и со свежеполученным осадком гидроксида меди (II) при нагревании (при этом медь восстанавливается до одновалентной меди) :
HCOOH + Ag2O аммиачный р-р t → H2O + CO2 + 2Ag↓
HCOOH + 2Cu(OH)2 ⟶ Cu2O + CO2 + 3H2O
Задание 12
Есть ли у вас на кухне уксусная кислота? Какие правила техники безопасности необходимо соблюдать при её использовании? Почему?
С уксусной кислотой необходимо обращаться очень осторожно, т.к. её пары могут вызвать ожоги дыхательных путей и слизистых оболочек глаз.
ГДЗ по химии 10 класс О.С. Габриелян Базовый уровень
Изучение химии в старших классах сложный и трудоемкий процесс. К сожалению, не все успешно с ним справляются и допускаемые ошибки крайне негативно влияют на успеваемость. ГДЗ по химии 10 класс базовый уровень Габриелян помогут исправить ситуацию в лучшую сторону.
Страницы онлайн-сборника содержат досконально расписанные и верные ответы. С их помощью ученик сможет подробно разобраться во всех тонкостях дисциплины, а также:
- быстро и правильно выполнить домашнее задание;
- заблаговременно подготовиться к текущему уроку;
- проработать дополнительно изученные темы.
Решебник имеет ту же структуру, что и учебное пособие. Расположение номеров имеет полное соответствие и найти нужный номер с необходимым заданием легко и просто. Это во многом экономит время и силы школьника. ГДЗ даст возможность подтянуть оценки и повысить уровень успеваемости самостоятельно, не прибегая к услугам дорогостоящих репетиторов.
Для чего нужен решебник по химии за 10 класс Габриеляна (Базовый уровень)
Химия относится к естественным наукам. В область её изучения входят вещества, их строение, свойства и взаимодействие друг с другом. Представить современную жизнь без этой науки невозможно. Она широко применяется практически во всех отраслях промышленности и является сырьевой базой фармакологии и сельского хозяйства. Кроме этого с её проявлениями мы сталкиваемся ежесекундно. Даже внутри нас происходят химические реакции: переваривание пищи, дыхание, обмен веществ и др, поэтому элементарными навыками и умениями химического характера должен обладать каждый человек. Учебная программа десятого года обучения разработана с учётом применения уже имеющихся знаний, приобретенных в предыдущих классах. Старшеклассники рассмотрят современную теорию строения органических веществ и механизм протекания химических реакций. Курс невероятно сложный и сборник станет настоящим спасением. Ученики научатся:
- понимать основные законы и химические понятия;
- называть изученные вещества и характеризовать их свойства;
- прогнозировать возможное протекание реакций.
Помимо этого ребята научатся безопасно пользоваться лабораторным оборудованием и реагентами.
К числу эффективных изданий относится решебник по химии для 10 класса (автор: О. С. Габриелян). Он содержит материал, изложенный понятным и доступным языком, наличие подробных примеров и пояснений способствует лучшему усвоению, а выделенные отдельным шрифтом важные определения и термины быстрому запоминанию. Пособие соответствует всем требованиям и восполняет тот объём знаний, который предусмотрен учебными стандартами.
ГДЗ по химии 10 класс базовый уровень Габриелян Дрофа
Многие десятиклассники уже точно определились со своими планами на то, в какой сфере они будут развиваться, совершенствоваться, трудиться после окончания школы. Нередко в число приоритетов попадает необходимость получения базовых и дополнительных знаний по химии. Эта наука актуальна для самых разных сфер деятельности — от агрономии и медицины до фармацевтики, технологии, услуг и быта, практических изысканий в нефтяной и газовой областях и т. д. Результативно подготовиться позволит специальная литература и решебники к ней.
Организовать занятия можно с профессиональной помощью, например, обратившись к репетиторам или посещая специализированные курсы и кружки по химии. Или — самостоятельно, используя ГДЗ к тому комплекту УМК, который применяется в рамках школьных уроков либо подобран десятиклассниками и их родителями самостоятельно. В любом случае, основные принципы работы:
— системность, то есть четкая постановка целей, учет базового уровня и тех задач, которые запланированы к решению. Часто именно в десятом классе школьники принимают участие в предметных олимпиадах и конкурсах по химии, проводимых на площадках ВУЗов в целью последующего поступления в них, имея преимущество по баллам;
— достаточное количество времени, выделенное на подготовку;
— регулярность проводимой работы;
— самопроверка и самоконтроль, позволяющие выявить возможные ошибки и сложности на самой ранней стадии их появления, своевременно исправить их, скорректировать планы подготовки;
— анализ достижений и запоминание принципа грамотной, правильной записи полученных результатов.
В числе эффективных и полезных источников, дающих достаточные и полные знания основного курса по дисциплине, эксперты называют учебник по химии для 10 класса — базовый уровень, составленный Габриеляном О. С. В книге представлены все тематики и разделы органической химии, изучаемой десятиклассниками. Учебник может быть использован как самостоятельная литература для подготовки к текущим занятиям, диагностическим и проверочным, экзаменам, конкурсам. И как часть УМК в комплекте с другой литературой по предмету. Книга актуальна и для одиннадцатиклассников, осуществляющих интенсивную подготовку к ЕГЭ по химии и повторяющих курс органической химии за десятый класс школы.
http://gdz.fm/himiya/10-klass/gabrielyan
http://www.euroki.org/gdz/ru/himiya/10_klass/gdz-himiya-10-klass-gabrielyan-o-s-2010g
