Этилен — структурная формула, химические свойства, применение
В данной статье мы расскажем вам о многочисленных химических свойствах такого органического вещества, как этилен. Во всех подробностях разберем химические реакции с этим веществом. Помимо химических свойств обязательно рассмотрим и общее строение этилена, а также применение данного алкена, основанное на его качествах и способностях.
Характеристики этилена
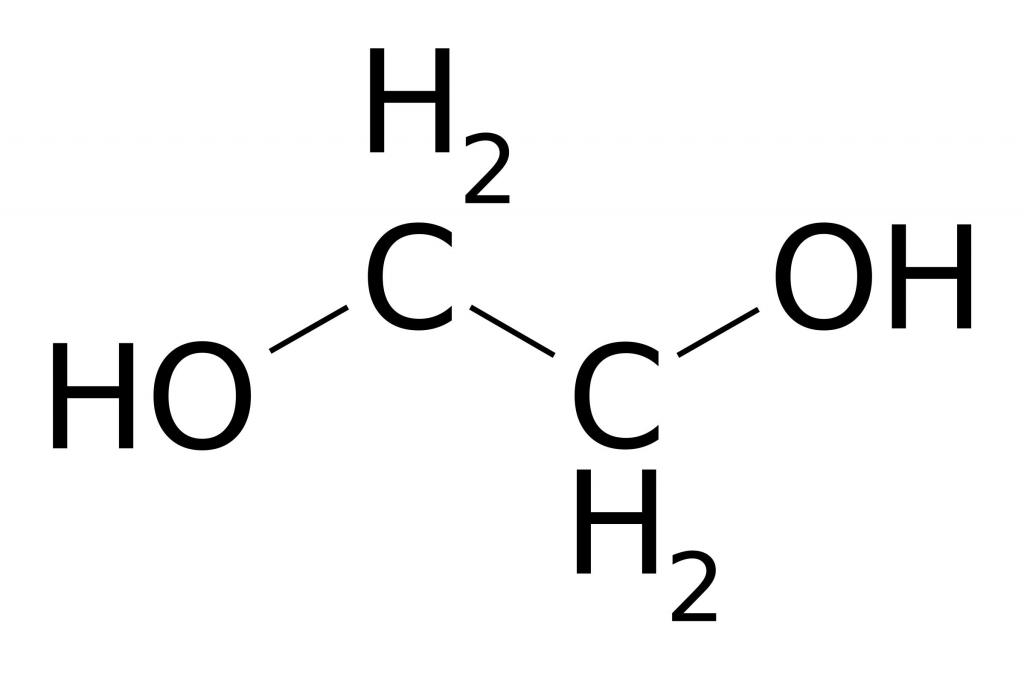
Этилен, или этен, имеет структурную формулу C2 H4 и является простейшим представителем непредельных этиленовых углеводородов:

Важно! В молекуле этилена невозможно свободное вращение sp 2 -гибридизованных углеродных атомов друг относительно друга без разрыва пи-связи.
В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:
- Гидрогалогенирование — присоединение галогеноводородов . Этилен взаимодействует с бромоводородом без особых условий, в результате чего получается бромэтан. Помните, что при присоединении реагента к несимметричному алкену действует правило Марковникова. Оно гласит о том, что атом водорода присоединяется к более гидрогенизированному углеродному атому, а галоген — к менее гидрогенизированному C.
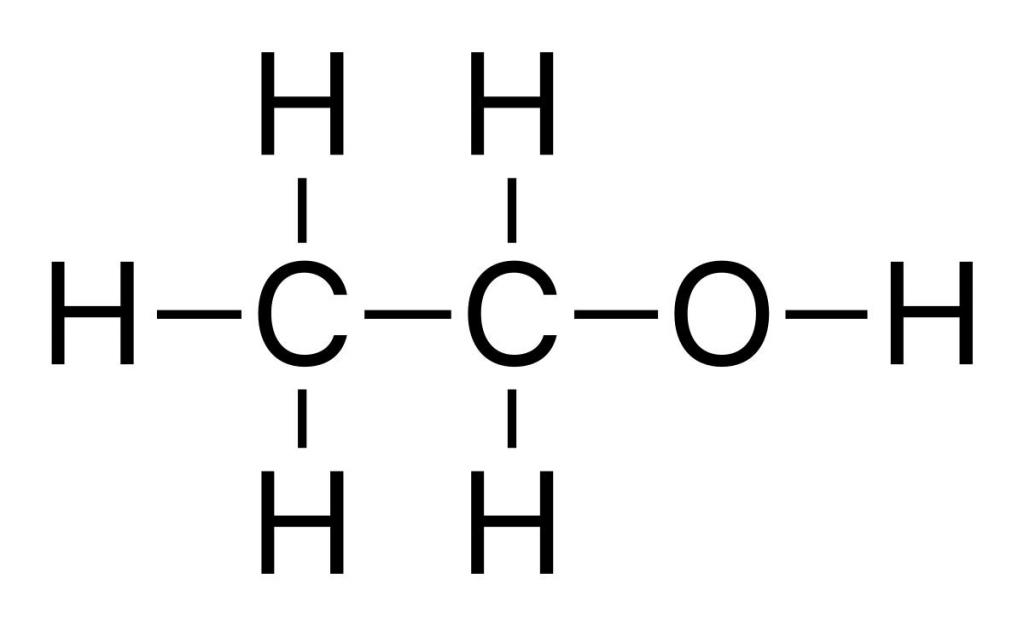
- Гидратация — присоединение H2O . C2 H4 реагирует с водой в присутствии концентрированной серной кислоты и при температуре. Продуктом реакции является этанол — одноатомный первичный спирт. Катализатором в данном случае может быть и фосфорная кислота. Если бы мы проводили аналогичное взаимодействие с пропеном, то получили бы пропанол-2 — вторичный спирт.
- Галогенирование — присоединение галогенов . В ходе этой реакции этен реагирует с хлором. Хлор присоединяется к C2 H4 , разрывая двойную связь, и на выходе получим 1,2-дихлорэтан. Реакция галогенирования является качественной на кратную связь.
- Гидрирование или дегидрирование — присоединение или отщепление атомов водорода. При гидрировании этилен взаимодействует с водородом в присутствии никелевого катализатора и температуры, образуя алкан — этан.

Реакция полимеризации
Полимеризация — это процесс соединения одинаковых простых молекул — мономеров, в более сложные — полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
- Реакция Вагнера (в нейтральной среде) — окисление перманганатом калия в водной среде . Три молекулы этена реагируют с двумя молекулами перманганата и четырьмя H2O. В результате этого взаимодействия мы получим три молекулы этиленгликоля — двухатомного спирта. Также выделится гидроксид калия и два оксида марганца (IV). Единственным условием данной реакции может являться холодная среда, то есть наличие температуры в 0 градусов, но это можно и не указывать.
- Реакция Вагнера (в кислотной среде) — окисление перманганатом калия в среде, где находится серная кислота . Этен аналогично реагирует с перманганатом, но вместо воды в этот раз присутствует серная кислота. Соответственно — продукты реакции будут другие. Мы получим две молекулы углекислого газа, сульфаты марганца и калия, а также воду. Взаимодействие идет при термическом воздействии.
- Горение— алкены горят так же, как и все органические соединения. Этилен не является исключением. При сгорании этена образуются углекислый газ и вода. Так как данная реакция является экзотермической, то происходит выделение энергии.
- Обесцвечивание окраски бромной воды— данная реакция является качественной на наличие кратной связи. Важно то, что нельзя отличить, тройная это связь или двойная. Этен реагирует с раствором брома без каких-либо условий. В ходе взаимодействия образуется 1,2-дибромэтан. Исходная темная окраска исчезает, а остается прозрачная жидкость.
Реакция изомеризации
Данная реакция не может протекать с этиленом, потому что у него не существует изомеров.
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой — частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса.

Применение этилена
Почему мы выделяем этот вопрос при изучении химических свойств этилена? Потому что применение данного органического вещества основано на всех его химических свойствах:
- В первую очередь, из-за своих многочисленных химических способностей алкены, в том числе и этилен, являются крайне ценным сырьем в химической промышленности.
- Этилен наряду с другими алкенами используют для ускорения созревания плодов и фруктов.
- C2 H4 применяется в получение таких органических веществ, как этиловый спирт, этиленгликоль, дихлорэтан и т.д.
- Широко распространен в медицине, технике, парфюмерии.
- Благодаря реакциям полимеризации с участием этилена, образуется полиэтилен — очень полезное вещество с уникальными свойствами.
- Получение антифризов также связано с химическими свойствами этилена.
Благодаря этой статье, вы изучили и подробно рассмотрели все химические реакции, которые характерны для этилена — простейшего представителя алкенов. Перед этим кратко узнали о строении этого органического соединения, что позволило более четко взглянуть на его химическую активность в различных взаимодействиях. Мы оценили важность и пользу этена, а также его необходимость в современной жизни человека. Чтобы закрепить изученный материал, рекомендуем вам пройти тест, расположенный ниже и посмотреть познавательное видео.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Химические свойства этилена. Формула этиленаНепредельные углеводороды с двойной химической связью в молекулах относят к группе алкенов. Первым представителем гомологического ряда является этен, или этилен, формула которого: C2H4. Алкены часто называют олефинами. Название является историческим и возникло в 18-м веке, после получения продукта взаимодействия этилена с хлором – этилхлорида, имеющего вид маслянистой жидкости. Тогда этен и назвали маслородным газом. В нашей статье мы изучим его химические свойства, а также получение и применение в промышленности. Взаимосвязь между строением молекулы и свойствами веществаСогласно теории строения органических веществ, предложенной М. Бутлеровым, характеристика соединения полностью зависит структурной формулы и вида связей его молекулы. Химические свойства этилена также определяются пространственной конфигурацией атомов, гибридизацией электронных облаков и наличием в его молекуле пи-связи. Два негибридизованных p-электрона атомов углерода перекрываются в плоскости, перпендикулярной плоскости самой молекулы. Формируется двойная связь, разрыв которой обусловливает способность алкенов к реакциям присоединения и полимеризации. Физические свойстваЭтен – это газообразное вещество, с едва уловимым своеобразным запахом. Оно плохо растворимо в воде, но хорошо растворяется в бензоле, тетрахлорметане, бензине и других органических растворителях. Исходя из формулы этилена С2Н4, его молекулярная масса равна 28, то есть этен немного легче воздуха. В гомологическом ряду алкенов с увеличением их массы агрегатное состояние веществ изменяется по схеме: газ – жидкость – твердое соединение. Получение газа в лаборатории и промышленностиНагревая этиловый спирт до 140 °С в присутствии концентрированной серной кислоты, можно получить этилен в лабораторных условиях. Еще один способ – отщепление атомов водорода от молекул алканов. Действуя едким натрием или калием на галогензамещенные соединения предельных углеводородов, например на хлорэтан, добывают этилен. В промышленности наиболее перспективным способом его получения является переработка природного газа, а также пиролиз и крекинг нефти. Все химические свойства этилена — реакции гидратации, полимеризации, присоединения, окисления — объясняются наличием в его молекуле двойной связи. Взаимодействие олефинов с элементами главной подгруппы седьмой группыВсе члены гомологического ряда этена присоединяют атомы галогенов по месту разрыва пи-связи в своей молекуле. Так, водный раствор брома красно-коричневого цвета обесцвечивается, в результате чего образуется уравнение этилена — дибромэтан: Аналогично протекает реакция с хлором и йодом, в ней присоединение атомов галогенов также происходит по месту разрушения двойной связи. Все соединения – олефины могут взаимодействовать с галогеноводородами: хлороводородом, фтороводородом и т.д. В результате реакции присоединения, протекающей по ионному механизму, образуется вещества – галогенопроизводные предельных углеводородов: хлорэтан, фторэтан. Промышленное производство этанолаХимические свойства этилена часто используют для получения важных веществ, широко применяемых в промышленности и быту. Например, нагревая этен с водой в присутствии ортофосфорной или серной кислот, под действием катализатора происходит процесс гидратации. Он идет с образованием этилового спирта – многотоннажного продукта, получаемого на химических предприятиях органического синтеза. Механизм реакции гидратации протекает по аналогии с другими реакциями присоединения. Кроме того, взаимодействие этилена с водой также происходит в результате разрыва пи-связи. К свободным валентностям атомов углерода этена присоединяются атомы водорода и гидроксогруппа, входящие в состав молекулы воды. Гидрогенизация и горение этиленаНесмотря на все вышесказанное, реакция соединения водорода не имеет большого практического значения. Однако она показывает генетическую связь между различными классами органических соединений, в данном случае алканов и олефинов. Присоединяя водород, этен превращается в этан. Противоположный процесс – отщепление от предельных углеводородов атомов водорода приводит к образованию представителя алкенов – этена. Жесткое окисление олефинов, называемое горением, сопровождается выделением большого количества тепла, реакция является экзотермической. Продукты сгорания одинаковы для веществ всех классов углеводородов: алканов, непредельных соединений ряда этилена и ацетилена, ароматических веществ. К ним относятся углекислый газ и вода. Воздух в реакции с этиленом образует взрывчатую смесь. Реакции окисленияЭтен может окисляться раствором перманганата калия. Это одна из качественных реакций, с помощью которой доказывают наличие двойной связи в составе определяемого вещества. Фиолетовая окраска раствора исчезает вследствие разрыва двойной связи и образования двухатомного предельного спирта – этиленгликоля. Продукт реакции имеет широкий спектр применения в промышленности в качестве сырья для получения синтетических волокон, например лавсана, взрывчатых веществ и антифризов. Как видим, химические свойства этилена используются для получения ценных соединений и материалов. Полимеризация олефиновПовышение температуры, увеличение давления и применение катализаторов – это необходимые условия для проведения процесса полимеризации. Его механизм отличается от реакций присоединения или окисления. Он представляет собой последовательное связывание многих молекул этилена в местах разрыва двойных связей. Продуктом реакции является полиэтилен, физические характеристики которого зависят от величины n — степени полимеризации. Если она невелика, то вещество находится в жидком агрегатном состоянии. Если показатель приближается к 1000 звеньев, то из такого полимера изготовляют полиэтиленовую пленку, гибкие шланги. Если степень полимеризации превышает 1500 звеньев в цепи, то материал представляет собой твердое вещество белого цвета, жирное на ощупь. Он идет на изготовление цельнолитых изделий и пластиковых труб. Галогенпроизводное соединение этилена – тефлон обладает антипригарными свойствами и является широко применяемым полимером, востребованным при изготовлении мультиварок, сковород, жаровен. Его высокая способность противостоять истиранию используется в производстве смазок к автомобильным двигателям, а низкая токсичность и толерантность к тканям человеческого организма позволили применять тефлоновые протезы в хирургии. В нашей статье мы рассмотрели такие химические свойства олефинов, как горение этилена, реакции присоединения, окисления и полимеризации. источники: http://acetyl.ru/o/a21b2b.php http://www.syl.ru/article/373013/himicheskie-svoystva-etilena-formula-etilena |