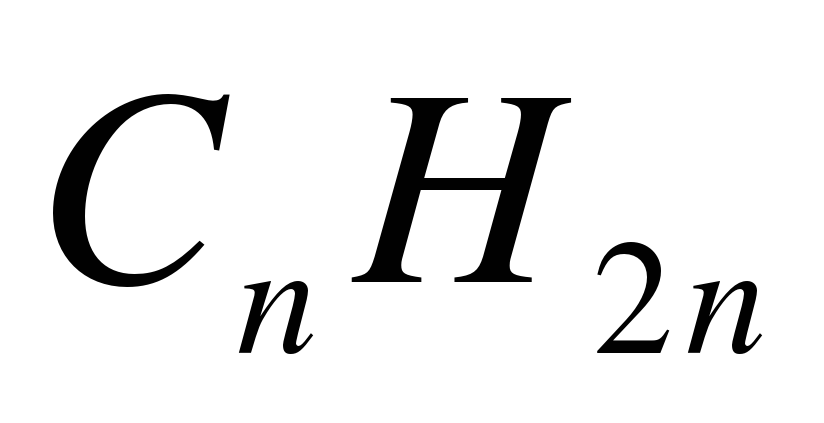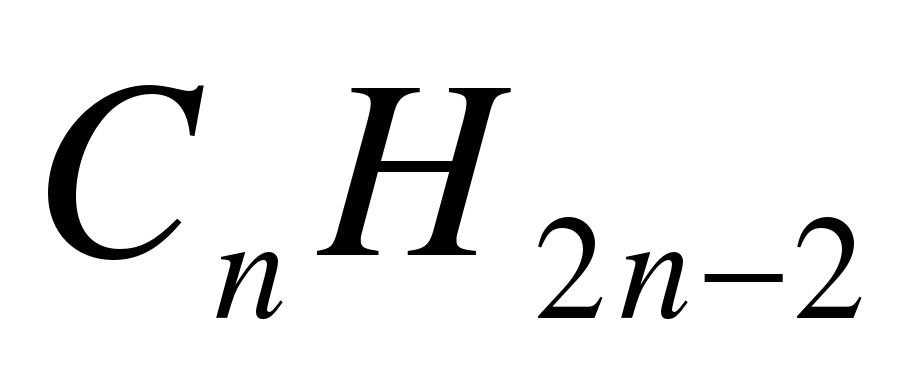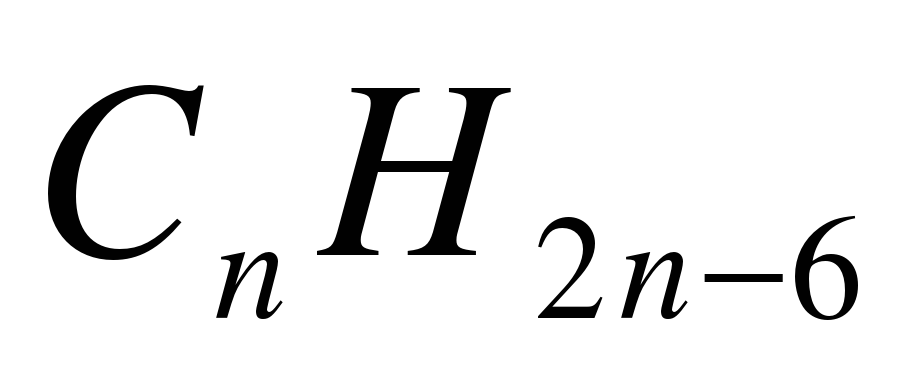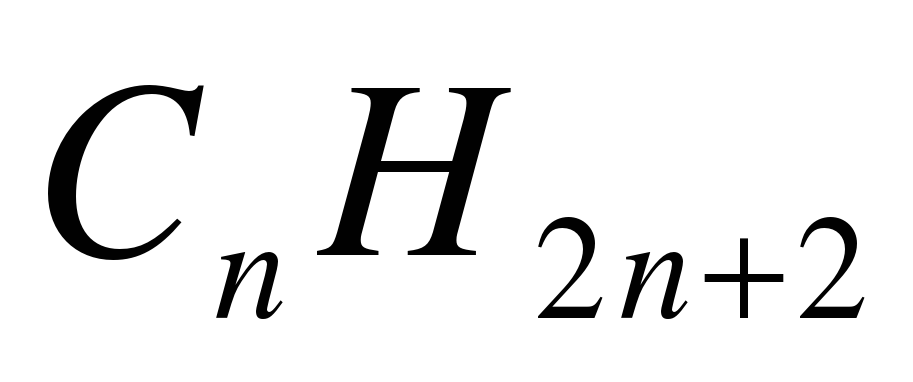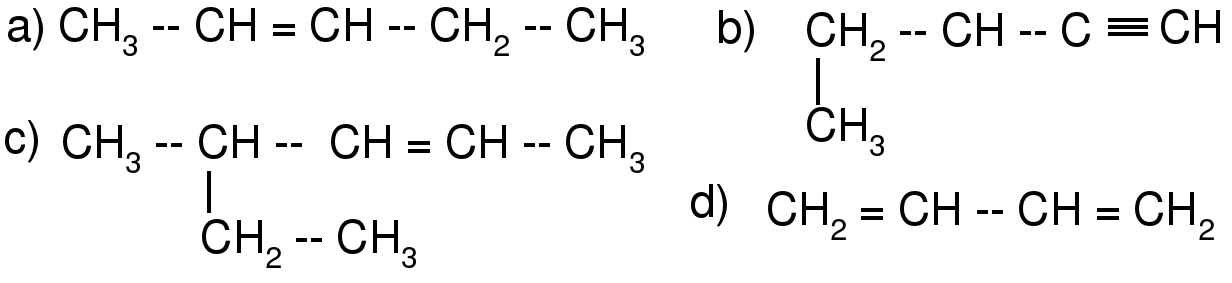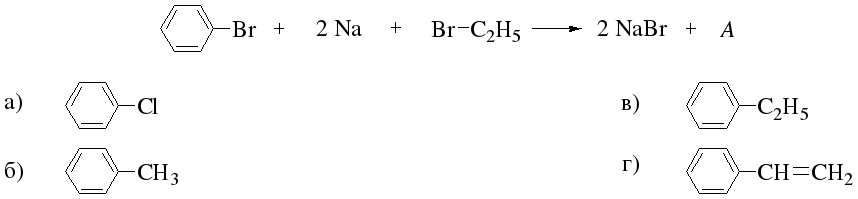Олимпиадные задания по химии
олимпиадные задания по химии (8, 9, 10, 11 класс) на тему
Думаю, что данная работа поможет молодым учителям, заинтересует учителей, которые не знают, с чего начать работу по подготовке ребят к олимпиадам по химии
Скачать:
| Вложение | Размер |
|---|---|
| Задания олимпиады по химии 8 класс | 57.5 КБ |
| Задания олимпиады по химии 9 класс | 38.23 КБ |
| Задания олимпиады по химии 10 класс | 26.81 КБ |
| Задания олимпиады по химии 11 класс | 28.58 КБ |
Предварительный просмотр:
ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ ПО ХИМИИ
Задание 1. ТЕСТ. Выберите один правильный ответ из предлагаемых ответов (1 балл за каждый правильный ответ).
1. Сколько элементов, простые вещества которых неметаллы, представлены сегодня в Периодической системе химических элементов Д.И. Менделеева?
2. Какой элемент назван в честь небесного тела — спутника Земли:
3. Какой элемент назван в честь мифического героя, укравшего огонь у богов:
4. К чистым веществам относится
2) дистиллированная вода
5. Является веществом:
2) медная монета
6.Одинаковую относительную массу имеют вещества, формулы которых:
4) CuSO 4 и Cu 2 S
7.Массовая доля серы в серной кислоте H 2 SО 4 равна:
8. Среди перечисленных металлических материалов, используемых для изготовления призовых медалей, жетонов и монетных знаков, сплавом является
9. Мельчайшая частица вещества, являющаяся носителем его химических свойств, называется:
10. Какие вещества могут растворяться в воде?
1) только газообразные
2) только жидкие и твёрдые
3) жидкие, газообразные, твёрдые
4) только твёрдые
Задание 2. Какие химические элементы названы в честь стран? Приведите не менее четырех названий. Укажите количество протонов и нейтронов, содержащихся в ядрах атомов, названных вами элементах (за каждое название и страну-1б, протоны и нейтроны-1б) (8 баллов)
Задание 3 . Юный химик составил список химических явлений, которые можно наблюдать на кухне:
а) гашение соды уксусом при приготовлении теста;
б) растворение сахара в воде;
в) прокисание молока;
г) брожение сока;
д) плавание сливочного масла на горячей сковородке;
е) заваривание чая;
ж) горение газовой горелки;
з) кипение воды в чайнике.
Однако он ошибся и включил в список физические явления. Укажите их. Чем они отличаются от химических явлений? (4 балла)
Задание 4. Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала древесные стружки с мелкими железными гвоздями, сахаром и речным песком и велела Золушке очистить сахар, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро справиться с заданием мачехи. (4 балла)
Задание 5. Кто из нас не мечтал разыскать сокровища, спрятанные когда-то, в глубине веков, морскими пиратами?! Если расположите элементы в определённом порядке, взяв за основу принцип построения периодической системы Д.И. Менделеева, то узнаете, как наверняка найти настоящий клад . (8 баллов)
Si – тон, Ar – оящ, Ne – др, Fe – ад, Mg — э, F – ий, Cr – кл,
Cl –аст, Li – хо, Sc – ий, N – рош, Na – уг.
А) Укажите названия данных элементов.
Б) Запишите порядок расположения элементов в таблицу.
В) Запишите полученную фразу.
Задание 1. 10 баллов (правильный ответ – 1б.)
Задание 2. 8 баллов
Рутений (Ru) – назван в честь России
протонов 44, нейтронов 57
Полоний (Po) – в честь Польши
протонов 84, нейтронов 126
Франций (Fr) – в честь Франции
протонов 87, нейтронов 136
Германий (Ge) – в честь Германии
протонов 32, нейтронов 41
Задание 3. ( 4 балла)
Физические явления: б, д, е, з (одно явление – 0,5б.) – 2б . При физических явлениях изменяются форма, размеры и агрегатное состояние веществ, но состав вещества не изменяется – 2б.
Задание 4. (4 балла)
Древесные стружки от мелких железных гвоздей можно разделить при помощи магнита (1б.). Сахар с речным песком растворить в воде (1б) , профильтровать (1б.) , выпарить воду (1б.).
Задание 5. 8 баллов
Если расположить символы химических элементов в порядке возрастания их порядковых номеров, то из набора букв, записанных рядом с химическими знаками, получится фраза: «Хороший друг – это настоящий клад». Каждый элемент – 0,5б., фраза – 2б.
Предварительный просмотр:
ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ
ШКОЛЬНИКОВ ПО ХИМИИ
Инструкция к заданию. Тест содержит 8 заданий. К каждому заданию дается 4 варианта ответа, из которых нужно выбрать и указать только номер одного правильного ответа.
1. Одинаковое число электронов во внешнем электронном слое имеют атомы
2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
3. В каком из соединений степень окисления фосфора равна –3?
4. К сложным веществам относится
5. В лаборатории имеются растворы следующих веществ:
С помощью раствора хлорида натрия можно распознать реактив, указанный под буквой:
6. К химическим явлениям относится процесс
1) образования кристаллов сахара при длительном хранении варенья
2) растворения кислорода в воде
3) получения кислорода из пероксида водорода
4) сжижения газообразного азота
7. Водород образуется при взаимодействии раствора серной кислоты и
1) оксида натрия
2) карбоната натрия
4) железа. (7 баллов)
Одинаково ли число молекул при одинаковых условиях содержится в смесях 1,1 г CO 2 c 2,4 г O 3 и 1,32 г CO 2 c 2,16 г O 3 ? (10 баллов)
Составьте уравнения реакций в соответствии со схемой:
Известно, что реакция 1 –замещения; 2 – соединения; 3,5,6,7 – обмена; 4,8 – разложения. (10 баллов)
Нерастворимое в воде соединение «А» бурого цвета при нагревании разлагается с образованием двух оксидов, один из которых вода. Другой оксид – «В» — восстанавливается углеродом с образованием металла «С», являющимся вторым по распространенности в природе металлом. Определите вещества «А», «В», «С»? Приведите уравнения реакций. (10 баллов)
Методом электронного баланса подберите коэффициенты в схеме окислительно-восстановительной реакции, укажите окислитель и восстановитель:
H 2 S + K 2 Cr 2 O 7 + H 2 SO4 → S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O (5 балла)
Общее количество баллов — 42
Решение заданий. 9 класс
Задание – тест №9-1.
Количество молей одинаково, поэтому число молекул тоже одинаково и равно:
Расчет количества каждого вещества (по 1 баллу)
Расчет общего количества вещества в смесях (по 1, 5 баллу за каждую смесь)
Вывод о равенстве числа молекул
Расчет числа молекул
Возможны другие варианты уравнений.
Написание уравнений (каждое по 1, 25 балла)
«B» — Fe 2 O 3 Fe 2 O 3 + 3C = 2Fe + 3CO
За определение веществ (по 2 балла за каждое)
За уравнения реакций (по 2 балла за каждое)
3 H 2 S + K 2 Cr 2 O 7 + 4 H 2 SO 4 = 3 S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O
Cr +6 + 3 e- = Cr +3
H 2 S — восстановитель
K 2 Cr 2 O 7 — окислитель
Предварительный просмотр:
ЗАДАНИЯ ШКОЛЬНОГО ЭТАПА ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ ПО ХИМИИ
1. При пропускании паров воды через оксид кальция масса реакционной смеси увеличилась на 9,65%. Определите процентный состав полученной твердой смеси.
2. Цена сжиженного газа, предназначенного для заправки автомобилей, составляет 17,1 р за 1 кг, или 9 р за 1 л. Во сколько раз сжиженный газ легче воды?
3. Предложите химические реакции, позволяющие осуществить следующие превращения и выделить все указанные вещества в индивидуальном виде. Каждая стрелка может соответствовать как одной стадии, так и нескольким.
NH 3 → NO → HNO 3 → (NH 4 ) 2 SO 4 → NH 4 Cl → NH 3
4. Чтобы приготовить электролит для аккумуляторов мастер использовал 0,5 кг 98% ной серной кислоты. Когда электролит был залит в аккумулятор, стакан с его остатками был случайно опрокинут и кислота вылилась на пол. Для нейтрализации разливов кислоты их засыпают гашеной известью (гидроксид кальция Ca(OH) 2 ).
а) Какой объем электролита приготовил мастер, если массовая доля серной кислоты в нем 32%, а плотность электролита 1,235 г/мл?
б) Какая минимальная масса извести необходима для нейтрализации разлива, если на пол вылилось 140 мл 32%-ной кислоты?
5. В пяти пронумерованных пробирках находятся твердые сульфаты аммония, калия, магния, бария и алюминия. Проведите мысленный эксперимент — идентифицируйте все вещества. В Вашем распоряжении имеются только дистиллированная вода, раствор NaOH и спиртовая горелка. Решение представьте в виде таблицы. В таблице отметьте признаки, по которым Вы провели идентификацию. Напишите уравнения реакций, представленных в Вашей таблице.
РЕШЕНИЕ. 10 класс
1. (3 балла) Записано уравнения химической реакции: СаO + H 2 O = Са(OH) 2
пусть исходное количество оксида кальция равна х моль, тогда:
m( H 2 O прореаг. ) = (40+16)х 0,0965= 5,4х,
( H 2 O прореаг.. ) = 5,4х/18 = 0,3х = ( СаO прореаг.. ) = ( Са(OH) 2, обрзов.. )
m(СаO оставш. ) = 0,7х (40+16) = 39,2х,
m(Са(OH) 2, обрзов. ) = (40+32+2) . 0,3х = 22,2х,
w(СаO) = 3920х/ 61,4х = 63,84% w(Са(OH) 2 ) = 2220х/61,4х = 36,16%
Ответ: w(СаO) = 63,84% w(Са(OH) 2 ) = 36,16%
2. (3 балла) m = V · ρ
Примем плотность за Х. тогда m = 1000 · x. Цена 1000 г – 17,1 р. Цена 1000 мл – 9 р. 1000 · 9 = 17,1 · 1000 х, х = 0,53 г/мл .
3. Каждое уравнение реакции по 1 баллу (всего 6 баллов)
(1) 4NH 3 + 5O 2 = 4NО + 6H 2 O
(2) 2NO + O 2 = 2NO 2
(3)4NO 2 + 2H 2 O + O 2 = 4HNO3
(4) 2NH 3 + H 2 SO 4 = (NH 4 ) 2 SO 4
(5) (NH 4 ) 2 SO 4 + BaCl 2 = BaSO 4 + 2NH 4 Cl
(6) NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
m(H 2 SO 4 ) = 500·0,98 = 490 г, m(р-ра кислоты) = 490/0,32 = 1531 г
V(р-ра кислоты) = 1531/1,235 = 1239,7 мл
Вылилось на пол кислота m = 140 · 1,235 = 172,9 г
ν(H 2 SO 4 ) = 172,9 / 98 = 1,8 моль,
H 2 SO 4 + Ca(OH) 2 = CaSO 4 + 2H 2 O
ν(Ca(OH) 2 ) = 1,8 моль m(Ca(OH) 2 ) = 1,8 · 74 = 133,2 г
Олимпиадные задания по химии (8- 11 кл) с решениями
Олимпиадные задачи — 2016 с решениями (8- 11 кл.)
Просмотр содержимого документа
«ЗАДАНИЯ — 10 класс 2016»
II этапа олимпиады по химии 2016
В заданиях 1-9 необходимо выбрать один правильный ответ. Всего можно набрать 9 баллов, по 1 баллу за каждый правильный ответ.
1. Укажите общую формулу алканов:
а)
б)
в)
г)
Выберите строку, в которой перечислены соединения с ковалентной неполярной связью
3. Укажите суммарное количество атомов углерода и водорода в молекуле гексену
4. Выберите структурную формулу изомера пентену-1
5. Выберите молекулярно-ионную схему, соответствующую реакции
б) ХОН + НА = А — + Х + + Н2О
в) ХОН + Н + = Х + +Н2О
г) НА + ОН — = А — + Н2О
6. Укажите, что можно наблюдать, если через раствор перманганата калия пропустить этилен
а) выделение бурого газу
б) выпадение желтого осадка
в) обесцвечивание раствора
г) разогревание вещества
7. Подберите коэффициенты в уравнении реакции и укажите их сумму
8. Определите химическую формулу алкана, 11,2 л (н.у.) которого имеют массу 29 г
9. Укажите группу веществ, реагирующих с пропеном
В заданиях 10-15 необходимо выбрать все правильные ответы. Правильный ответ на каждое задание – 1,5 балла.
10. Выберите реакции, в результате которых можно получить гидроксид кальция Выберите утверждение относительно углеводорода, содержащего 92 % углерода по массе б) используется для получения бензола г) основной компонент природного газа 12. Укажите формулы соединений, которые могут быть только восстановителями 13. Укажите реакции, происходящие в растворах полностью 14. Обозначьте вещества, с которыми реагирует ацетилен 15. Укажите утверждение относительно реакции KBr + KClO + HCl = KCl + Br2 + . а) Ионы Br — являются восстановителем б) Ионы [СlO] — являются окислителем в) соляная кислота является восстановителем г) сумма коэффициентов в уравнении равна 15. Задания 16-17 предполагают установление правильной последовательности. Правильный ответ на каждое задания – 4 балла. 16. Из предложенных электронных структур частичек постройте последовательность, отвечающую схему превращения Cl o → Cl — → Cl + → Cl +3 |
Б 3s 2 3p 5
17. Выберите вещества A, B, С и D для осуществления превращения согласно схеме
6 ВаSO4
1 19 р + і 18 е Se 2-
19. Установите соответствие схемы превращения и количеством электронов, участвующих в превращении
Схема превращения: Количество электронов
1 Mn 2+ → MnO2 А +5 е
20. Установите соответствие между реакцией и именем ученого, открывшего эту реакцию
реакция ученые
4. 2СН3С1 + 2Nа → С2Н6 + 2NаС1 Г Кучеров Н.Г.
Задания 21-25 с открытым ответом. Они предполагают запись развернутого ответа и расчетов.
21. (5 баллов) Составьте уравнения реакций, в соответствии со схемой. Расшифруйте неизвестные вещества – приведите их структурную формулу и название
H 2 SO 4(к) KMnO 4 HBr KOH ,спирт С активир. , t º
22. (5 балла) Составьте графическую формулу 4,7-диметилдекатриен-1,2,7-ин-5. Укажите тип гибридизации каждого атома углерода главной цепи. Предложите общую формулу гомологического ряда, к которому может принадлежать это вещество. Что вы можете сказать об устойчивости этого соединения, ответ аргументируйте.
23. (7 балла) При сжигании 7,4 г органического вещества получено 8,96 л (н.у.) углекислого газа и 9,0 г воды. Молекула вещества имеет массу 1,23∙10 -22 г. в ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с оксидом меди (II) образуется кетон. На основании данных задачи:
1) установите формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает его строение;
3) напишите уравнение реакции этого вещества с оксидом меди (II).
24. (10 баллов) Для полного хлорирования смеси алюминия, меди и железа массой 58,8 г было использовано 35,84 л (н.у.) хлора. При обработке такого же количества исходной смеси металлов избытком концентрированной азотной (нитратной) кислоты выделилось 17,92 л (н.у.) газа бурого цвета. Установите количественный состав исходной смеси металлов.
25. (10 баллов) Соль А при взаимодействии с раствором нитрата серебра образует белый осадок и окрашивает пламя горелки в желтый цвет. При взаимодействии концентрированной серной (сульфатной) кислоты с солью А при нагревании образовался газ Б, который растворили в воде. Раствор полученного вещества В полностью реагирует с 52,2 г оксида Г, содержащего 63,21% (по массе) четырехвалентного металла Д при этом образуется газ Е, способный обесцвечивать окрашенную влажную ткань. Определите компоненты А, Б, В, Г, Д и Е реакционной системы, количество исходной соли А и объем выделившегося газа Е (н.у.).
Просмотр содержимого документа
«ЗАДАНИЯ — 11 класс 2016»
II этапа олимпиады по химии 2016
В заданиях 1-9 необходимо выбрать один правильный ответ. Всего можно набрать 9 баллов, по 1 баллу за каждый правильный ответ.
1. Укажите формулу 1,2,3 – тринитробензола
2. Укажите оксид азота, образующийся при непосредственном взаимодействии простых веществ
3. Свободный металл образуется при разложении
4. Выберите формулу возможного конечного продукта А в соответствии со схемой химической реакции
5. Определите формулу карбоновой кислоты, если массовые доли элементов в молекуле составляют:
углерод – 26,1%, водород – 4,35%, кислород – 69,55%
6. Укажите класс соединений к которому относится бензиловый спирт
а) ароматические кислоты
б) ароматические спирты
в) насыщенные одноатомные спирты
7. Укажите число принятых электронов в уравнении восстановления SO4 2- + 8Н + + …..ē→ S 2- + 4Н2О
8. В результате реакции между 2 л ацетилена и 9 л кислорода в избытке останется
а) 2 л кислорода в) 1 л ацетилену
б) 3 л ацетилена г) 4 л кислорода
9. Определите сумму всех коэффициентов в уравнении реакции
В заданиях 10-15 необходимо выбрать все правильные ответы. Правильный ответ на каждое задание – 1,5 балла.
10. Выберите пару оксидов которые не будут взаимодействовать друг с другом Укажите явления, которые происходят при взаимодействии раствора CuSO4 и водного раствора аммиака, взятого в избытке а ) образуется белый осадок б) образуется комплексное соединение в) образуется синий раствор г) выделяется газ 12. Выберите формулы соединений, которые могут быть только окислителями 13. Какие из перечисленных солей не подвергаются гидролизу 14. В каких соединениях атомы Карбона имеют sp 2 и sp 3 гибридизацию 15. Укажите вещества, из которых можно получить этанол в одну стадию Задания 16-17 предполагают установление правильной последовательности. Правильный ответ на каждое задания – 4 балла. 16. Установите последовательность типов реакций в ряду превращений ХимияСборник олимпиадных заданий (задач) с ответами, решениями и критериями оценивания по химии для 7-11 классов Химия 11 класс, муниципальный этап (2 этап), г. Москва, 2017-2018 учебный годЗадания, ответы, критерии оценивания Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается. Решения и система оценивания В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не […] Химия 10 класс, муниципальный этап (2 этап), г. Москва, 2017-2018 учебный годЗадания, ответы, критерии оценивания Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается. Решения и система оценивания В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не […] Химия 9 класс, муниципальный этап (2 этап), г. Москва, 2017-2018 учебный годЗадания, ответы, критерии оценивания Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается. Решения и система оценивания В итоговую оценку из 6 задач засчитываются 5 решений, за которые частник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не […] Химия 8 класс, муниципальный этап (2 этап), г. Москва, 2017-2018 учебный годЗадания, ответы, критерии оценивания Общие указания: если в задаче требуются расчёты, они обязательно должныбыть приведены в решении. Ответ, приведённый без расчётов или иногообоснования, не засчитывается. Решения и система оценивания. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается. Содержание Задание […] Химия 11 класс, школьный (первый) этап, г. Москва, 2017-2018 годСодержание Задача 1. Элемент-хамелеон Решение Задача 2. Свойства гомологов Решение Задача 3. Синтез ванадата Решение Задача 4. Гидратация углеводородов Решение Задача 5. Идентификация кислородсодержащего соединения Решение Задача 6. Получение и свойства неизвестной жидкости Решение Задача 1. Элемент-хамелеон Содержание ↑ На приведённой ниже схеме представлены превращения соединений одного химического элемента: Вещества Б, Д и Е нерастворимы в […] Химия 10 класс, школьный (первый) этап, г. Москва, 2017-2018 годСодержание Задача 1. Левые части Решение Задача 2. От азотной кислоты к алюминату Решение Задача 3. Получение и окисление алкена Решение Задача 4. Запах газа Решение Задача 5. «Медный всадник» Решение Задача 6. Осторожное получение газа Решение В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна […] Химия 9 класс, школьный (первый) этап, г. Москва, 2017-2018 годСодержание Задача 1. Два газа Решение Задача 2. Соединения с водородом Решение Задача 3. Свойства неизвестного газа Решение Задача 4. Хорошо растворимый газ Решение Задача 5. Ионное соединение без металлов Решение Задача 6. Расширение и сжатие газа Решение В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть […] Химия 7-8 класс, школьный (первый) этап, г. Москва, 2017-2018 годСодержание Задача 1. Реакции соединения Решение Задача 2. Вещество из водорода и кислорода Решение Задача 3. Фториды в природе и в быту Решение Задача 4. Новое ракетное топливо Решение Задача 5. Реакция горения Решение Задача 6. Эксперименты с газами Решение В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие […] Химия 11 класс, муниципальный (второй) этап, г. Москва, 2016 годЗадание 1. (10 баллов) Правые части По правой части с коэффициентами восстановите формулы веществ и коэффициенты в левой части уравнений реакций: … + … + … = 2Na2CrO4 + 3NaNO2 + 2CO2 … + … = Na2Cr2O7+ 2NaCl + H2O … + … + … = 2Na3[Cr(OH)6] + 3S + 4NaOH … + … = […] Химия 10 класс, муниципальный (второй) этап, г. Москва, 2016 годЗадание 1. (10 баллов) «Правые части» По правой части с коэффициентами восстановите формулы веществ и коэффициенты в левой части уравнений реакций: … + … = SiH4↑ + 2MgBr2 + 4NH3↑ … + … = Ca3N2 + 3CaH2 … + … = 2KCl + 3Ca(OH)2 … + … + … = SiCl4 […] Химия 9 класс, муниципальный (второй) этап, г. Москва, 2016 годЗадание 1. (10 баллов) «Ионные реакции» Завершите приведённые ниже сокращённые ионные уравнения реакций с коэффициентами. Все неизвестные частицы обозначены многоточиями. … + 2… → Cu(OH)2↓ … + 2OH– + … → BaSO3↓ + … Pb2+ + … → … + 2H+ H+ + … → CO2↑ + … 3H+ + … → Al3+ + 3… […] Химия 8 класс, муниципальный (второй) этап, г. Москва, 2016 годЗадание 1 (10 баллов) «Реакции кислорода» Приведите примеры реакций с участием кислорода, в результате которых образуются: а) вода и кислотный оксид; б) вода и простое вещество; в) кислотный и основный оксиды; г) два кислотных оксида; д) основание. Напишите уравнения реакций. Решение а) CH4 + 2O2 = CO2 + 2H2O; б) 4NH3 + 3O2 = 2N2 […] Химия 11 класс, школьный (первый) этап, г. Москва, 2016 годЗадача 1 «Гаснущие свечки» В прибор, изображённый на рисунке, поместили небольшие кусочки кристаллического вещества Х белого цвета и налили жидкость Y. После того как открыли кран, жидкость Y опустилась из воронки в нижнюю часть прибора и пришла в соприкосновение с веществом X, началась реакция, сопровождающаяся выделением бесцветного газа Z. Газ Z по газоотводной трубке поступал […] Химия 10 класс, школьный (первый) этап, г. Москва, 2016 годЗадание 1 «Десять порошков» В десяти пронумерованных стаканах выданы порошки следующих веществ: медь, оксид меди(II), древесный уголь, красный фосфор, сера, железо, хлорид натрия, сахар, мел, малахит (оснóвный карбонат меди(II)). Ученики исследовали свойства выданных порошкообразных веществ, результаты своих наблюдений представили в таблице. Номер стакана Цвет исследуемого вещества «Поведение» порошка при помещении его в стакан с водой […] Химия 9 класс, школьный (первый) этап, г. Москва, 2016 годЗадача 1. «Полезная соль» Нерастворимая в воде соль X входит в состав множества полезных веществ – белых красок, огнеупорных материалов, жидкостей для бурения скважин, контрастных веществ для рентгенографии. Она состоит из трёх элементов, один из которых – сера. При прокаливании с избытком угля X превращается в растворимую соль Y, которая состоит всего из двух элементов […] источники: http://multiurok.ru/files/olimpiadnyie-zadaniia-po-khimii-8-11-kl-s-rieshien.html http://olimpiadnye-zadanija.ru/predmet/himiya/ |