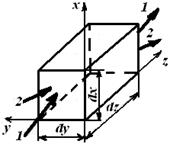
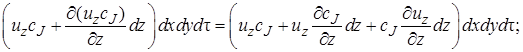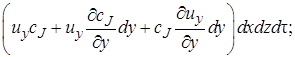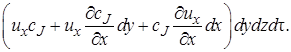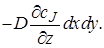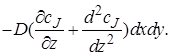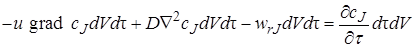Уравнение материального баланса для элементарного объема проточного химического реактора
Прежде чем рассмотреть отдельные типы химических реакторов в соответствии с приведенной классификацией, составим уравнение материального баланса по произвольному участнику реакции – веществу J – для элементарного объема произвольного проточного химического реактора и элементарного промежутка времени.
Рассмотрим поток жидкости, протекающей через реактор. О ходе химического процесса в реакторе будем судить по изменению молярной концентрации вещества J в жидкости сJ. Так как, в общем случае, в реакторе имеет место то, или иное распределение концентрации сJ по объему, а в каждой произвольно выбранной точке еще и распределение концентрации во времени, то считается, что сJ является функцией четырех переменных: трех пространственных координат х, у, z и времени τ: сJ = сJ(х, у, z, τ).
В соответствии с рассмотренными в § 4.2 требованиями к размеру элементарного объема и значению элементарного промежутка времени выберем в качестве элементарного промежутка времени бесконечно малый интервал dτ (dτ 
В уравнении материального баланса по веществу J должны быть отражены, как указано выше, все изменения, которые произойдут за время dτ с веществом J при прохождении потоком элементарного объема. Эти изменения могут быть связаны с тремя причинами: конвективным переносом, диффузионным переносом и химической реакцией.
Рис. 4.1. Элементарный объем химического реактора:
1, 1 / – конвективный и 2, 2 / – диффузионный потоки соответственно
на входе в элементарный объем и на выходе из него
Конвективный перенос, или перенос импульса, вызван движением потока со скоростью u в результате какого-либо внешнего воздействия (например, из-за перепада давления, созданного насосом или компрессором). При макроскопическом движении жидкости каждый данный ее участок передвигается как целое с неизменным составом, и в результате происходит чисто механическое перемешивание: хотя состав каждого передвигающегося участка жидкости может оставаться неизменным (если нет химической реакции) в каждой неподвижной точке пространства (неподвижном элементарном объеме), концентрация жидкости будет со временем меняться. Охарактеризовать конвективный перенос можно изменением импульса единицы объема жидкости с, и.
Диффузионный перенос вызван наличием неравномерного распределения вещества J в пространстве. Вследствие выравнивания концентрации молекулярным переносом веществ реакционной смеси из одного участка жидкости в другой также происходит изменение состава внутри элементарного объема. Охарактеризовать диффузионный перенос можно в соответствии с законами Фика изменением диффузионного потока вещества J, равного D grad cJ (D – коэффициент диффузии).
Протекание химической реакции в элементарном объеме – неотъемлемая часть любого химического процесса. Расход или образование вещества J в ходе химической реакции пропорционален скорости реакции wrJ.
Алгебраическая сумма всех этих трех изменений должна быть равна накоплению (положительному или отрицательному) вещества J в элементарном объеме, т. е. изменению количества вещества J, находящегося внутри элементарного объема, за тот промежуток времени, для которого составляется материальный баланс.
Запишем теперь отдельные составляющие уравнения материального баланса.
Количество вещества, попадающее за время dτ в элементарный объем с конвективным потоком, можно рассматривать как сумму составляющих потока, которые войдут через отдельные грани параллелепипеда. В направлении оси z через грань dx dy за время dτ войдет cJ иz dx dy dt моль вещества J.
Аналогично через грань dy dz войдет cJ ux dy dz dτмоль вещества J, а через грань dx dz cJ uy dx dz dτмоль J.
Суммарно с конвективным потоком в элементарный объем будет внесено
При прохождении элементарного объема произойдет изменение импульса единицы объема (так как в общем случае и сJ и скорость и имеют неравномерное распределение в пространстве). В результате количество вещества J, которое будет вынесено за тот же промежуток времени dτ через противоположные грани параллелепипеда, составит:
· в направлении оси z
· в направлении оси у
· в направлении оси х
Суммарно по всем осям:
где 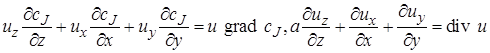
После вычитания выражения (4.2) из (4.1) получим (с учетом того, что для несжимаемой жидкости div u = 0) изменение количества вещества в элементарном объеме в результате конвективного переноса за время dτ:
Аналогично получим член уравнения материального баланса, описывающий изменение количества вещества J в результате диффузионного переноса. Диффузионный поток на входе в параллелепипед через грань dxdy (в направлении оси z)в соответствии с первым законом Фика равен
При прохождении потока через элементарный объем произойдет изменение градиента концентрации dcJ/dz на величину (d 2 cJ /dz 2 )dz,следовательно, диффузионный поток на выходе из параллелепипеда через противоположную грань составит
Изменение количества вещества J в результате диффузионного переноса через все грани параллелепипеда за время dτ
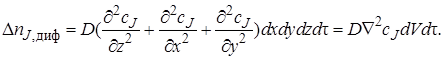
Расход вещества на химическую реакцию (или его образование в ходе химической реакции) внутри элементарного объема dV заэлементарный промежуток времени dτ пропорционален скорости реакции wrJ (она определяется концентрацией вещества JcJ,установившейся внутри элементарного объема), объему dV ивремени dτ:
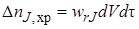
Следует отметить, что в соответствии с формальным правилом о знаках при составлении кинетических уравнений (см. §3.2) ∆nJ,хрположительно, если вещество J – реагент, и отрицательно, если J – продукт. Поэтому для сохранения физического смысла в уравнение материального баланса член ∆nJ,хрдолжен всегда входить со знаком «минус».
Накопление вещества J за время dτ внутри элементарного объема может произойти в результате приращения концентрации сJ при изменении времени на величину dτ. Это изменение концентрации равно (дcj/дτ)dτ. Соответственно накопление вещества в элементарном объеме dV
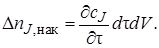
Таким образом, уравнение материального баланса по веществу J в соответствии с выражениями (4.3)–(4.6) можно записать как:
или, сократив все его члены на dFdx,
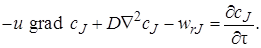
Уравнение (4.7) достаточно полно описывает химический процесс, протекающий в любом химическом реакторе (при его выводе не было принято никаких допущений об его применимости только к какому-то одному определенному типу химических реакторов). В нем отражен перенос импульса (первый член уравнения), диффузионный перенос (второй член) и протекание химической реакции (третий член).
Уравнение (4.7) вместе с уравнением теплового баланса, учитывающим явления теплопереноса в элементарном объеме реактора, составят полную математическую модель реактора. Таким образом, будет решен вопрос и о небольшом числе уравнений, составляющих математическую модель, и об ее полноте.
Однако уравнение (4.7) слишком сложно для решения (дифференциальное уравнение второго порядка в частных производных). Следовательно, реальный путь создания математических моделей, пригодных для решения практических инженерных задач по расчету и проектированию химических реакторов, заключается в упрощении математической модели, которое можно провести для различных частных случаев.
В соответствии с такой концепцией рассмотрим математические модели различных типов реакторов:
· реакторов для гомогенных процессов, работающих в изотермическом режиме;
Материальный и тепловой балансы химического процесса (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНСЫ ХИМИЧЕСКОГО ПРОЦЕССА
Материальный и тепловой балансы химического процесса: составляются на основе законов сохранения массы и энергии.
Уравнения материального и теплового балансов служат основой расчета реакционного объема аппарата (при заданной степени превращения) или степени превращения в реакторе (при заданных условиях). При расчете чаще всего пользуются выражением общего баланса, составленного по одному из исходных веществ, участвующих в химическом процессе. Вид уравнения зависит от типа реактора, в котором протекает процесс химического превращения веществ. Материальный баланс представляет собой основу для вывода зависимости связи между степенью превращения, скоростью и временем химического процесса, которая является необходимым элементом его расчета и носит название характеристического уравнения реактора. Если химическое превращение вещества протекает в неизотермических условиях, тепловой баланс процесса следует рассматривать совместно с его материальным балансом.
1. Общий материальный баланс реакционной системы равен сумме материальных балансов по каждому из реагирующих веществ:
где М — общее количество реакционной смеси, кмоль; t — время реакции, с;. D Мобщ — изменение общего количества реакционной смеси, кмоль×с-1.
2. Общее уравнение материального баланса для i-ro вещества, участвующего в реакции:
где Mi — количество i-го вещества в системе, кмоль; DMi — изменение количества i-го вещества, кмоль×с-1; ri —скорость химической реакции, выраженная по i-му веществу, кмоль×м-3×с-1; V — реакционный объем, м3.
3. Уравнения материального баланса для различных типов. химических реакторов.
Периодически действующий реактор идеального смешения:
где Ci — концентрация i-го вещества в системе, кмоль×м-3.
Непрерывнодействующий реактор идеального смешения:

где 

Каскад n непрерывнодействующих реакторов идеального смешения:

.где ,- концентрация i-ro вещества в системе на выходе из п-го реактора, кмоль×м-3; rin —скорость реакции по i-му веществу в n-м реакторе, кмоль×м-3×с-1
Непрерывнодействующий реактор идеального вытеснения:
где S — площадь поперечного сечения потока реагирующей системы, м2; L — длина реактора, м.
Полунепрерывнодействующий реактор идеального смешения:
По i-му веществу для этого реактора имеем:
где 


4. Общий вид уравнения теплового баланса:
где U — внутренняя энергия реакционной системы, кДж-кмоль»1; / — энтальпия системы, кДж×кмоль-1; . — коэффициент теплопередачи, Вт(м2×К)-1; F — площадь поверхности теплопередачи, м2; Тр — температура реакции, К или °С; Тх—температура теплоносителя (хладоагента), К или °С; р — давление в системе, Па.
5. Уравнения теплового баланса для различных типов химических реакторов.
Периодически действующий реактор идеального смешения при V = const:
где сu — удельная теплоемкость смеси реагирующих веществ при постоянном объеме, кДж(кмоль×К)-1; DHr — тепловой эффект реакции, кДж×кмоль-1.
Непрерывнодействующий реактор идеального смешения с внешним теплообменом:

где u0 — объемная скорость подачи реагирующих веществ, м3×с-1; Со — начальная концентрация реагирующих веществ, кмоль×м-3; х — степень превращения; То—начальная температура реакционной смеси, К или °С; Т1 — конечная температура реакционной смеси, К или °С; ср — удельная теплоемкость смеси реагирующих веществ при постоянном давлении, кДж(кг×К)-1
Непрерывнодействующий реактор идеального вытеснения с внешним теплообменом при постоянных температуре и составе по поперечному сечению потока:
где S — площадь поперечного сечения, м2; Rr — гидравлический радиус, м..
Непрерывнодействующий реактор идеального смешения, работающий в автотермическом режиме:
Адиабатический yепрерывнодействующий реактор идеального вытеснения с теплообменом между реагентом и продуктами реакции (система теплообменник — реактор):
где 
u0rcp(T0—
где 

Непрерывнодействующий реактор идеального вытеснения с внутренним теплообменом между исходными веществами и реакционной смесью (при подогреве исходных веществ):
где Ti— температура реакционной смеси во внутреннем подогревателе, К или °С.
Пример 2-1. В реакторе идеального смешения происходят следующие реакции:
где D — целевой продукт реакции; СRа = CSo = СТo = CDo = 0 — начальные концентрации промежуточных и конечных продуктов.
Начальная концентрация исходного вещества СА = 1 кмоль × м-3; текущие концентрации веществ (в кмоль × м-3); СА = 0,44; Св=1,06; СR = 0,05; CS = 0,33; СT = 0,14. Скорость подачи исходных веществ u0 = 5 × 10-3 м3 × с-1.
Определить производительность реактора GB по веществу В:
Решение. Составляем материальный баланс для реактора смешения. На основании стехиометрических соотношений реакций (а) и (г); (а) и (б); (а), (б), (в) и (г); (г) запишем:
CBo-CB = (3/2)CT + 2C’R+ C’S + CD, (3)
Комбинируя уравнения (1), (2), (4) и (5), а также (2) — (5), получаем:
CAo-CA = CR + CS + CD, (6)
CBo-CB=(3/2)CT + 2CR + 3CS-2CD. (7)
Из уравнения (6) определяем концентрацию продукта D:
CD = 1 — (0,44 + 0,05 + 0,33) = 0,18 кмоль × м-3.
Тогда производительность по продукту D будет равна:
Из уравнения (7) определяем концентрацию исходного вещества В
СВо= (3/2) 0,14 + 2 × 0,05 — 2 × 0,18+ 1,06 = 2 кмоль × м-3,
а затем производительность по веществу В:
Пример 2-2. В реакторе идеального смешения, работающем в адиабатических условиях, происходят реакции:
2R®S, (в)
где R — продукт реакции.
Начальные концентрации исходных веществ и продуктов (в кмоль × м-3): САо = 0,1; СВо=0,3; CRo = CDa = СРо =CSo = 0. Текущие концентрации взаимодействующих веществ (в кмоль х м-3): СА = 0,016; СР = 0,028; CS = 0,012; CD = 0,034.
Тепловой эффект реакции —DНr= 1,5 × 108 Дж (кмоль × В) -1. Плотность смеси r = 860 кг× м-3, теплоемкость смеси ср = = 2,85 × 103 Дж(кг×К)-1, скорость подачи u0 = 2,6×10-2×м3 ×с-1.
Определить производительность реактора по продукту R и температуру на выходе реактора, если начальная температура 12 °С (285 К).
Решение. Составляем уравнения материального и теплового баланса. Из стехиометрических соотношений уравнений реакции (а), (б) и (в) следует:
Тогда из уравнений (1) и (3) получим:
= 0,026 кмоль • м -3.
Из уравнений (2) и (3) находим:
СB = СВо — (СAо — СA) — 2СР = 0,30 — (0,1 —0,016) —2 • 0,028 =
= 0,160 кмоль • м -3.
Таким образом, производительность реактора по продукту R:
GR = CRu0 = 0,026 • 2,6 •10 -2 = 6,76•10 -4 кмоль • с -1.
где QP = (—DНr) (CBo —CB) u0 — тепловой поток, который выделяется в результате реакций; QH = cppu0 DT— тепловой поток, который затрачивается на нагревание реакционной смеси при адиабатических условиях работы реактора идеального смешения.
Из уравнения (4) после преобразования получаем:
Следовательно, температура на выходе из реактора равна 285 + 8,6 = 393,6 К или 20,6 °С.
Пример 2-3. В реакторе идеального вытеснения, работающем т адиабатических условиях, происходит жидкофазная реакция первого порядка
Константа скорости реакции kA (в с -1):
Начальные концентрации веществ (в кмоль×м-3): СAо=4,5; СB = 0. Тепловой эффект реакции—DHr=2×107 Дж(кмоль×А)-1, теплоемкость реакционной смеси ср:=2,2×103 Дж(кг×К)-1, плотность реакционной смеси r = 850 кг×м-3, температура исходной смеси Т0 = 300 К, скорость подачи uо= 10-3 м3 × с-1, объем реактора V = 5 м3.
Определить производительность реактора по продукту В и температуру смеси на выходе.
Решение. Тепловой баланс:
где QP = (—DHr) (СAо—CA) uо — тепловой поток, который выделяется в результате реакции; QH = срruо (Tк — Т0) — тепловой поток, который затрачивается на нагревание исходных веществ и продуктов реакции; Тк — температура реакционной смеси на выходе из реактора; Т0 — температура исходной смеси, подаваемой в реактор.
Характеристическое уравнение для необратимой реакции первого порядка, протекающей в реакторе идеального вытеснения:

Так как процесс протекает при адиабатических условиях, константа скорости реакции будет изменяться по ходу реакции. Используем метод конечных разностей:

где ki = 1013ехр(—1,2-104 Ti-1).
Для определения концентрации вещества А на выходе из реактора проводим последовательные приближения по Ti при шаге DT = 2 К. Тогда из уравнения материального баланса
определяем для каждого значения Тi соответствующее значение 


Тогда производительность реактора по продукту В:
= 1/2 (4,500 — 0,386) •= 2,06 •кмоль • с.
Пример 2-4. Установка состоит из следующих последовательно соединенных реакторов: идеального смешения (V1 = 2 м3), идеального вытеснения (V2 = 2 м3) и идеального смешения (V3 = 3 м3). Начальная концентрация вещества САo = = 1 кмоль • м -3, скорость подачи uо = 5×10-2 м3×с-1, скорость реакции (-rA) =5,1 • 10-3CA0,28. В начальный момент времени продукт в системе отсутствует. Плотность реакционной смеси не меняется.
Определить концентрацию исходного вещества после каждого реактора и рассчитать графически производительность установки по продукту, если известно, что 1 моль исходного вещества дает 2 моль продукта.
Решение. Составляем материальный баланс по веществу А для 1-го реактора смешения:
Для нахождения времени пребывания в реакторе идеального вытеснения интегрируем кинетическое уравнение:

Составляем материальный баланс по веществу А для 2-го реактора смешения:

Материальный баланс РИС-П
Описание модели РИС-П
Реактор идеального смешения периодического действия представляет собой ёмкостный аппарат с перемешивающим устройством.
В периодический реактор все реагенты помещают до начала реакции, а продукты извлекают из него только после проведения процесса.
Общая масса реакционной смеси в реакторе остается постоянной, а изменяется лишь ее состав.
Условием идеальности работы реактора смешения периодического действия является мгновенное установление одинаковых параметров процесса в реакционном объеме аппарата в результате интенсивного перемешивания.
 |
Схема реактора идеального смешения периодического действия:
1 – внутренний объем реактора;
2 – реакционный объем;
3 – мешалка;
4 – штуцер для опорожнения реактора;
5 – загрузочное отверстие;
Т.Н. – теплоноситель или хладагент, поступающий в теплообменную рубашку.
РИС-П работает в нестационарном режиме, т.е. в разные моменты времени условия в периодическом реакторе разные (концентрация реагентов, продуктов, скорость реакции и т. д.). Однако в каждый момент времени в силу допущения об идеальности эти параметры одинаковы во всем объеме реактора.
Исходя из допущений об идеальности РИС-П, за элементарный объем аппарата принимают весь реакционный объем (Vp). Так как РИС-П работает в нестационарном режиме, за элементарный промежуток времени принимают бесконечно малую величину dτ.
 |
Изменение концентрации реагента А в реакторе идеального смешения периодического действия во времени процесса и в объеме в разные моменты времени
В реальных условиях приблизиться к режиму идеального смешения можно, применяя интенсивное перемешивание реакционной смеси. Наряду с этим, форма и размеры емкостного аппарата должны быть оптимальными для уменьшения объема застойных зон.
Материальный баланс РИС-П
Материальный баланс показывает изменение количества реагента или продукта за счёт его поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени. Материальный баланс РИС-П составляют на стадию химической реакции при отсутствии подачи реагентов и отвода продуктов (NAвх = NAвых= 0).
Запишем материальный баланс РИС-П по взятому в недостатке реагенту A:
Здесь NAх.р − количество (в молях) реагента A, расходуемого на протекание химической реакции в элементарном объёме за элементарный промежуток времени,
NAнак − количество (в молях) реагента A, накопленное вэлементарном объёме за элементарный промежуток времени.
Входящие в состав материального баланса РИС-П слагаемые могут быть выражены через параметры процесса следующим образом:


При подстановке полученных выражений в уравнение материального баланса РИС-П получим:
Преобразуем выражение, сократив на реакционный объём реактораVр:
Выразим отсюда элементарный промежуток времени dτ:
Проинтегрировав dτ на интервале от 0 до τх.р, рассчитаем полное время протекания химической реакции в РИС-П τх.р:
Учитывая, что 
Тепловой баланс РИС-П
Тепловой баланс показывает изменение количества теплоты за счёт её поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени. Тепловой баланс РИС-П составляют на стадию химической реакции при отсутствии подачи реагентов и отвода продуктов (Qвх = Qвых = 0).
Запишем тепловой баланс политермического РИС-П:
Здесь Qх.р − количество теплоты, выделяющейся (со знаком плюс) или поглощаемой (со знаком минус) при протекании химической реакции в элементарном объёме за элементарный промежуток времени,
Qт.о − количество теплоты, вносимой (со знаком плюс) в элементарный объём или отводимой (со знаком минус) из него за счёт теплообмена с теплоносителем или хладагентом за элементарный промежуток времени,
Qнак − количество теплоты, накопленное в элементарном объёме за элементарный промежуток времени.
Входящие в состав теплового баланса РИС-П слагаемые могут быть выражены через параметры процесса следующим образом:
(здесь ΔH − тепловой эффект химической реакции, WA − скорость химической реакции по компоненту A, Vр − реакционный объём реактора, dτ − элементарный промежуток времени)
(здесь Kт − коэффициент теплопередачи между теплоносителем или хладагентом и реакционной массой, F − поверхность теплообмена между теплоносителем или хладагентом и реакционной массой, ΔT− положительная разность температур между теплоносителем или хладагентом и реакционной массой, dτ − элементарный промежуток времени)
(здесь ρ − плотность реакционной массы в реакционном объёме реактора, Vр − реакционный объём реактора, cp − удельная теплоёмкость реакционной массы в реакционном объёме реактора,dT − изменение температуры в реакционном объёме реактора за элементарный промежуток времени dτ)
При подстановке полученных выражений в уравнение теплового баланса РИС-П получим:
Преобразуем выражение, разделив на реакционный объём реактораVр:
Выразим из материального баланса РИС-П скорость реакцииWA:
Подставим это выражение в тепловой баланс и разделим все слагаемые на CAo:
Учитывая, что мольная теплоёмкость с ‘ p может быть рассчитана по формуле 
В случае адиабатического теплового режима, характеризующегося отсутствием теплообмена реакционной смеси с теплоносителем или хладагентом (тепловая изоляция реактора), тепловой баланс РИС-П примет вид:

В случае изотермического теплового режима, характеризующегося постоянством температуры реакционной смеси (dT = 0) получим:

http://pandia.ru/text/78/161/9489.php
http://poisk-ru.ru/s27869t12.html