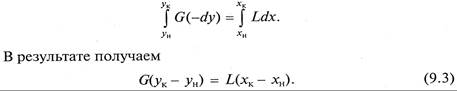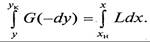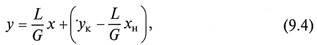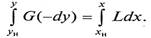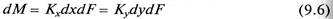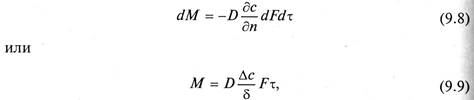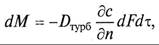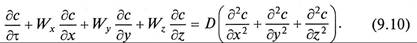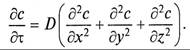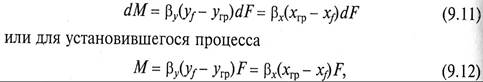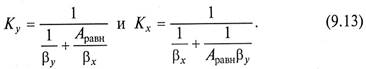Материальный баланс
|
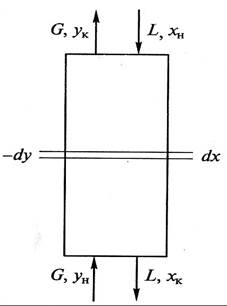
Рассмотрим массообменный процесс между фазами G и L в противоточном аппарате, схема которого представлена на рис. 9.1. Будем считать, что начальные хн, ун и конечные хк, ук массовые (мольные) концентрации распределяемого вещества в фазах G и L соответствуют его переходу из фазы G в фазу L. В этом случае на некотором малом участке произвольного сечения массоо6менного аппарата концентрация компонента М в фазе L увеличится на величину dх, а в фазе G уменьшится на величину dу (по ходу движения фазы).
Таким образом, переданное количество dМ распределяемого компонента можно записать как по одной, таки по другой распределяющим фазам:
Уравнение (9.2) является дифференциальным уравнением материального баланса массообменного процесса.
Для получения полного (интегрального) уравнения материального баланса проинтегрируем его в пределах изменения рабочих концентраций
Легко убедиться, что уравнение (9.3), так же как и (9.2), не зависит от направления движения взаимодействующих фаз, а характеризует только материальный баланс системы при массопередаче.
Важной характеристикой массоо6менных процессов являются уравнения рабочих линий, которые связывают между собой концентрации распределяемого компонента в распределяющих фазах во время осуществления процесса.
Различают два основных способа взаимодействия распределяющих фаз в процессе массообмена: противоток и прямоток.
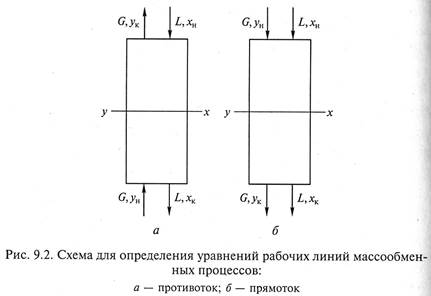
1. Противоточная схема проведения процесса массопередачи (рис. 9.2, а).
Используя уравнение материального баланса (9.2), проинтегрируем его для верхней части аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии противоточного процесса массопередачи
которое является уравнением прямой с тангенсом угла наклона L/G. Второе слагаемое является постоянной величиной, Не меняющейся в случае интегрирования уравнения (9.2) в пределах концентраций в нижней части массообменного аппарата.
2. Прямоточная схема осуществления процесса массопередачи (рис. 9.2, б).
Интегрирование уравнения (9.2) произведем также для верхней части массообменного аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии прямоточного процесса массопередачи
Уравнение (9.5) также является уравнением прямой линии, однако угол наклона этой прямой противоположен углу наклона рабочей линии противоточного массообменного процесса, о чем указывает знак « — » перед значением тангенса угла (L/G) наклона прямой.
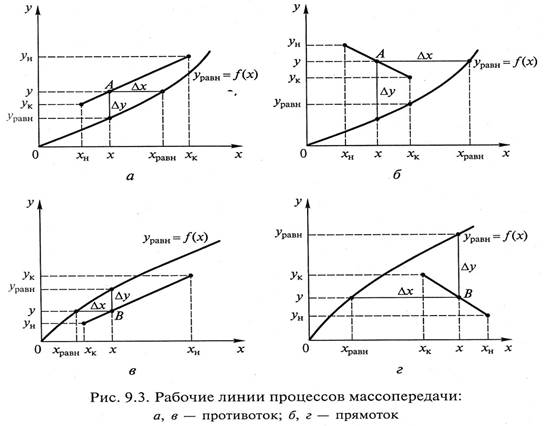
Изображения рабочих линий процесса массопередачи для противотока и прямотока представлены на рис. 9.3.
Движущая сила массоо6менного процесса определяется степенью отклонения системы от равновесия и может быть выражена разностью содержаний целевого компонента в рабочем и равновесном состояниях системы (Δу или Δх). Направление переноса
распределяемого вещества удобно определять на диаграмме у – х по расположению равновесной и рабочей линий.
Если рабочая линия расположена выше линии равновесия (рис. 9.3, а, б), то для любой точки, расположенной на этой линии (точка А), у > уравн и х хравн.
При таком процессе распределяемый компонент будет переходить из фазы L в фазу G, причем движущая сила в точке В, выраженная через концентрации соответствующих фаз, может быть записана как Δу = уравн – y и Δх = х – хравн.
Скорость массопередачи может быть выражена через количество вещества, переходящего в единицу времени из одной фазы в другую. В этом случае, в соответствии с (В. 3) можно записать основное уравнение массопередачи в дифференциальном
или интегральном (для стационарных процессов) виде
Скорость массопередачи связана с механизмом переноса распределяемого вещества в фазах, между которыми происходит массообмен.
Перенос вещества в фазах может происходить либо путем молекулярной диффузии, либо конвекцией и молекулярной диффузией одновременно (конвективная диффузия).
Массопередача молекулярной диффузией осуществляется в неподвижной среде вследствие движения молекул, атомов и ионов.
Массопередача конвективной диффузией реализуется в движущейся среде. При этом если движение жидкости обусловлено градиентами температуры или концентрацией, то такая конвекция называется свободной, или естественной. Если движение вызвано внешними силами, конвекция является вынужденной.
В случае турбулентного движения жидкости, сопровождающегося массопередачей, в ряде случаев рассматривают турбулентный механизм переноса вещества, при котором оно переносится беспорядочными турбулентными пульсациями потока. Такой механизм называется турбулентной диффузией.
Молекулярная диффузия описывается первым законом Фика, в соответствии с которым количество продиффундировавшего вещества dМ пропорционально градиенту концентрации в направлении диффузии дс/дп, площади массопередачи dF, перпендикулярной направлению диффузионного потока и времени осуществления процесса dτ,
где 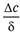
Коэффициент пропорциональности D в уравнениях (9.8) и (9.9) называется коэффициентом молекулярной диффузии и имеет размерность м 2 /с при с, кг/м 3 .
Коэффициент молекулярной диффузии показывает, какая масса вещества диффундирует в единицу времени через единицу поверхности при градиенте концентрации, равном единице. Значение коэффициента молекулярной диффузии зависит от природы и свойств как распределяемого вещества, таки среды, через которую он диффундирует, а также давления и температуры. Причем увеличению его значения способствует повышение температуры и уменьшение давления. Знак минус перед правой частью уравнения (9.8) указывает на то, что молекулярная диффузия протекает в направлении уменьшения концентрации распределяемого компонента.
В ряде случаев по аналогии с первым законом Фика, записывают уравнение, характеризующее массопередачу в результате турбулентной диффузии,
где Dтурб – коэффициент турбулентной диффузии, зависящий от гидродинамических условий протекания процесса — скорости потока и масштаба турбулентных пульсаций.
Конвективная диффузия характеризуется тем, что полный поток вещества складывается из конвективного и диффузионного потоков.
Поскольку конвективный перенос вещества осуществляется преимущественно потоками жидкости, его интенсивность учитывается компонентами скорости перемещения массы, диффузионная составляющая – коэффициентом молекулярной диффузии и суммой вторых производных концентраций по соответствующим координатам
Уравнение (9.10) является дифференциальным уравнением конвективной диффузии.
При массоо6мене в неподвижном слое проекции скорости на оси координат Wx = Wy = =Wz= 0, и уравнение (9.10) преобразуется в дифференциальное уравнение молекулярной диффузии (второй закон Фика)
Трудности теоретического описания и расчета процесса массопередачи обусловлены сложностью механизма переноса вещества к границе раздела фаз и от нее, недостаточной изученностью гидродинамических закономерностей турбулентных потоков, особенно вблизи границы раздела фаз.
|
В связи с этим предложен ряд теоретических моделей, в основу большинства которых положены допущения:
· общее сопротивление процессу массопередачи складывается из сопротивления распределяющих фаз. Сопротивлением поверхности разделав большинстве случаев можно пренебречь;
· на поверхности раздела фазы находятся в равновесии.
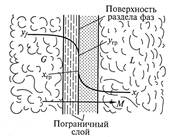
На рис. 9.4 представлена схема массопередачи между система ми жидкость – газ (пар) или жидкость — жидкость. Фазы разделены поверхностью раздела и движутся друг относительно друга с некоторой скоростью.
Процесс массопередачи заключается в переносе распределяемого вещества из фазы G к поверхности раздела фаз (процесс массоотдачи), а затем массоотдачи от поверхности раздела к фазе L.
Процесс массопередачи связан со структурой потока в каждой фазе, которая включает турбулентное ядро потока, где массоперенос осуществляется конвекцией и концентрация компонента практически постоянна. При приближении к поверхности раздела в пограничном слое происходит затухание пульсаций, преобладание механизма молекулярной диффузии, а следовательно, резкое уменьшение концентраций.
Для нахождения скорости перехода вещества из одной фазы к поверхности раздела фаз и далее от нее во вторую фазу используют уравнения массоотдачи, которые для схемы, представленной на рис. 9.4, можно записать как
где уf — угр и хгр — хf – движущие силы в процессах массоотдачи в фазах G и L; F – поверхность массопередачи; βy и βх – коэффициенты массоотдачи (β, м/с, при размерности единичной движу щей силы – кг/м 3 ).
Коэффициент массоотдачи показывает, какое количество вещества переходит из ядра потока к поверхности раздела (или наоборот) через единицу площади поверхности за единицу времени при движущей силе, равной единице, и зависит в первую очередь от гидродинамических условий.
Если равновесная линия массообменного процесса – прямая с тангенсом угла наклона Аравн, то между коэффициентами массопередачи Кy, Кх из уравнений (9.6) (9.7) и коэффициентами массоотдачи βy, βх из уравнений (9.11) (9.12) существует однозначная связь
Коэффициент массопередачи показывает, какое количество вещества переходит из одной фазы в другую за единицу времени через единицу площади поверхности контакта фаз при движущей силе массопередачи, равной единице. Размерность коэффициента массопередачи совпадает с размерностью коэффициента массоотдачи.
Поскольку величины, обратные значениям коэффициентов массопередачи, представляют собой общее сопротивление переносу вещества из фазы в фазу (В.3), то выражения в знаменателях уравнений (9.13) представляют сумму сопротивлении массоотдачи в фазах.
Для расчетов коэффициентов массоотдачи βх и βy чаще всего используют уравнения, которые получают на основании теории подобия.
Дата добавления: 2015-08-14 ; просмотров: 3509 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Дифференциальное уравнение материального баланса
Дифференциальное уравнение материального баланса
- Массовый поток. Уравнения, ранее оцененные в этой главе, применимы только к стабильным одномерным потокам. Если это сложнее, то необходимо использовать дифференциальные уравнения материального баланса, полученные в разделе 2. 9. Проанализируйте эти уравнения и установите связи с различными типами вводимых потоков. Уравнение (9. 17) и (9. 18) в выводе предполагается, что 1-литровый диффузионный поток накладывается. Вызывается средним расходом и выражается в средней массовой скорости, как мы теперь знаем. Формула (9. 18) в Где * и u-обе составляющие средней массовой скорости.
Формулу (9. 18) удобно применять к системе постоянной плотности, где члены в скобках равны нулю, а формула(9. 19). Уравнение (9. 19) аналогичное уравнение、 Постоянная плотность Другие топоры. Уравнение (9. 18) для жидкости, формат(9. Двадцать два) °Ч — _ н ИА’0l. АЭЛ.、\ — ДГ-РКН-дуги + — ый)+ га ’ Коэффициент диффузии O AB является постоянной величиной. Плотность многих растворов относительно не изменяется при изменении концентрации.
Математическая формулировка закона теплопроводности может быть выражена следующим образом: дп (2-1) пояснить, воспользовавшись закона теплопроводности. Людмила Фирмаль
Например, плотность водного раствора этилового спирта составляет 0.9996-0.7994 г! При см3 плотность моля составляет 48-16 кмоль / м3. для стабильного 1-D потока в направлении оси y уравнение (9. 22) принимает вид: 1У АВ(1У) (32.28)) Куда деваться после интеграции «0Л = ОАВ ^-+°OPZ1. (32.29) значение otsl представляет собой поток компонента A, вызванный средней скоростью. Hxa или (LA- / — Lgv) равны xA. Поскольку диффузионный член равен-IA, выражение (32.29) можно записать следующим образом: sop51 = +(я + ДГК) ХД. (32.30) 1. однако следует отметить, что коэффициент диффузии (таблица 31.2) автономной адресной книги в значительной степени зависит от концентрации.
Мы будем изучать в этой книге ИО будет. Правая часть уравнения (32.30) представляет собой сумму потоков, обусловленных диффузией и средней скоростью, т. е. фиксированной системы координат нет. Равен суммарному потоку компонента а относительно А. Таким образом, интегральная постоянная равна АХЛ, а формула(32. 30) — это формула (32. 20) и идентичны. Это лекарство не для генерала public. In в газовой системе с давлением, близким к атмосферному в изотермических условиях, молярная плотность смеси постоянна. Для уравнений неразрывности, полученных в начале СН 9, представим значения в Моле и уравнении(9. 12) учитывая, что если нет химической реакции, то это было бы: Дамба.
- Их значения ui и u₂ являются компонентами средней молярной скорости, случай системы с постоянной молярной плотностью. Формула молярного баланса компонента а(9. Шестнадцать) л(мл + ЛГ) ау ах yu33> Анализ Свинца Это выражение является выражением(9. 18), но термины, включающие га, опущены. Формула (32.31)применима только к системам, в которых не происходит реакции. Это происходит потому, что в общем случае это не 2 g ноль. 2r всегда равно нулю. Если молярная плотность Р постоянна, то формула(32. 32) применяется、 (32. Тридцать пять> Это выражение эквивалентно выражению (31.1).Аналогичная зависимость действительна и для 2 других осей.
Для В системе с постоянной молярной плотностью при отсутствии химической реакции формула (32.34) имеет вид (32.36)) Это формула(9. 22). для одномерных стационарных течений вдоль оси y уравнение (32.36) принимает следующий вид: (32.37)) После интеграции, откуда ^ л =°ЛВ^ -+⁰, 1⁸1• (32.38) Поскольку константа равна молярному расходу IV, то формула (32. 38) является формулой(32. 18). Применение дифференциальных уравнений баланса. Одновременное решение дифференциальных уравнений сохранения вещества и энергии, а также уравнений постоянства импульса многокомпонентных систем может быть очень сложным.
В этом случае вследствие симметрии поток тепла в точке обязательно имеет направление, перпендикулярное к изотермической поверхности через точку. Людмила Фирмаль
Например, для газовой системы можно применить уравнение (32.36), но уравнение Навье-Стокса записывается в массовых, а не молярных единицах. Уравнение Навье-Стокса постоянной плотности p (уравнение (I. 52)-(11. 54)] вместо уравнения (11. 50) с уравнением, аналогичным уравнению(9. 18) было бы лучше применить переменную плотность p. К счастью, в большинстве реальных случаев решение эффективного уравнения Навье-Стокса не оказывает существенного влияния в отсутствие массопереноса. Например, если на стенках трубы находятся несколько нерастворимых веществ, которые либо диффундируют в сторону оси потока.
Массоперенос газовой смеси, который не настолько велик, чтобы изменение концентрации оказывало существенное влияние на плотность, включает формулу(9. 22).Если опущенный вторичный эффект игнорируется в простых случаях, по поводу которых происходят реакции и большие изменения в составе, то могут возникнуть серьезные ошибки. Формула (10. 11) и(10. 14) смогите сделать такой же вид remark. In во многих простых уравнениях тепловой поток, вызванный диффузией, игнорируется в этих уравнениях. Дело можно проигнорировать. Скорость используется из расчета средней массы Они считаются в штанах.




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
МАТЕРИАЛЬНЫЙ БАЛАНС ЭЛЕМЕНТАРНОГО ОБЪЕМА РЕАКТОРА В ДИФФЕРЕНЦИАЛЬНОЙ ФОРМЕ. МАТЕРИАЛЬНЫЙ БАЛАНС РЕАКТОРОВ ДЛЯ СТАЦИОНАРНОГО И НЕСТАЦИОНАРНОГО РЕЖИМОВ ИХ РАБОТЫ.
Исходным уравнением для получения характеристического уравнения реактора любого типа является материальный баланс в следующем виде:
Составим материальный баланс по исходному веществу А при проведении простой необратимой реакции А → R [6].
В общем виде уравнение материального баланса записывается так

где 
Учитывая, что поступившее в реактор вещество А расходуется в трех направлениях, можно записать

где 


С учетом уравнения (59) уравнение (58) записывается в виде

Разность между массой вещества А, поступающего в единицу времени в реактор 

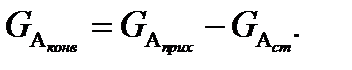
Принимая это во внимание, уравнение (61) можно записать в такой форме

В каждом конкретном случае уравнение материального баланса принимает различную форму. Оно может составляться для единицы объема реакционной массы, либо для бесконечно малого (элементарного) объема, либо для реактора в целом. При этом можно рассчитывать материальные потоки, проходящие через объем за единицу времени, а можно относить эти потоки к 1 молю одного из исходных реагентов.
Так, в общем случае, когда состав реакционной смеси, температура и другие параметры непостоянны в различных точках реактора или непостоянны во времени, материальный баланс составляют в дифференциальной форме для элементарного объема реактора. В результате получают уравнение конвективного массообмена [10], дополненное членом vА, который учитывает протекание химической реакции. Составленное по исходному реагенту А, оно имеет вид

где СА – концентрация вещества А в реакционной смеси; x, y, z – пространственные координаты; D – коэффициент молекулярной и турбулентной диффузии; vА – скорость химической реакции.
Член в левой части уравнения (63) отражает общее изменение концентрации исходного вещества во времени в элементарном объеме, для которого составляется материальный баланс. Это накопление вещества А. Этому члену соответствует величина 
Уравнения (70) и (71) представляют математическое описание потоков тепла в нестационарном режиме, когда имеет место накопление тепла, и температура процесса изменяется во времени.
Для реакторов непрерывного действия характерен стационарный режим. Неустановившееся состояние наблюдается только в пусковой период и в период остановки реактора. В дальнейшем все реакторы непрерывного действия будут рассматриваться только в стационарном режиме, когда отсутствует накопление тепла, т. е. Qнак = 0.
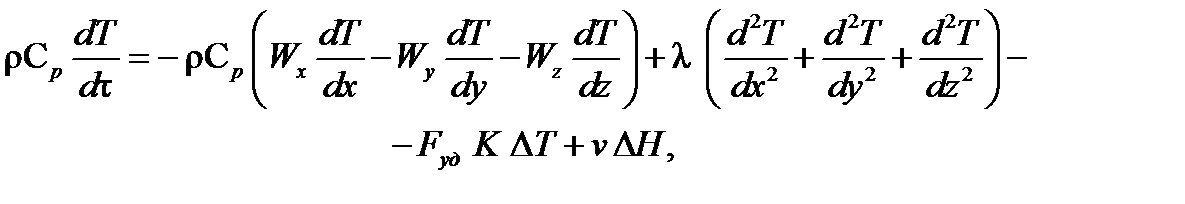
где ρ – плотность реакционной смеси; Ср – удельная теплоемкость реакционной смеси; х, y, z – пространственные координаты; Wx, Wy, Wz – составляющие скорости движения потока в направлении осей Х, Y, Z; λ – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси; Fуд – удельная поверхность теплообмена; K – коэффициент теплопередачи; ΔТ = Т – Тт; Т – температура реакционной смеси; Тт – температура в теплообменнике; v – скорость химической реакции; ΔН – изменение энтальпии реакции.
ХАРАКТЕРИСТИЧЕСКИЕ УРАВНЕНИЯ ДЛЯ МОДЕЛЕЙ РЕАКТОРОВ РИС – П, РИВ И РИС – Н И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ РАСЧЕТА ОБЪЕМОВ РЕАКТОРОВ.
Реактор идеального смешения периодический (РИС-П). Это реактор периодического действия с перемешивающим устройством. Перемешивание в таком реакторе настолько интенсивное, что в каждый данный момент времени концентрация реагентов одинакова по всему объему реактора и меняется лишь во времени по мере протекания химической реакции.
Математической моделью РИС-П является его характеристическое уравнение. Исходя из этого уравнения, представляется возможным установить размеры реактора, а также исследовать эту модель с точки зрения определения оптимальных значений всех параметров, входящих в характеристическое уравнение.
Исходным соотношением для получения характеристического уравнения реактора, как уже отмечалось, является уравнение материального баланса в дифференциальной форме.
В РИС-П все параметры (в том числе и концентрация СА реагента А) одинаковы по всему объему реактора в любой момент времени, так как реакционная смесь интенсивно перемешивается. Производная любого порядка от концентрации по х, y, z равна нулю, поэтому можно записать

С учетом полученных значений уравнение упрощается и может быть записано не в частных производных, а в виде обыкновенного дифференциального уравнения:
При выражении скорости реакции по исходному веществу А 
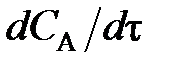
Реакторы непрерывного действия (проточные реакторы): реактор идеального смешения (РИС-Н) и реактор идеального вытеснения (РИВ).В реакторах непрерывного действия питание их реагентами и отвод продуктов реакции осуществляется непрерывно.
Если в периодическом реакторе можно непосредственно (по часам) измерить продолжительность реакции, так как показатели процесса меняются во времени, то в реакторе непрерывного действия это сделать невозможно (при установившемся режиме параметры не меняются со временем). Поэтому для непрерывных реакторов удобней пользоваться понятием условного времени пребывания реагентов в системе (времени контакта), которое определяется уравнением
τ =
где τ – время пребывания; Vр – объем реактора; V0 – объем реакционной смеси, поступающей в реактор в единицу времени (объемный расход реагентов), измеренный при определенных условиях.
Для получения характеристического уравнения РИВ исходят из дифференциального уравнения материального баланса (63), упрощая его на основе указанных выше особенностей этого реактора. Поскольку в РИВ реакционная смесь двигается только в одном направлении (по длине l), то для первой группы членов правой части уравнения (63) можно записать (выбрав за направление оси Х направление движения потока реагентов в реакторе):
где W – линейная скорость движения реакционной смеси в реакторе; l – длина пути, пройденного элементом объема реакционной смеси в реакторе.
Непрерывный реактор идеального смешения (РИС-Н) – это реактор с мешалкой, в который непрерывно подают реагенты и выводят из него продукты реакции.
Это характеристическое уравнение реактора идеального смешения. Для более общего случая, когда начальная степень превращения хА0 не равна нулю, оно записывается
АДИАБАТИЧЕСКИЙ, ИЗОТЕРМИЧЕСКИЙ И ПОЛИТРОПИЧЕСКИЙ ТЕПЛОВЫЕ РЕЖИМЫ ДЛЯ МОДЕЛЕЙ РЕАКТОРОВ РИС — П, РИВ И РИС – Н
В адиабатическом реакторе отсутствует теплообмен с окружающей средой, и тепло химической реакции полностью расходуется на изменение температуры реакционной смеси.
В изотермическом реакторе путем подвода или отвода тепла поддерживают постоянную температуру в течение всего процесса.
В политропическом реакторе температура не постоянна, при этом часть тепла отводится или подводится.
Адиабатический и изотермический реакторы представляют предельные случаи, которых на практике не бывает, но режим работы многих промышленных реакторов приближается к этим крайним моделям, поэтому с достаточной для практических целей точностью реакторы могут рассчитываться по уравнениям, полученным для адиабатических и изотермических режимов.
Исходным уравнением для расчета реакторов с учетом переноса тепла является уравнение теплового баланса, 
Адиабатический реактор периодического действия, например реактор идеального смешения (А-РИС-П), представляет собой аппарат с мешалкой, стенки которого имеют тепловую изоляцию для поддержания адиабатического режима. В адиабатических реакторах нет теплообмена, т. е. Qт = 0. В периодическом реакторе отсутствует также и конвективный поток, поэтому Qконв = 0
Адиабатические реакторы непрерывного действия. В адиабатических проточных реакторах отсутствует теплообмен с окружающей средой (Qт = 0), для стационарных условий не происходит также накопление тепла (Qнак = 0), поэтому уравнение принимает вид
Адиабатический реактор идеального вытеснения (А-РИВ) представляет собой трубчатый реактор, снабженный тепловой изоляцией. Значения тепловых потоков, входящих в уравнение 
В реакторе идеального вытеснения конвективный перенос тепла (так же, как и вещества) происходит только в направлении основного перемещения потока реагентов, т. е. по длине реактора l (или по оси Х), а по осям Y и Z градиенты параметров равны нулю, поэтому можно записать
Адиабатический реактор идеального смешения непрерывный (А-РИС-Н) снабжен мешалкой и тепловой изоляцией для поддержания в нем адиабатического режима. Следует помнить, что в РИС-Н благодаря интенсивному перемешиванию все параметры процесса, имеющие на входе в реактор значения CА0, хА0, Т0, мгновенно изменяются до CА, хА, Т, имеющих одинаковые значения по всему объему реактора и отличающихся от выходных параметров.
Рассмотрим вывод уравнения теплового баланса для А-РИС-Н, работающего в стационарном режиме, для которого Qнак = 0 и Qт = 0, и уравнение (70) принимает вид
При этом 

В изотермическом реакторе идеального смешения непрерывном отвод (или подвод) тепла осуществляется через стенку, которая охлаждается каким-либохладоагентом или с помощью теплообменных элементов, расположенных внутри реактора.
Так как в изотермических условиях температура реакционной среды не изменяется (Т0 = Т), уравнение 
Политропические реакторы
В политропическом реакторе имеет место теплообмен, и температура реакционной среды меняется, причем изменение температуры может происходить по любому закону, независимо от величины теплового эффекта протекающих в нем реакций и степени превращения. Поэтому наиболее важная задача при расчете политропических реакторов состоит в определении оптимального профиля (во времени или в пространстве) температуры, при которой скорость процесса в любой момент времени реактора РИС или в любом сечении реактора РИВ была бы максимально высокой. Уравнение теплового баланса (70) политропического реактора для стационарных условий запишется в виде
http://lfirmal.com/differencialnoe-uravnenie-materialnogo-balansa/
http://megalektsii.ru/s45132t3.html