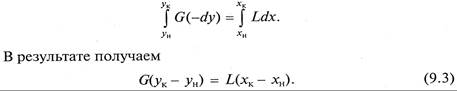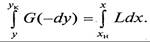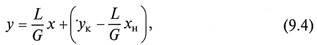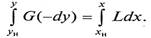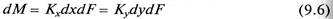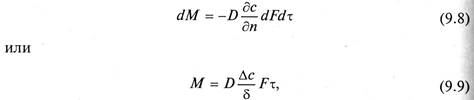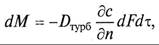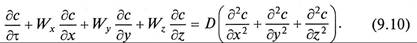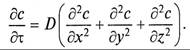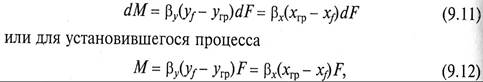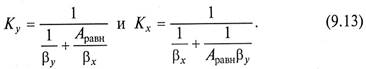Расчёт изотермического РИВ
Описание модели РИВ
Реактор идеального вытеснения представляет собой длинный канал, через который реакционная смесь движется в поршневом режиме, при котором каждый ограниченный двумя плоскостями перпендикулярными оси потока элемент не смешивается ни с предыдущими ни с последующими элементами.

В РИВ выполняются следующие допущения об идеальности:
1. Движущийся поток имеет плоский профиль линейных скоростей (то есть скорость движения потока в любой точке поперечного сечения реактора одинакова).
2. В любом сечении, перпендикулярном оси потока, все параметры выравнены.
3. Отсутствует перемешивание смеси в направлении оси потока.
Для реакторов непрерывного действия характерен стационарный режим работы, то есть параметры в реакторе не изменяются с течением времени.
Отсутствие перемешивания вдоль оси реактора идеального вытеснения при протекании в нем химической реакции приводит к неравномерному распределению концентраций участников реакции по длине аппарата.
Исходя из допущений об идеальности РИВ, за элементарный объем аппарата принимают бесконечно малый объем (dVp). В качестве элементарного объема можно рассматривать объем, вырезанный в канале двумя параллельными плоскостями, находящимися друг от друга на бесконечно малом расстоянии dl и перпендикулярными оси канала. По условию стационарности в качестве элементарного промежутка времени можно принять любой промежуток времени τ.

Следует отметить, что допущения об идеальности в реальных реакторах не выполняются. Из гидравлики известно, что даже очень гладкие каналы оказывают гидравлическое сопротивление движению потока. Наличие сопротивления движению приводит к уменьшению скорости движения потока от центра канала к стенкам.

Сравнивая профили скоростей при различных потоках, видим, что максимально приблизиться к идеальному вытеснению можно лишь в развитом турбулентном режиме. Однако турбулентный поток характеризуется наличием нерегулярных пульсаций, носящих хаотичный характер, в результате чего некоторые частицы потока могут опережать основной поток или отставать от него, т. е. произойдет частичное перемешивание в осевом направлении. Конечно, абсолютные значения таких перемещений будут невелики по сравнению с основным осевым перемещением потока и при больших линейных скоростях ими можно пренебречь. В то же время турбулентные пульсации в радиальном направлении будут способствовать локальному перемешиванию реагентов в сечении.
В реальном реакторе можно приблизиться к режиму идеального вытеснения, если:
1) реакционный поток — турбулентный;
2) длина канала существенно превышает его поперечный размер (например, для цилиндрических труб L/D > 20).
Материальный баланс РИВ
Материальный баланс показывает изменение количества реагента или продукта за счёт его поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени.
Запишем материальный баланс РИВ по взятому в недостатке реагенту A:
Здесь NAвх − количество (в молях) реагента A, поступающего со входящим в элементарный объём потоком реакционной массы за элементарный промежуток времени,
NAвых − количество (в молях) реагента A, уходящего с выходящим из элементарного объёма потоком реакционной массы за элементарный промежуток времени,
NAх.р − количество (в молях) реагента A, расходуемого на протекание химической реакции в элементарном объёме за элементарный промежуток времени.
Входящие в состав материального баланса РИС-Н слагаемые могут быть выражены через параметры процесса следующим образом:



При подстановке полученных выражений в уравнение материального баланса РИВ получим:
Преобразуем выражение, сократив на элементарный промежуток времени τ, и вынеся за скобку объёмный расход смеси Vo:
Отношение элементарного объёма dVр к объёмному расходу реакционной смеси Vo соответствует полному времени пребывания частиц в элементарном объёме (для сохранения аналогии с РИС-Н будем называть его средним временем пребывания):
Выразив среднее время пребывания частиц в элементарном объёме, получим дифференциальную форму характеристического уравнения РИВ:
Проинтегрировав 

Учитывая, что 
Тепловой баланс РИВ
Тепловой баланс показывает изменение количества теплоты за счёт её поступления (со знаком плюс) и расходования (со знаком минус) в элементарном объёме за элементарный промежуток времени.
Запишем тепловой баланс политермического РИВ:
Здесь Qвх − количество теплоты, поступающей со входящим в элементарный объём потоком реакционной массы за элементарный промежуток времени,
Qвых − количество теплоты, уходящей с выходящим из элементарного объёма потоком реакционной массы за элементарный промежуток времени,
Qх.р − количество теплоты, выделяющейся (со знаком плюс) или поглощаемой (со знаком минус) при протекании химической реакции в элементарном объёме за элементарный промежуток времени,
Qт.о − количество теплоты, вносимой (со знаком плюс) в элементарный объём или отводимой (со знаком минус) из него за счёт теплообмена с теплоносителем или хладагентом за элементарный промежуток времени.
Входящие в состав теплового баланса РИВ слагаемые могут быть выражены через параметры процесса следующим образом:
(здесь ρo − плотность входящей в элементарный объём реакционной смеси, Vo − объёмный расход реакционной смеси, cpo − удельная теплоёмкость входящей в элементарный объём реакционной смеси,T − температура входящей в элементарный объём реакционной смеси, τ − элементарный промежуток времени),
(здесь ρ − плотность выходящей из элементарного объёма реакционной смеси, Vo − объёмный расход реакционной смеси, cp − удельная теплоёмкость выходящей из элементарного объёма реакционной смеси, (T+dT) − температура выходящей из элементарного объёма реакционной смеси, τ − элементарный промежуток времени)
(здесь ΔH − тепловой эффект химической реакции, WA − скорость химической реакции по компоненту A, dVр − элементарный объём,τ − элементарный промежуток времени)
(здесь Kт − коэффициент теплопередачи между теплоносителем или хладагентом и реакционной массой, dF − поверхность теплообмена между теплоносителем или хладагентом и элементарным объёмом,ΔT − положительная разность температур между теплоносителем или хладагентом и реакционной массой, τ − элементарный промежуток времени).
При подстановке полученных выражений в уравнение теплового баланса РИВ получим:
Преобразуем выражение, сократив на элементарный промежуток времени τ, и предполагая, что плотность и теплоёмкость реакционной смеси слабо зависят от температуры (ρocpo ≈ ρcp):
Выразим из материального баланса РИВ скорость реакции WA:
Подставим это выражение в тепловой баланс и разделим все слагаемые на CAoVo:
Учитывая, что мольная теплоёмкость с ‘ p может быть рассчитана по формуле 
В случае адиабатического теплового режима, характеризующегося отсутствием теплообмена реакционной смеси с теплоносителем или хладагентом (тепловая изоляция реактора), тепловой баланс РИВ примет вид:

В случае изотермического теплового режима, характеризующегося постоянством температуры реакционной смеси, можно принять Qвх ≈ Qвых:

Расчёт изотермического РИВ
Расчёт изотермического РИВ сводится к нахождению его объёма из уравнения материального баланса. Объём проточного реактора может быть рассчитан по уравнению:
Среднее время пребывания частиц в реакторе рассчитывается по характеристическому уравнению РИВ:
Скорость реакции WA можно выразить через кинетическое уравнение:
(здесь k – константа скорости реакции, CA и CB – концентрации реагентов A и B, n и m – порядки реакции по компонентам A и B)
Для реакций, протекающих в газовой фазе с изменением объёма, текущая концентрация CA реагента A может быть рассчитана по уравнению:
(здесь NA – количество (в молях) реагента A в объёме выходящего из реактора за единицу времени потока реакционной массы, NAo – количество (в молях) реагента A в объёме входящего в реактор за единицу времени потока реакционной массы, V – объёмный расход реакционной смеси на выходе из реактора, εA – коэффициент, учитывающий изменение объёма в ходе реакции)
Коэффициент, учитывающий изменение объёма в ходе реакцииεA рассчитывается по формуле:
(здесь Δν – изменение количества моль газообразных реагентов в ходе реакции, nAo – объёмная доля реагента A в исходной смеси, a – стехиометрический коэффициент перед реагентом A в уравнении химической реакции)
При описании модельной газовой реакции вида 
Для реакций, протекающих в жидкой фазе, или в газовой фазе без изменения объёма, текущая концентрация CA реагента A может быть рассчитана по уравнению:
Для реакций, протекающих в газовой фазе с изменением объёма, текущая концентрация CB реагента B может быть рассчитана по уравнению:
(здесь NB – количество (в молях) реагента B в объёме выходящего из реактора за единицу времени потока реакционной массы, NBo – количество (в молях) реагента B в объёме входящего в реактор за единицу времени потока реакционной массы, V – объёмный расход реакционной смеси на выходе из реактора, a и b – стехиометрические коэффициенты перед реагентами A и B в уравнении химической реакции, εA – коэффициент, учитывающий изменение объёма в ходе реакции)
Для реакций, протекающих в жидкой фазе, или в газовой фазе без изменения объёма, текущая концентрация CB реагента B может быть рассчитана по уравнению:
После подстановки выражений для CA и CB в кинетическое уравнение получим:
Тогда среднее время пребывания частиц в реакторе рассчитывается по формуле:
Конечное выражение для расчёта объёма РИВ примет вид:
Материальный баланс
|
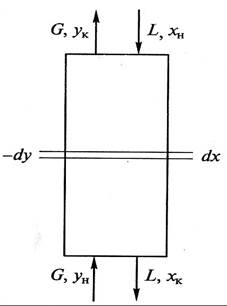
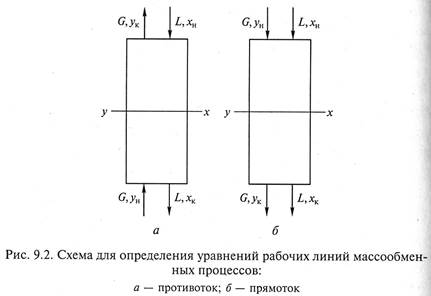
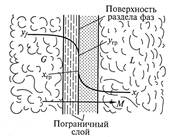
Рассмотрим массообменный процесс между фазами G и L в противоточном аппарате, схема которого представлена на рис. 9.1. Будем считать, что начальные хн, ун и конечные хк, ук массовые (мольные) концентрации распределяемого вещества в фазах G и L соответствуют его переходу из фазы G в фазу L. В этом случае на некотором малом участке произвольного сечения массоо6менного аппарата концентрация компонента М в фазе L увеличится на величину dх, а в фазе G уменьшится на величину dу (по ходу движения фазы).
Таким образом, переданное количество dМ распределяемого компонента можно записать как по одной, таки по другой распределяющим фазам:
Уравнение (9.2) является дифференциальным уравнением материального баланса массообменного процесса.
Для получения полного (интегрального) уравнения материального баланса проинтегрируем его в пределах изменения рабочих концентраций
Легко убедиться, что уравнение (9.3), так же как и (9.2), не зависит от направления движения взаимодействующих фаз, а характеризует только материальный баланс системы при массопередаче.
Важной характеристикой массоо6менных процессов являются уравнения рабочих линий, которые связывают между собой концентрации распределяемого компонента в распределяющих фазах во время осуществления процесса.
Различают два основных способа взаимодействия распределяющих фаз в процессе массообмена: противоток и прямоток.
1. Противоточная схема проведения процесса массопередачи (рис. 9.2, а).
Используя уравнение материального баланса (9.2), проинтегрируем его для верхней части аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии противоточного процесса массопередачи
которое является уравнением прямой с тангенсом угла наклона L/G. Второе слагаемое является постоянной величиной, Не меняющейся в случае интегрирования уравнения (9.2) в пределах концентраций в нижней части массообменного аппарата.
2. Прямоточная схема осуществления процесса массопередачи (рис. 9.2, б).
Интегрирование уравнения (9.2) произведем также для верхней части массообменного аппарата в указанных на схеме пределах:
В результате получаем уравнение рабочей линии прямоточного процесса массопередачи
Уравнение (9.5) также является уравнением прямой линии, однако угол наклона этой прямой противоположен углу наклона рабочей линии противоточного массообменного процесса, о чем указывает знак « — » перед значением тангенса угла (L/G) наклона прямой.
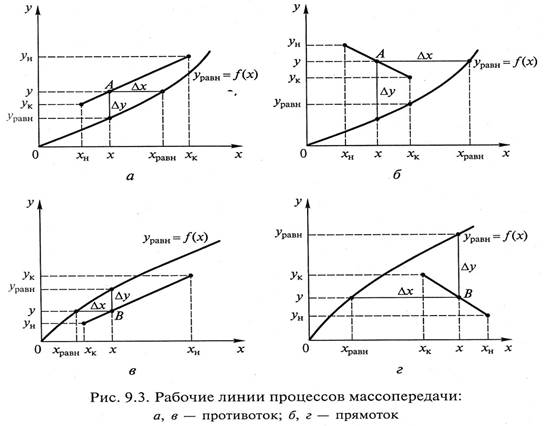
Изображения рабочих линий процесса массопередачи для противотока и прямотока представлены на рис. 9.3.
Движущая сила массоо6менного процесса определяется степенью отклонения системы от равновесия и может быть выражена разностью содержаний целевого компонента в рабочем и равновесном состояниях системы (Δу или Δх). Направление переноса
распределяемого вещества удобно определять на диаграмме у – х по расположению равновесной и рабочей линий.
Если рабочая линия расположена выше линии равновесия (рис. 9.3, а, б), то для любой точки, расположенной на этой линии (точка А), у > уравн и х хравн.
При таком процессе распределяемый компонент будет переходить из фазы L в фазу G, причем движущая сила в точке В, выраженная через концентрации соответствующих фаз, может быть записана как Δу = уравн – y и Δх = х – хравн.
Скорость массопередачи может быть выражена через количество вещества, переходящего в единицу времени из одной фазы в другую. В этом случае, в соответствии с (В. 3) можно записать основное уравнение массопередачи в дифференциальном
или интегральном (для стационарных процессов) виде
Скорость массопередачи связана с механизмом переноса распределяемого вещества в фазах, между которыми происходит массообмен.
Перенос вещества в фазах может происходить либо путем молекулярной диффузии, либо конвекцией и молекулярной диффузией одновременно (конвективная диффузия).
Массопередача молекулярной диффузией осуществляется в неподвижной среде вследствие движения молекул, атомов и ионов.
Массопередача конвективной диффузией реализуется в движущейся среде. При этом если движение жидкости обусловлено градиентами температуры или концентрацией, то такая конвекция называется свободной, или естественной. Если движение вызвано внешними силами, конвекция является вынужденной.
В случае турбулентного движения жидкости, сопровождающегося массопередачей, в ряде случаев рассматривают турбулентный механизм переноса вещества, при котором оно переносится беспорядочными турбулентными пульсациями потока. Такой механизм называется турбулентной диффузией.
Молекулярная диффузия описывается первым законом Фика, в соответствии с которым количество продиффундировавшего вещества dМ пропорционально градиенту концентрации в направлении диффузии дс/дп, площади массопередачи dF, перпендикулярной направлению диффузионного потока и времени осуществления процесса dτ,
где 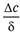
Коэффициент пропорциональности D в уравнениях (9.8) и (9.9) называется коэффициентом молекулярной диффузии и имеет размерность м 2 /с при с, кг/м 3 .
Коэффициент молекулярной диффузии показывает, какая масса вещества диффундирует в единицу времени через единицу поверхности при градиенте концентрации, равном единице. Значение коэффициента молекулярной диффузии зависит от природы и свойств как распределяемого вещества, таки среды, через которую он диффундирует, а также давления и температуры. Причем увеличению его значения способствует повышение температуры и уменьшение давления. Знак минус перед правой частью уравнения (9.8) указывает на то, что молекулярная диффузия протекает в направлении уменьшения концентрации распределяемого компонента.
В ряде случаев по аналогии с первым законом Фика, записывают уравнение, характеризующее массопередачу в результате турбулентной диффузии,
где Dтурб – коэффициент турбулентной диффузии, зависящий от гидродинамических условий протекания процесса — скорости потока и масштаба турбулентных пульсаций.
Конвективная диффузия характеризуется тем, что полный поток вещества складывается из конвективного и диффузионного потоков.
Поскольку конвективный перенос вещества осуществляется преимущественно потоками жидкости, его интенсивность учитывается компонентами скорости перемещения массы, диффузионная составляющая – коэффициентом молекулярной диффузии и суммой вторых производных концентраций по соответствующим координатам
Уравнение (9.10) является дифференциальным уравнением конвективной диффузии.
При массоо6мене в неподвижном слое проекции скорости на оси координат Wx = Wy = =Wz= 0, и уравнение (9.10) преобразуется в дифференциальное уравнение молекулярной диффузии (второй закон Фика)
Трудности теоретического описания и расчета процесса массопередачи обусловлены сложностью механизма переноса вещества к границе раздела фаз и от нее, недостаточной изученностью гидродинамических закономерностей турбулентных потоков, особенно вблизи границы раздела фаз.
|
В связи с этим предложен ряд теоретических моделей, в основу большинства которых положены допущения:
· общее сопротивление процессу массопередачи складывается из сопротивления распределяющих фаз. Сопротивлением поверхности разделав большинстве случаев можно пренебречь;
· на поверхности раздела фазы находятся в равновесии.
На рис. 9.4 представлена схема массопередачи между система ми жидкость – газ (пар) или жидкость — жидкость. Фазы разделены поверхностью раздела и движутся друг относительно друга с некоторой скоростью.
Процесс массопередачи заключается в переносе распределяемого вещества из фазы G к поверхности раздела фаз (процесс массоотдачи), а затем массоотдачи от поверхности раздела к фазе L.
Процесс массопередачи связан со структурой потока в каждой фазе, которая включает турбулентное ядро потока, где массоперенос осуществляется конвекцией и концентрация компонента практически постоянна. При приближении к поверхности раздела в пограничном слое происходит затухание пульсаций, преобладание механизма молекулярной диффузии, а следовательно, резкое уменьшение концентраций.
Для нахождения скорости перехода вещества из одной фазы к поверхности раздела фаз и далее от нее во вторую фазу используют уравнения массоотдачи, которые для схемы, представленной на рис. 9.4, можно записать как
где уf — угр и хгр — хf – движущие силы в процессах массоотдачи в фазах G и L; F – поверхность массопередачи; βy и βх – коэффициенты массоотдачи (β, м/с, при размерности единичной движу щей силы – кг/м 3 ).
Коэффициент массоотдачи показывает, какое количество вещества переходит из ядра потока к поверхности раздела (или наоборот) через единицу площади поверхности за единицу времени при движущей силе, равной единице, и зависит в первую очередь от гидродинамических условий.
Если равновесная линия массообменного процесса – прямая с тангенсом угла наклона Аравн, то между коэффициентами массопередачи Кy, Кх из уравнений (9.6) (9.7) и коэффициентами массоотдачи βy, βх из уравнений (9.11) (9.12) существует однозначная связь
Коэффициент массопередачи показывает, какое количество вещества переходит из одной фазы в другую за единицу времени через единицу площади поверхности контакта фаз при движущей силе массопередачи, равной единице. Размерность коэффициента массопередачи совпадает с размерностью коэффициента массоотдачи.
Поскольку величины, обратные значениям коэффициентов массопередачи, представляют собой общее сопротивление переносу вещества из фазы в фазу (В.3), то выражения в знаменателях уравнений (9.13) представляют сумму сопротивлении массоотдачи в фазах.
Для расчетов коэффициентов массоотдачи βх и βy чаще всего используют уравнения, которые получают на основании теории подобия.
Дата добавления: 2015-08-14 ; просмотров: 3503 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Материальный и тепловой балансы химического процесса (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНСЫ ХИМИЧЕСКОГО ПРОЦЕССА
Материальный и тепловой балансы химического процесса: составляются на основе законов сохранения массы и энергии.
Уравнения материального и теплового балансов служат основой расчета реакционного объема аппарата (при заданной степени превращения) или степени превращения в реакторе (при заданных условиях). При расчете чаще всего пользуются выражением общего баланса, составленного по одному из исходных веществ, участвующих в химическом процессе. Вид уравнения зависит от типа реактора, в котором протекает процесс химического превращения веществ. Материальный баланс представляет собой основу для вывода зависимости связи между степенью превращения, скоростью и временем химического процесса, которая является необходимым элементом его расчета и носит название характеристического уравнения реактора. Если химическое превращение вещества протекает в неизотермических условиях, тепловой баланс процесса следует рассматривать совместно с его материальным балансом.
1. Общий материальный баланс реакционной системы равен сумме материальных балансов по каждому из реагирующих веществ:
где М — общее количество реакционной смеси, кмоль; t — время реакции, с;. D Мобщ — изменение общего количества реакционной смеси, кмоль×с-1.
2. Общее уравнение материального баланса для i-ro вещества, участвующего в реакции:
где Mi — количество i-го вещества в системе, кмоль; DMi — изменение количества i-го вещества, кмоль×с-1; ri —скорость химической реакции, выраженная по i-му веществу, кмоль×м-3×с-1; V — реакционный объем, м3.
3. Уравнения материального баланса для различных типов. химических реакторов.
Периодически действующий реактор идеального смешения:
где Ci — концентрация i-го вещества в системе, кмоль×м-3.
Непрерывнодействующий реактор идеального смешения:

где 

Каскад n непрерывнодействующих реакторов идеального смешения:

.где ,- концентрация i-ro вещества в системе на выходе из п-го реактора, кмоль×м-3; rin —скорость реакции по i-му веществу в n-м реакторе, кмоль×м-3×с-1
Непрерывнодействующий реактор идеального вытеснения:
где S — площадь поперечного сечения потока реагирующей системы, м2; L — длина реактора, м.
Полунепрерывнодействующий реактор идеального смешения:
По i-му веществу для этого реактора имеем:
где 


4. Общий вид уравнения теплового баланса:
где U — внутренняя энергия реакционной системы, кДж-кмоль»1; / — энтальпия системы, кДж×кмоль-1; . — коэффициент теплопередачи, Вт(м2×К)-1; F — площадь поверхности теплопередачи, м2; Тр — температура реакции, К или °С; Тх—температура теплоносителя (хладоагента), К или °С; р — давление в системе, Па.
5. Уравнения теплового баланса для различных типов химических реакторов.
Периодически действующий реактор идеального смешения при V = const:
где сu — удельная теплоемкость смеси реагирующих веществ при постоянном объеме, кДж(кмоль×К)-1; DHr — тепловой эффект реакции, кДж×кмоль-1.
Непрерывнодействующий реактор идеального смешения с внешним теплообменом:

где u0 — объемная скорость подачи реагирующих веществ, м3×с-1; Со — начальная концентрация реагирующих веществ, кмоль×м-3; х — степень превращения; То—начальная температура реакционной смеси, К или °С; Т1 — конечная температура реакционной смеси, К или °С; ср — удельная теплоемкость смеси реагирующих веществ при постоянном давлении, кДж(кг×К)-1
Непрерывнодействующий реактор идеального вытеснения с внешним теплообменом при постоянных температуре и составе по поперечному сечению потока:
где S — площадь поперечного сечения, м2; Rr — гидравлический радиус, м..
Непрерывнодействующий реактор идеального смешения, работающий в автотермическом режиме:
Адиабатический yепрерывнодействующий реактор идеального вытеснения с теплообменом между реагентом и продуктами реакции (система теплообменник — реактор):
где 
u0rcp(T0—
где 

Непрерывнодействующий реактор идеального вытеснения с внутренним теплообменом между исходными веществами и реакционной смесью (при подогреве исходных веществ):
где Ti— температура реакционной смеси во внутреннем подогревателе, К или °С.
Пример 2-1. В реакторе идеального смешения происходят следующие реакции:
где D — целевой продукт реакции; СRа = CSo = СТo = CDo = 0 — начальные концентрации промежуточных и конечных продуктов.
Начальная концентрация исходного вещества СА = 1 кмоль × м-3; текущие концентрации веществ (в кмоль × м-3); СА = 0,44; Св=1,06; СR = 0,05; CS = 0,33; СT = 0,14. Скорость подачи исходных веществ u0 = 5 × 10-3 м3 × с-1.
Определить производительность реактора GB по веществу В:
Решение. Составляем материальный баланс для реактора смешения. На основании стехиометрических соотношений реакций (а) и (г); (а) и (б); (а), (б), (в) и (г); (г) запишем:
CBo-CB = (3/2)CT + 2C’R+ C’S + CD, (3)
Комбинируя уравнения (1), (2), (4) и (5), а также (2) — (5), получаем:
CAo-CA = CR + CS + CD, (6)
CBo-CB=(3/2)CT + 2CR + 3CS-2CD. (7)
Из уравнения (6) определяем концентрацию продукта D:
CD = 1 — (0,44 + 0,05 + 0,33) = 0,18 кмоль × м-3.
Тогда производительность по продукту D будет равна:
Из уравнения (7) определяем концентрацию исходного вещества В
СВо= (3/2) 0,14 + 2 × 0,05 — 2 × 0,18+ 1,06 = 2 кмоль × м-3,
а затем производительность по веществу В:
Пример 2-2. В реакторе идеального смешения, работающем в адиабатических условиях, происходят реакции:
2R®S, (в)
где R — продукт реакции.
Начальные концентрации исходных веществ и продуктов (в кмоль × м-3): САо = 0,1; СВо=0,3; CRo = CDa = СРо =CSo = 0. Текущие концентрации взаимодействующих веществ (в кмоль х м-3): СА = 0,016; СР = 0,028; CS = 0,012; CD = 0,034.
Тепловой эффект реакции —DНr= 1,5 × 108 Дж (кмоль × В) -1. Плотность смеси r = 860 кг× м-3, теплоемкость смеси ср = = 2,85 × 103 Дж(кг×К)-1, скорость подачи u0 = 2,6×10-2×м3 ×с-1.
Определить производительность реактора по продукту R и температуру на выходе реактора, если начальная температура 12 °С (285 К).
Решение. Составляем уравнения материального и теплового баланса. Из стехиометрических соотношений уравнений реакции (а), (б) и (в) следует:
Тогда из уравнений (1) и (3) получим:
= 0,026 кмоль • м -3.
Из уравнений (2) и (3) находим:
СB = СВо — (СAо — СA) — 2СР = 0,30 — (0,1 —0,016) —2 • 0,028 =
= 0,160 кмоль • м -3.
Таким образом, производительность реактора по продукту R:
GR = CRu0 = 0,026 • 2,6 •10 -2 = 6,76•10 -4 кмоль • с -1.
где QP = (—DНr) (CBo —CB) u0 — тепловой поток, который выделяется в результате реакций; QH = cppu0 DT— тепловой поток, который затрачивается на нагревание реакционной смеси при адиабатических условиях работы реактора идеального смешения.
Из уравнения (4) после преобразования получаем:
Следовательно, температура на выходе из реактора равна 285 + 8,6 = 393,6 К или 20,6 °С.
Пример 2-3. В реакторе идеального вытеснения, работающем т адиабатических условиях, происходит жидкофазная реакция первого порядка
Константа скорости реакции kA (в с -1):
Начальные концентрации веществ (в кмоль×м-3): СAо=4,5; СB = 0. Тепловой эффект реакции—DHr=2×107 Дж(кмоль×А)-1, теплоемкость реакционной смеси ср:=2,2×103 Дж(кг×К)-1, плотность реакционной смеси r = 850 кг×м-3, температура исходной смеси Т0 = 300 К, скорость подачи uо= 10-3 м3 × с-1, объем реактора V = 5 м3.
Определить производительность реактора по продукту В и температуру смеси на выходе.
Решение. Тепловой баланс:
где QP = (—DHr) (СAо—CA) uо — тепловой поток, который выделяется в результате реакции; QH = срruо (Tк — Т0) — тепловой поток, который затрачивается на нагревание исходных веществ и продуктов реакции; Тк — температура реакционной смеси на выходе из реактора; Т0 — температура исходной смеси, подаваемой в реактор.
Характеристическое уравнение для необратимой реакции первого порядка, протекающей в реакторе идеального вытеснения:

Так как процесс протекает при адиабатических условиях, константа скорости реакции будет изменяться по ходу реакции. Используем метод конечных разностей:

где ki = 1013ехр(—1,2-104 Ti-1).
Для определения концентрации вещества А на выходе из реактора проводим последовательные приближения по Ti при шаге DT = 2 К. Тогда из уравнения материального баланса
определяем для каждого значения Тi соответствующее значение 


Тогда производительность реактора по продукту В:
= 1/2 (4,500 — 0,386) •= 2,06 •кмоль • с.
Пример 2-4. Установка состоит из следующих последовательно соединенных реакторов: идеального смешения (V1 = 2 м3), идеального вытеснения (V2 = 2 м3) и идеального смешения (V3 = 3 м3). Начальная концентрация вещества САo = = 1 кмоль • м -3, скорость подачи uо = 5×10-2 м3×с-1, скорость реакции (-rA) =5,1 • 10-3CA0,28. В начальный момент времени продукт в системе отсутствует. Плотность реакционной смеси не меняется.
Определить концентрацию исходного вещества после каждого реактора и рассчитать графически производительность установки по продукту, если известно, что 1 моль исходного вещества дает 2 моль продукта.
Решение. Составляем материальный баланс по веществу А для 1-го реактора смешения:
Для нахождения времени пребывания в реакторе идеального вытеснения интегрируем кинетическое уравнение:

Составляем материальный баланс по веществу А для 2-го реактора смешения:

http://helpiks.org/4-91319.html
http://pandia.ru/text/78/161/9489.php