Материальный и тепловой балансы химико-технологических процессов
Материальный и тепловой балансы составляют для анализа работы существующего аппарата, установки, производства или при проектировании нового. Материальный баланс технологического процесса или части его составляют на основании закона сохранения массы вещества, и это означает, что масса веществ, поступающих на технологическую операцию, равна массе полученных веществ.
Расчеты балансов основываются на технико-экономических показателях, рассмотренных в разделе 1. Для процессов, которые можно описать суммарной химической реакцией, материальный баланс складывается их двух частей: левая часть уравнения – приход, правая часть уравнения – расход. Материальный баланс рассчитывается или только по уравнению основной суммарной реакции (упрощенный) или с учетом всех параллельных, побочных реакций и продуктов (полный). Уравнение материального баланса:
где Σmприх – суммарная масса исходных веществ процесса цикла;
Σmрасх – суммарная масса конечных продуктов процесса.
Материальный баланс обычно рассчитывается на единицу полученного продукта (кг, т, м 3 ) или в % на основе данных производства.. Результаты сводят в таблицу. Материальный баланс служит основой для составления теплового и экономического балансов и поэтому составляется первым. В результате составления материального баланса можно вычислять практические расходные коэффициенты на сырье.
Тепловой (энергетический) баланс технологического процесса или части его составляют на основе закона сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна, т.е. приход теплоты должен быть равен расходу его в данном процессе, аппарате, операции. Уравнение теплового баланса:
где Qприх – сумма теплот Q1,Q2, Q3,; Q1 – теплота, приносимая входящими в аппарат веществами; Q2,- теплота экзотермических реакций, протекающих в данном аппарате; Q3 – теплота, вносимая извне за счет подогрева; ΣQрасх – сумма теплот Q4,Q5, Q6,; Q4 – теплота, уносимая выходящими из аппарата продуктами; Q5 – теплота эндотермических реакций,протекающих в аппарате; Q6 – потери теплоты в окружающую среду и отвод ее через холодильники, помещенные внутри аппарата Уравнение теплового баланса:
Q1 и Q4 в технологии называют теплосодержанием материалов и рассчитывают для каждого вещества, поступающего в аппарат и выходящего из него:
где m – масса вещества (кг, моль) (берут из данных материального баланса); с – средняя теплоемкость этого вещества (берут из справочника); t – температура, отсчитанная от какой-либо точки (обычно 273К).
Тепловые эффекты химических реакций Q2 и Q5 могут быть рассчитаны на основе изобарных теплот образования из элементов различных веществ q 0 обр, или теплот сгорания, или энтальпии образования веществ ΔН298 в стандартных условиях (для массы 1 моль, давление 1.01 –10 5 Па, температуры 298К). Изменение энтальпии реакции ΔН численно равно тепловому эффекту реакции, взятому с обратным знаком:
Изменение энтальпии реакции находим как разность энтальпии продуктов реакции и исходных веществ:
Значение ΔНобр приведено в справочниках термохимических и термодинамических величин.
Подвод теплоты Q3 можно рассчитать по потере ее теплоносителем. Потери теплоты Q6 можно рассчитать по изменению теплоты хладоагента или в процентах к массе внесенной теплоты.
Совместное решение материального и теплового
балансов для стационарного адиабатического реактора РИС–Н
Математическая модель адиабатического реактора РИС-Н
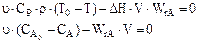
Система уравнений материального и теплового балансов представляет собой математическую модель реактора.
Определим значения степени превращения XА и температуры Т, достигаемые в реакторе. Естественно, что частные значения будут зависеть от конкретного вида кинетического уравнения. Скорость химической реакции зависит от концентрации CA и температуры T.
Рассмотрим самые простые варианты:
– необратимую реакцию первого порядка А 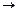
– обратимую реакцию первого порядка А 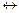
Предварительно преобразуем математическую модель реактора.
Ранее (см. раздел 2) получено:

Уберем скорость химической реакции из уравнения теплового баланса (13.17). Представим произведение скорости химической реакции на объем, как
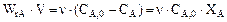
Тогда уравнение теплового баланса будет:
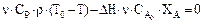

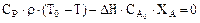

Для необратимой реакции первого порядка скорость химической реакции
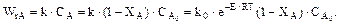
Подставив значение скорости химической реакции в математическую модель реактора (13.21), получим систему уравнений:
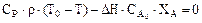
Аналитическое решение системы уравнений (13.23) затруднено, т.к. температура Т входит в уравнения в виде линейного члена и в составе комплекса. Для решения используем численные методы, т.к. уравнения являются трансцендентными.
Решим систему графическим методом.
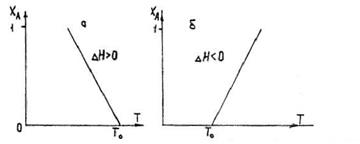
Уравнение теплового баланса (13.23) преобразуем и получим:
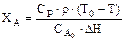
В координатах XA-Т это уравнение прямой линии, где отрезок, отсекаемый на оси абсцисс – начальная температура Т0. Наклон линии будет определять значение изменения энтальпии 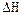
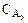
Рисунок 13.1 – Уравнение теплового баланса
реактора идеального смешения для эндотермических (а)
и экзотермических реакций (б)
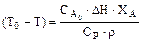
Принимаем, что степень превращения XA = 1, следовательно,

Величина ΔТадиаб. показывает максимальное изменение температуры реакционной смеси, возможное в адиабатических условиях

Для необратимой простой реакции

Решение системы уравнений материального и теплового балансов имеет различный вид для экзо- и эндотермических реакций (рисунки 13.2, 13.3).
Для эндотермической реакции возможно только одно решение, в то время как для экзотермической реакции, в зависимости от начальных температур Т01,Т02,Т03, возможно от одного до трех решений.
Если обратимая простая реакция, то
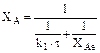
Для обратимой реакции степень превращения ХА фактически будет находиться ниже равновесной кривой, следовательно, для эндотермической реакции одно решение, а для экзотермической в зависимости от начальной температуры Т0, будет от одного до трех решений (рисунки 13.4, 13.5).
Материальный и тепловой балансы химического процесса (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
МАТЕРИАЛЬНЫЙ И ТЕПЛОВОЙ БАЛАНСЫ ХИМИЧЕСКОГО ПРОЦЕССА
Материальный и тепловой балансы химического процесса: составляются на основе законов сохранения массы и энергии.
Уравнения материального и теплового балансов служат основой расчета реакционного объема аппарата (при заданной степени превращения) или степени превращения в реакторе (при заданных условиях). При расчете чаще всего пользуются выражением общего баланса, составленного по одному из исходных веществ, участвующих в химическом процессе. Вид уравнения зависит от типа реактора, в котором протекает процесс химического превращения веществ. Материальный баланс представляет собой основу для вывода зависимости связи между степенью превращения, скоростью и временем химического процесса, которая является необходимым элементом его расчета и носит название характеристического уравнения реактора. Если химическое превращение вещества протекает в неизотермических условиях, тепловой баланс процесса следует рассматривать совместно с его материальным балансом.
1. Общий материальный баланс реакционной системы равен сумме материальных балансов по каждому из реагирующих веществ:
где М — общее количество реакционной смеси, кмоль; t — время реакции, с;. D Мобщ — изменение общего количества реакционной смеси, кмоль×с-1.
2. Общее уравнение материального баланса для i-ro вещества, участвующего в реакции:
где Mi — количество i-го вещества в системе, кмоль; DMi — изменение количества i-го вещества, кмоль×с-1; ri —скорость химической реакции, выраженная по i-му веществу, кмоль×м-3×с-1; V — реакционный объем, м3.
3. Уравнения материального баланса для различных типов. химических реакторов.
Периодически действующий реактор идеального смешения:
где Ci — концентрация i-го вещества в системе, кмоль×м-3.
Непрерывнодействующий реактор идеального смешения:

где 

Каскад n непрерывнодействующих реакторов идеального смешения:

.где ,- концентрация i-ro вещества в системе на выходе из п-го реактора, кмоль×м-3; rin —скорость реакции по i-му веществу в n-м реакторе, кмоль×м-3×с-1
Непрерывнодействующий реактор идеального вытеснения:
где S — площадь поперечного сечения потока реагирующей системы, м2; L — длина реактора, м.
Полунепрерывнодействующий реактор идеального смешения:
По i-му веществу для этого реактора имеем:
где 


4. Общий вид уравнения теплового баланса:
где U — внутренняя энергия реакционной системы, кДж-кмоль»1; / — энтальпия системы, кДж×кмоль-1; . — коэффициент теплопередачи, Вт(м2×К)-1; F — площадь поверхности теплопередачи, м2; Тр — температура реакции, К или °С; Тх—температура теплоносителя (хладоагента), К или °С; р — давление в системе, Па.
5. Уравнения теплового баланса для различных типов химических реакторов.
Периодически действующий реактор идеального смешения при V = const:
где сu — удельная теплоемкость смеси реагирующих веществ при постоянном объеме, кДж(кмоль×К)-1; DHr — тепловой эффект реакции, кДж×кмоль-1.
Непрерывнодействующий реактор идеального смешения с внешним теплообменом:

где u0 — объемная скорость подачи реагирующих веществ, м3×с-1; Со — начальная концентрация реагирующих веществ, кмоль×м-3; х — степень превращения; То—начальная температура реакционной смеси, К или °С; Т1 — конечная температура реакционной смеси, К или °С; ср — удельная теплоемкость смеси реагирующих веществ при постоянном давлении, кДж(кг×К)-1
Непрерывнодействующий реактор идеального вытеснения с внешним теплообменом при постоянных температуре и составе по поперечному сечению потока:
где S — площадь поперечного сечения, м2; Rr — гидравлический радиус, м..
Непрерывнодействующий реактор идеального смешения, работающий в автотермическом режиме:
Адиабатический yепрерывнодействующий реактор идеального вытеснения с теплообменом между реагентом и продуктами реакции (система теплообменник — реактор):
где 
u0rcp(T0—
где 

Непрерывнодействующий реактор идеального вытеснения с внутренним теплообменом между исходными веществами и реакционной смесью (при подогреве исходных веществ):
где Ti— температура реакционной смеси во внутреннем подогревателе, К или °С.
Пример 2-1. В реакторе идеального смешения происходят следующие реакции:
где D — целевой продукт реакции; СRа = CSo = СТo = CDo = 0 — начальные концентрации промежуточных и конечных продуктов.
Начальная концентрация исходного вещества СА = 1 кмоль × м-3; текущие концентрации веществ (в кмоль × м-3); СА = 0,44; Св=1,06; СR = 0,05; CS = 0,33; СT = 0,14. Скорость подачи исходных веществ u0 = 5 × 10-3 м3 × с-1.
Определить производительность реактора GB по веществу В:
Решение. Составляем материальный баланс для реактора смешения. На основании стехиометрических соотношений реакций (а) и (г); (а) и (б); (а), (б), (в) и (г); (г) запишем:
CBo-CB = (3/2)CT + 2C’R+ C’S + CD, (3)
Комбинируя уравнения (1), (2), (4) и (5), а также (2) — (5), получаем:
CAo-CA = CR + CS + CD, (6)
CBo-CB=(3/2)CT + 2CR + 3CS-2CD. (7)
Из уравнения (6) определяем концентрацию продукта D:
CD = 1 — (0,44 + 0,05 + 0,33) = 0,18 кмоль × м-3.
Тогда производительность по продукту D будет равна:
Из уравнения (7) определяем концентрацию исходного вещества В
СВо= (3/2) 0,14 + 2 × 0,05 — 2 × 0,18+ 1,06 = 2 кмоль × м-3,
а затем производительность по веществу В:
Пример 2-2. В реакторе идеального смешения, работающем в адиабатических условиях, происходят реакции:
2R®S, (в)
где R — продукт реакции.
Начальные концентрации исходных веществ и продуктов (в кмоль × м-3): САо = 0,1; СВо=0,3; CRo = CDa = СРо =CSo = 0. Текущие концентрации взаимодействующих веществ (в кмоль х м-3): СА = 0,016; СР = 0,028; CS = 0,012; CD = 0,034.
Тепловой эффект реакции —DНr= 1,5 × 108 Дж (кмоль × В) -1. Плотность смеси r = 860 кг× м-3, теплоемкость смеси ср = = 2,85 × 103 Дж(кг×К)-1, скорость подачи u0 = 2,6×10-2×м3 ×с-1.
Определить производительность реактора по продукту R и температуру на выходе реактора, если начальная температура 12 °С (285 К).
Решение. Составляем уравнения материального и теплового баланса. Из стехиометрических соотношений уравнений реакции (а), (б) и (в) следует:
Тогда из уравнений (1) и (3) получим:
= 0,026 кмоль • м -3.
Из уравнений (2) и (3) находим:
СB = СВо — (СAо — СA) — 2СР = 0,30 — (0,1 —0,016) —2 • 0,028 =
= 0,160 кмоль • м -3.
Таким образом, производительность реактора по продукту R:
GR = CRu0 = 0,026 • 2,6 •10 -2 = 6,76•10 -4 кмоль • с -1.
где QP = (—DНr) (CBo —CB) u0 — тепловой поток, который выделяется в результате реакций; QH = cppu0 DT— тепловой поток, который затрачивается на нагревание реакционной смеси при адиабатических условиях работы реактора идеального смешения.
Из уравнения (4) после преобразования получаем:
Следовательно, температура на выходе из реактора равна 285 + 8,6 = 393,6 К или 20,6 °С.
Пример 2-3. В реакторе идеального вытеснения, работающем т адиабатических условиях, происходит жидкофазная реакция первого порядка
Константа скорости реакции kA (в с -1):
Начальные концентрации веществ (в кмоль×м-3): СAо=4,5; СB = 0. Тепловой эффект реакции—DHr=2×107 Дж(кмоль×А)-1, теплоемкость реакционной смеси ср:=2,2×103 Дж(кг×К)-1, плотность реакционной смеси r = 850 кг×м-3, температура исходной смеси Т0 = 300 К, скорость подачи uо= 10-3 м3 × с-1, объем реактора V = 5 м3.
Определить производительность реактора по продукту В и температуру смеси на выходе.
Решение. Тепловой баланс:
где QP = (—DHr) (СAо—CA) uо — тепловой поток, который выделяется в результате реакции; QH = срruо (Tк — Т0) — тепловой поток, который затрачивается на нагревание исходных веществ и продуктов реакции; Тк — температура реакционной смеси на выходе из реактора; Т0 — температура исходной смеси, подаваемой в реактор.
Характеристическое уравнение для необратимой реакции первого порядка, протекающей в реакторе идеального вытеснения:

Так как процесс протекает при адиабатических условиях, константа скорости реакции будет изменяться по ходу реакции. Используем метод конечных разностей:

где ki = 1013ехр(—1,2-104 Ti-1).
Для определения концентрации вещества А на выходе из реактора проводим последовательные приближения по Ti при шаге DT = 2 К. Тогда из уравнения материального баланса
определяем для каждого значения Тi соответствующее значение 


Тогда производительность реактора по продукту В:
= 1/2 (4,500 — 0,386) •= 2,06 •кмоль • с.
Пример 2-4. Установка состоит из следующих последовательно соединенных реакторов: идеального смешения (V1 = 2 м3), идеального вытеснения (V2 = 2 м3) и идеального смешения (V3 = 3 м3). Начальная концентрация вещества САo = = 1 кмоль • м -3, скорость подачи uо = 5×10-2 м3×с-1, скорость реакции (-rA) =5,1 • 10-3CA0,28. В начальный момент времени продукт в системе отсутствует. Плотность реакционной смеси не меняется.
Определить концентрацию исходного вещества после каждого реактора и рассчитать графически производительность установки по продукту, если известно, что 1 моль исходного вещества дает 2 моль продукта.
Решение. Составляем материальный баланс по веществу А для 1-го реактора смешения:
Для нахождения времени пребывания в реакторе идеального вытеснения интегрируем кинетическое уравнение:

Составляем материальный баланс по веществу А для 2-го реактора смешения:

http://helpiks.org/3-90373.html
http://pandia.ru/text/78/161/9489.php