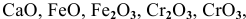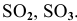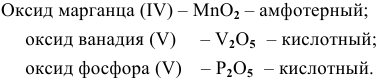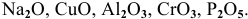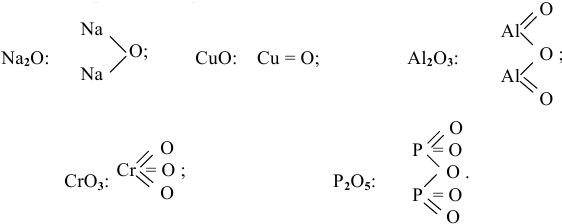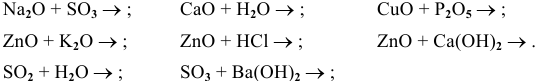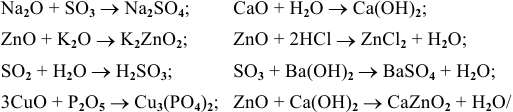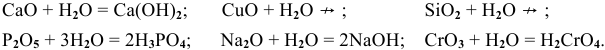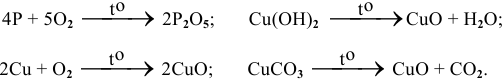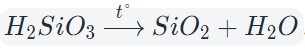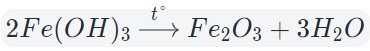Задачи с решениями по оксидам
Типовые задачи с решениями по оксидам
Задача 1
Назвать следующие оксиды:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 2
Найти эмпирические формулы следующих оксидов: оксид марганца (IV), оксид ванадия (V), оксид фосфора (V). К какой группе оксидов относится каждый из них?
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 3
Привести графические формулы следующих оксидов:
Решение:
Графическая формула показывает порядок, в котором атомы соединены в молекуле. В графической формуле единица химической связи (валентности) изображается черточкой:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 4
К каким типам относятся следующие оксиды: 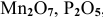
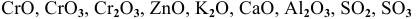
Решение:
К основным оксидам относятся оксиды металлов с ярко выраженными металлическими свойствами, проявляющими низкие валентности, в основном I и II:
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. Обычно эти металлы находятся в каждом периоде на границе между неметаллами и металлами с ярко выраженными металлическими свойствами:
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов, проявляющих высокие валентности, в основном V, VI, VII: 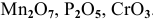
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 5
Составить уравнения следующих химических реакций:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 6
Какие из перечисленных оксидов будут взаимодействовать с водой: 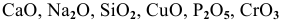
Решение:
С водой взаимодействуют кислотные оксиды, за исключением 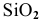
оксид щелочного или щелочно-земельного металла + 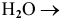
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 7
Какие из оксидов будут реагировать попарно: 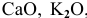
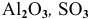
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 8
Как можно получить следующие оксиды: 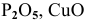
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Задания для закрепления темы. «Оксиды».
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Учитель химии высшей категории Гребенюк Татьяна Николаевна.
ГБОУ СОШ №626 г. Москва. Задания для 8 класса по теме. «Оксиды»
1. Даны формулы веществ: Cu, AI 2 O 3 , CO 2 , BaSO 4 ,CI 2 O 7 , MgO, NaNO 3 , HCI, H 2 SO 3 , O 2 , CaO, HNO 3 , N 2 O 5 , AgCI 3 , Fe. Выпишите формулы основных и кислотных оксидов. Дайте названия оксидам.
2. Определите валентность атомов химических элементов по формулам их оксидов: SO 2 , AI 2 O 3 , NO, Cu 2 O, NO 2 , Na 2 O.
3. Составьте формулы оксидов по их названиям: а) Оксид алюминия, б) оксид серы(VI), в) оксид железа (III), г) оксид азота (IV), д) оксид натрия, е) оксид фосфора (V), з) оксид кальция.
4. Назовите оксиды по их формулам: А) FeO , б) SO 2 , в) BaO , г) NO 2 , д) K 2 O , е) Cu 2 O .
5. Закончите уравнения химических реакций (сера в уравнении 4) проявляет валентность IV ) , расставьте коэффициенты, назовите продукты: 1) P + O 2 → ? 2) AI + O 2 → ? 3) C + O 2 → ? 4) S + O 2 → ? 5) Zn + O 2 →?
6.Закончите уравнения реакций, дайте названия продуктам реакций:
1) Na 2 O + H 2 O → 2) SO 2 + H 2 O → 3) SO 3 + H 2 O →
4) CaO + CO 2 → 5) CaO + P 2 O 5 → 6) K 2 O + SO 3 →
7) Na2O + SO3 → 8) K2O + SO2→ 9) CaO + SO3 →
10) CuO + HCl → 11) Na 2 O + H 3 PO 4 → 12) K 2 O + H 2 SO 3 →
13) ZnO + HCl→ 14) MgO + HCl → 15) BaO + H2SO4 →
16) Na 2 O + H 2 CO 3 → 18) P 2 O 5 + NaOH → 19) CO 2 + KOH
20) SO 2 + NaOH → 21) KOH + SO 3 →
Определите тип химической реакции.
Краткое описание документа:
Тема «Оксиды» является важной темой при изучении химии в 8 классе. При изучении этой темы очень важно научить составлять формулы по валентности и степеням окисления, уметь классифицировать оксиды, давать названия. используя номенклатуру оксидов. Научить писать уравнения по химическим свойствам оксидов расставлять коэффициенты, используя правило по расстановке коэффициентов. Учащиеся должны уметь определять тип химических реакций. Поэтому эти задания могут использоваться для закрепления темы оксиды или как самостоятельная работа для проверки знаний по теме.
Оксиды
О чем эта статья:
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
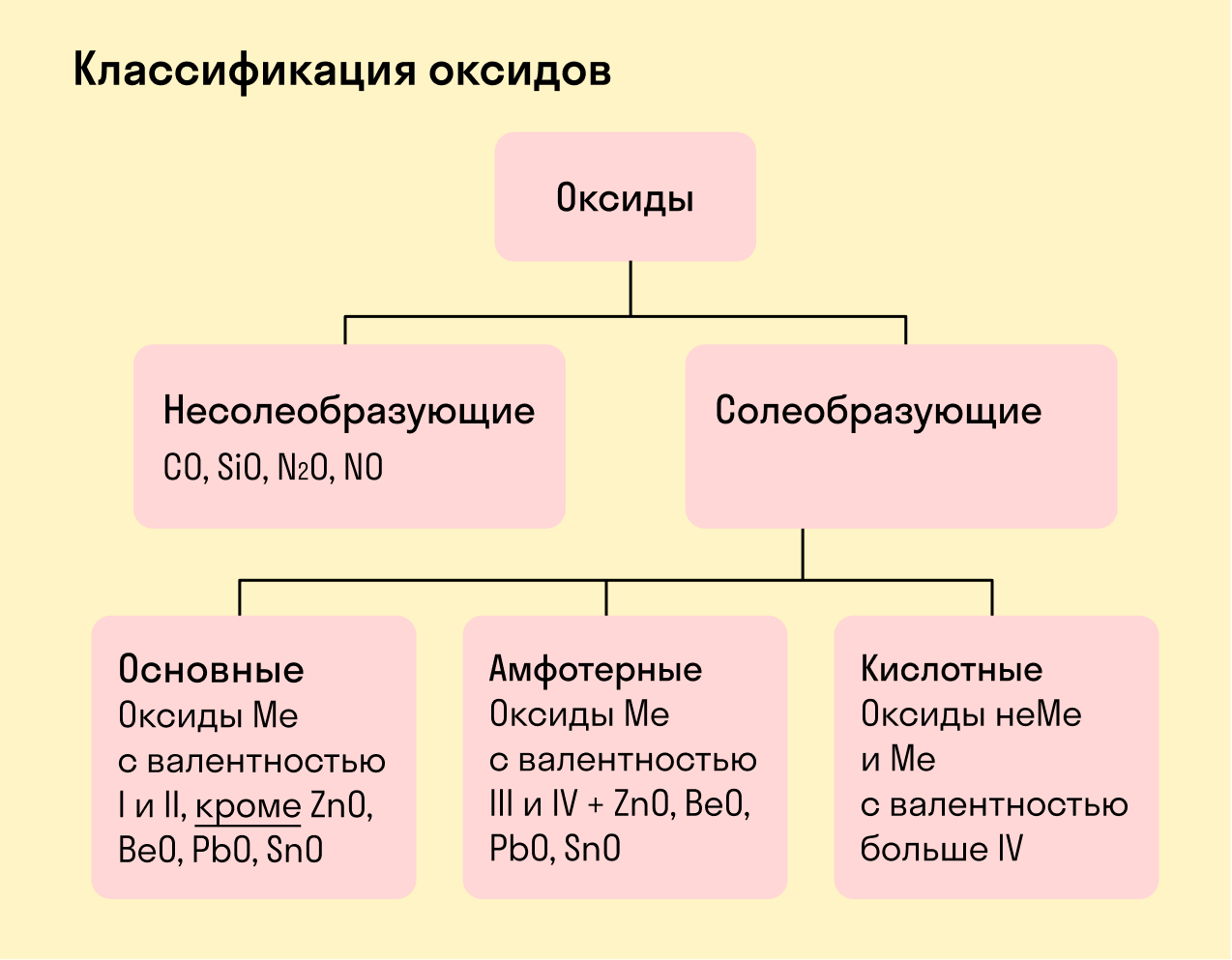
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
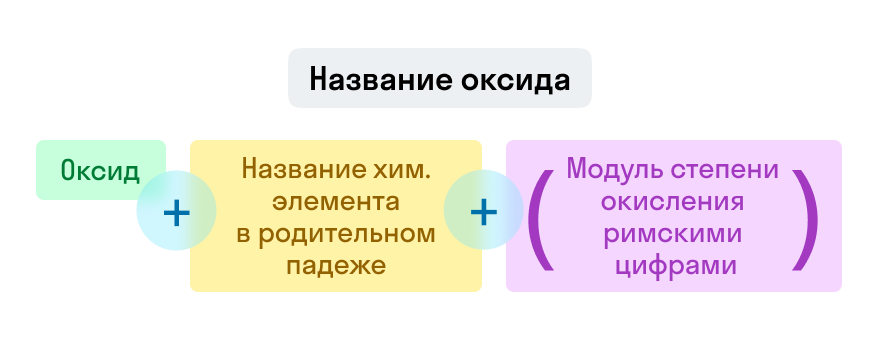
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
http://infourok.ru/material.html?mid=113459
http://skysmart.ru/articles/chemistry/oksidy