Урок химии по теме «Степень окисления». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: усвоение новых знаний.
Цели урока:
1. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентные полярные) состоят из ионов.
2. С.О. положительная “+” и отрицательная “-” ставится над знаками элементов перед цифрами, в том числе и единицей.
ПРАВИЛА:
- Степень окисления свободных атомов и простых веществ равна 0: (
; Mg 0 )
- Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH -1 , H +1 Cl).
- Степень окисления фтора в соединениях всегда равна -1: (HF -1 , CaF -1 2).
- Степень окисления кислорода в соединениях равна -2 (NO -2 , Al2O -2 3), а в пероксидах -1 (H2O -1 2, O +1 F2)
- Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
- Суммарная степень окисления всех атомов в молекуле равна 0.
- Высшая степень окисления элемента равна (+№ группы).
- Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
- Элементы в высшей степени окисления могут только принимать электроны
- Элементы в низшей степени окисления могут только отдавать электроны
- Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны.
ЗАДАНИЕ:
постоянная
(указывается в скобках римской цифрой)
элементы I-А, II-А, III-А– группы
все остальные
Бинарные соединения (“би” – два) – состоят из двух химических элементов.
В соединениях на первом месте пишется элемент (или частица) с положительной степенью окисления, а на втором — с отрицательной с.о.
Алгоритм определения степеней окисления по формуле:
Расставить степени окисления в соединениях: Na; K2O; Fe; CaCO3; AlCl3; Li3N; BaSO4; Zn; H2CO3; O3; OF2; CuSO4; NaOH; O2; SO3; KH; KOH; BaH2; H2O; NH3.
НАЗВАНИЯ БИНАРНЫХ СОЕДИНЕНИЙ:
| латинское название элемента с отрицательной степенью окисления (“-”) + суффикс -ид | русское название элемента с положительной степенью окисления (“+”) в родительном падеже | (римская цифра переменной степени окисления) |
Пример: Al +3 2O -2 3 – оксид алюминия; Cu +2 O -2 – оксид меди (II)
Cl -1 – хлорид; O -2 – оксид; Н -1 – гидрид; S -2 – сульфид; C -4 – карбид; N -3 – нитрид; P -3 — фосфид; Si -4 — силицид.
Алгоритм составления формул по названиям:
Составить формулы веществ по названиям:
- хлорид кальция
- оксид железа (III)
- оксид азота (V)
- хлорид серы (IV)
- сульфид хрома (VI)
- гидрид магния
- карбид алюминия
Степень окисления элемента
О чем эта статья:
Что такое степень окисления
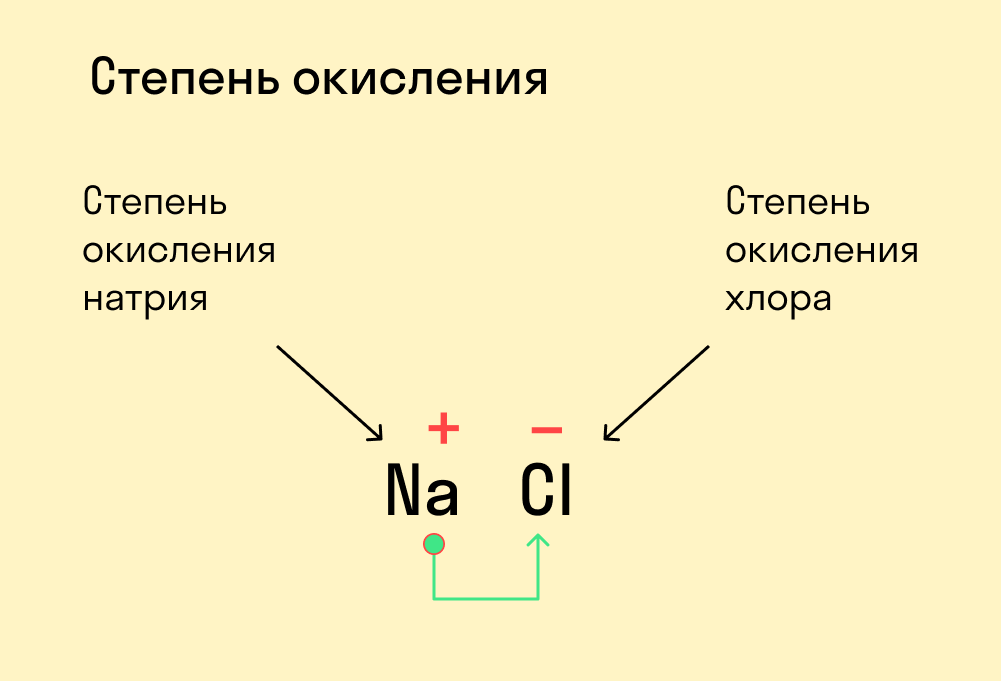
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
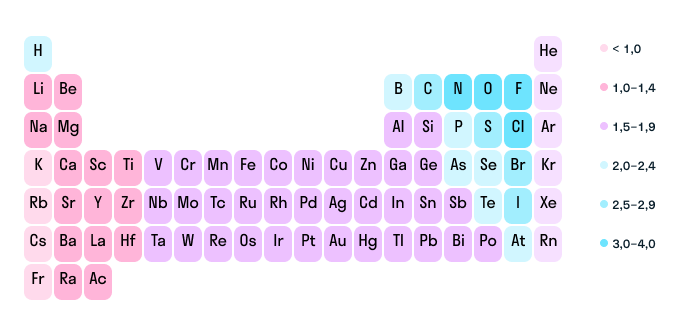
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
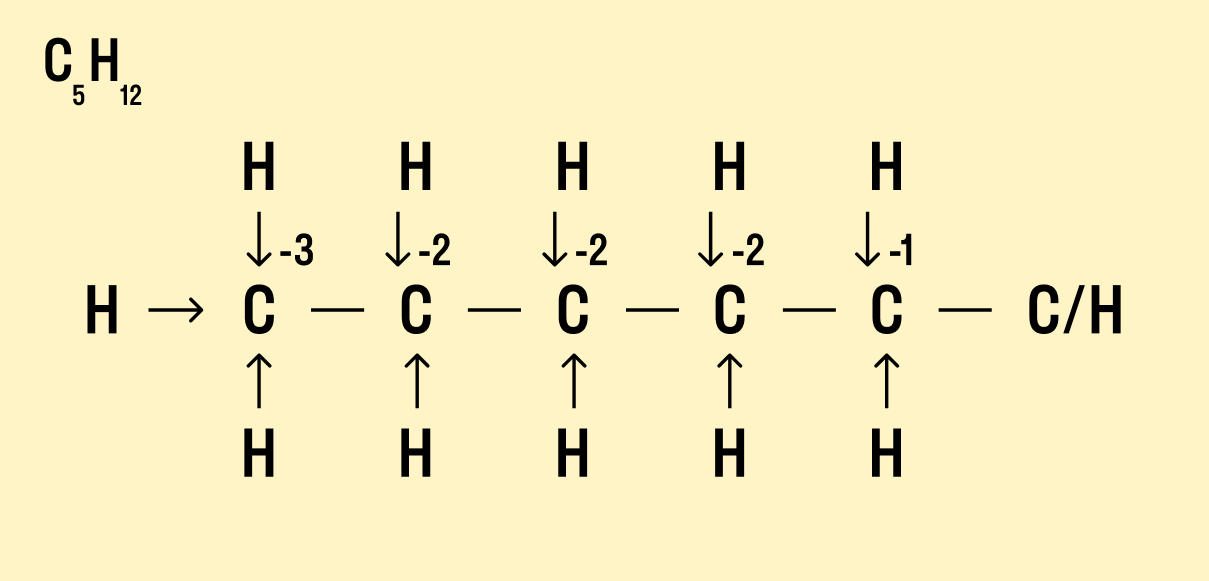
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
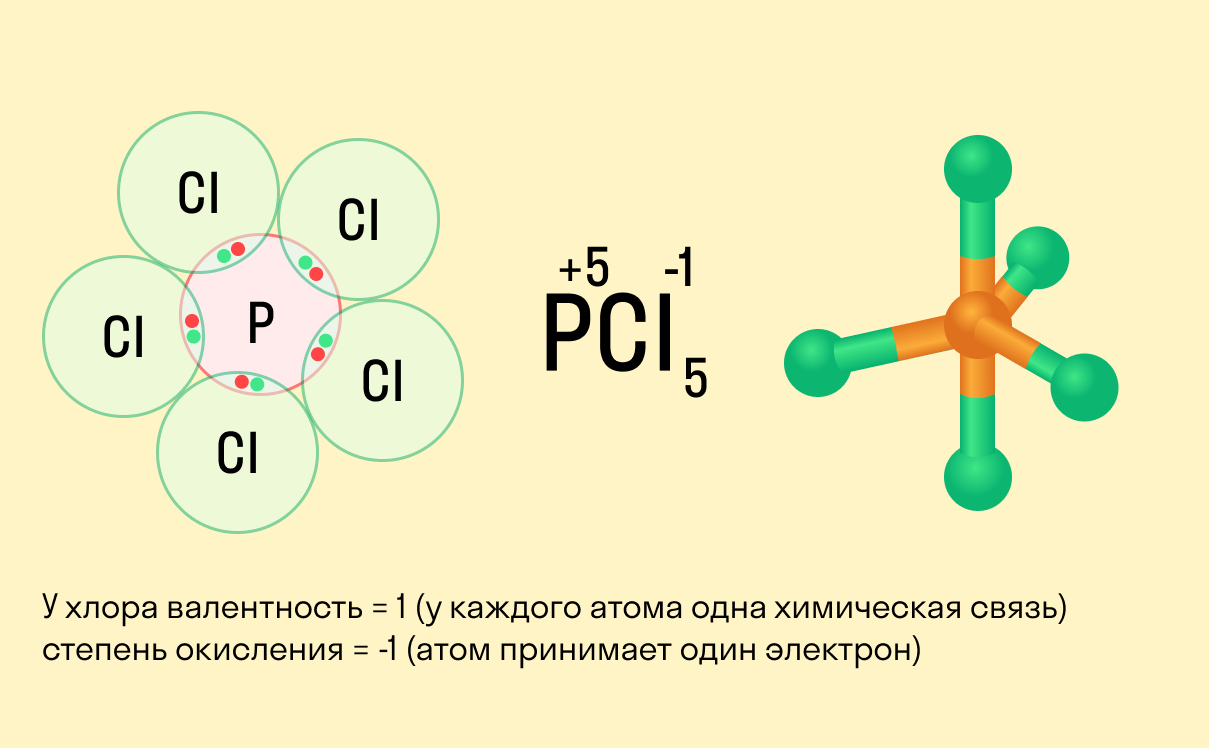
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Пособие–памятка по теме: «Степень окисления. Окислительно-восстановительные реакции» (8-9 класс).
методическая разработка по химии (8 класс) по теме
Пособие – памятка («шпаргалка») по теме: «Степень окисления. Окислительно-восстановительные реакции» может быть предложено учащимся 8 — 9 классов при изучении соответствующей темы и практическом применении знаний. Содержит краткие теоретические сведения, примеры расчетов степеней окисления, алгоритм расстановки коэффициентов в уравнении окислительно–восстановительной реакции методом электронного баланса и образцы записей в тетради. Уровень базовый.
Скачать:
| Вложение | Размер |
|---|---|
| posobie_po_teme_stepen_okisleniya.okislitelno-vosstanovitelnye_reakcii.docx | 25.44 КБ |
Предварительный просмотр:
Степень окисления. Окислительно-восстановительные реакции
Степень окисления СО — условный заряд элемента , вычисленный в предположении, что все связи в соединении ионные.
Правила , используемые при вычислении СО
- Алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в сложном ионе (например, анионе кислотного остатка) — заряду иона.
- СО атомов в простых веществах равна нулю (H 2 , N 2 , Cu, C…)
- Постоянную СО в соединениях имеют: щелочные металлы Na, K, Li… (+1); почти все металлы II группы, в том числе щелочноземельные Ca и Ba.. (+2); алюминий (+3); фтор (-1).
- CО водорода в соединениях (+1), кроме гидридов — NaH, KH, CaH 2 … -(-1)
- СО кислорода (-2), кроме ОF 2 (+2) и пероксидов – Na 2 O 2 , H 2 O 2 – (-1).
- Высшая (наибольшая положительная ) степень окисления элемента равна номеру его группы (№ группы ) в периодической системе, низшая — ( 8 — № группы )
- СО элемента в простом ионе равна заряду этого иона: FeCl 3 -соль, по таблице растворимости можно узнать заряды ионов, а значит и степени окисления
Заряд иона Fe 3+ → степень окисления Fe Заряд иона Cl — → степень окисления Cl
1. Находим в формуле элементы с известной СО и записываем их над знаками
- «Неизвестную» СО х рассчитываем по правилу 1
+1 x -2 +1 x -2 +2 x -2
KMnO 4 HNO 3 CaSO 4
1 + X +4(-2) =0 1+x+3(-2)=0 2+x+4(-2)=0
x=7 → CO(Mn)=+7 x=5→CO(N)=+5 x=+6→CO(S)=+6
Fe 2 (SO 4 ) 3 заряд иона SO 4 2- , значит заряд железа Fe 3+ ,тогда
Fe 2 S 3 О 12 2(+3) + 3х+12(-2) = 0 х=6 → СО(S)=+6
- Окислительно-восстановительные реакции ОВР
ОВР — такие реакции, в ходе которых электроны от одних атомов переходят к другим (меняется степень окисления элементов).
Окислитель – вещество, атомы или ионы которого, присоединяют электроны.
Восстановитель – вещество, атомы или ионы которого отдают электроны.
Повышение степени окисления СО, связано с отдачей
атомом или ионом электронов, называют процессом окисления
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8 СО
Понижение степени окисления СО, связано с присоединением (приобретением)
атомом или ионом электронов, называется процессом восстановления
Составление уравнений ОВР.
Расстановка коэффициентов методом электронного баланса. При использовании метода постулируют: число электронов, отданным восстановителем равно числу электронов, присоединенных окислителем.
- Записывают схему реакции (формулы исходных веществ и продуктов реакции без коэффициентов)
Cl 2 + H 2 S + H 2 O → HCl + H 2 SO 4
- Определяют элементы, которые поменяли степень окисления
Cl 2 + H 2 S + H 2 O → HCl + H 2 SO 4
- Записывают эти элементы в две строки и определяют число электронов, приобретенных окислителем и отданных восстановителем (число атомов обычно берут из левой части схемы реакции). Дополнительные уравнения называют уравнениями электронного баланса, иногда полуреакциями окисления и восстановления
4. Уравнивают число приобретаемых и отдаваемых электронов
S — 8ē → S 1 (надо взять один атом серы, он отдаст 8ē)
Cl 2 + 2ē → 2Cl 4 (надо взять четыре молекулы хлора, они приобретут 8ē)
восстановитель S — 8ē → S 1 окисление
окислитель Cl 2 + 2ē → 2Cl 4 восстановление
Полученные числа 1 и 4 представляют соотношение исходных атомов серы (в составе H 2 S)
и молекул хлора и являются коэффициентами для левой части уравнения.
- Запишем полученные коэффициенты перед формулами двух веществ (окислителя Cl 2 и
восстановителя H 2 S) в левую часть уравнения
4Cl 2 + H 2 S + H 2 O → HCl + H 2 SO 4
- Правую часть уравниваем по левой
4Cl 2 + H 2 S + 4H 2 O = 8HCl + H 2 SO 4
В тетради результаты вашей работы выглядят так :
4Cl 2 + H 2 S + 4H 2 O = 8HCl + H 2 SO 4
восстановитель S — 8ē → S 1 окисление
окислитель Cl 2 + 2ē → 2Cl 4 восстановление
Никакие другие записи не нужны
1,2 Al + Cl 2 → AlCl 3
3,4 восстановитель Al — 3ē → Al 2 окисление
окислитель Сl 2 + 2ē → 2Cl 3 восстановление
5,6 2Al + 3Cl 2 = 2AlCl 3
1,2 Al + HCl → AlCl 3 + H 2
3,4 восстановитель Al — 3ē → Al 1 окисление
окислитель H + 1ē → H 3 восстановление
5,6 Al + 3HCl → AlCl 3 + 3/2 H 2 — промежуточные коэффициенты. После умножения всех коэффициентов на 2 получим:
2Al + 6HCl = 2AlCl 3 + 3H 2
По теме: методические разработки, презентации и конспекты
презентация по теме «Степень окисления»
Данную презентацию можно использовать в 8 классе при изучении темы «Степень окисления» по программе О.С.Габриеляна.
Презентация к уроку 8 класс по теме: Степень окисления
В архиве содержится презентация и видеофайл. Остальные материалы данного урока можно найти в архиве: Материалы к уроку в 8 классе по теме: Степень окисления. http://nsportal.ru/sites/defaul.
Материалы к уроку в 8 классе по теме: Степень окисления
Это материалы к проведению урока по теме: Степень окисления к учебнику О.С. Габриеляна. Материалы являются приложением к моей презентации по теме: Степень окисления http://nsportal.ru/sites/defa.
Презентация на урок химии в 8 классе по теме «Степень окисления».
Наглядный материал на урок химии в 8 классе.
Урок в 8 классе . Тема-«Степень окисления»
Тестовый материал для подготовки к ЕГЭ по теме «Степень окисления. Окислительно-восстановительные реакции»
В данном документе собрано большое количество тестовых заданий для проверки знаний обучающихся по теме «Степень окисления. Окислительно-восстановительные реакции» и подготовке к ЕГ.
9 класс Тема: «Составление уравнений окислительно-восстановительных реакций методом электронного баланса»
Тема: «Составление уравнений окислительно-восстановительных реакций методом электронного баланса».
http://skysmart.ru/articles/chemistry/stepen-okisleniya-elementa
http://nsportal.ru/shkola/khimiya/library/2012/01/08/posobie-pamyatka-po-teme-stepen-okisleniya-okislitelno
 ; Mg 0 )
; Mg 0 )