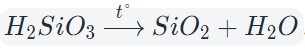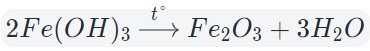Оксиды
О чем эта статья:
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
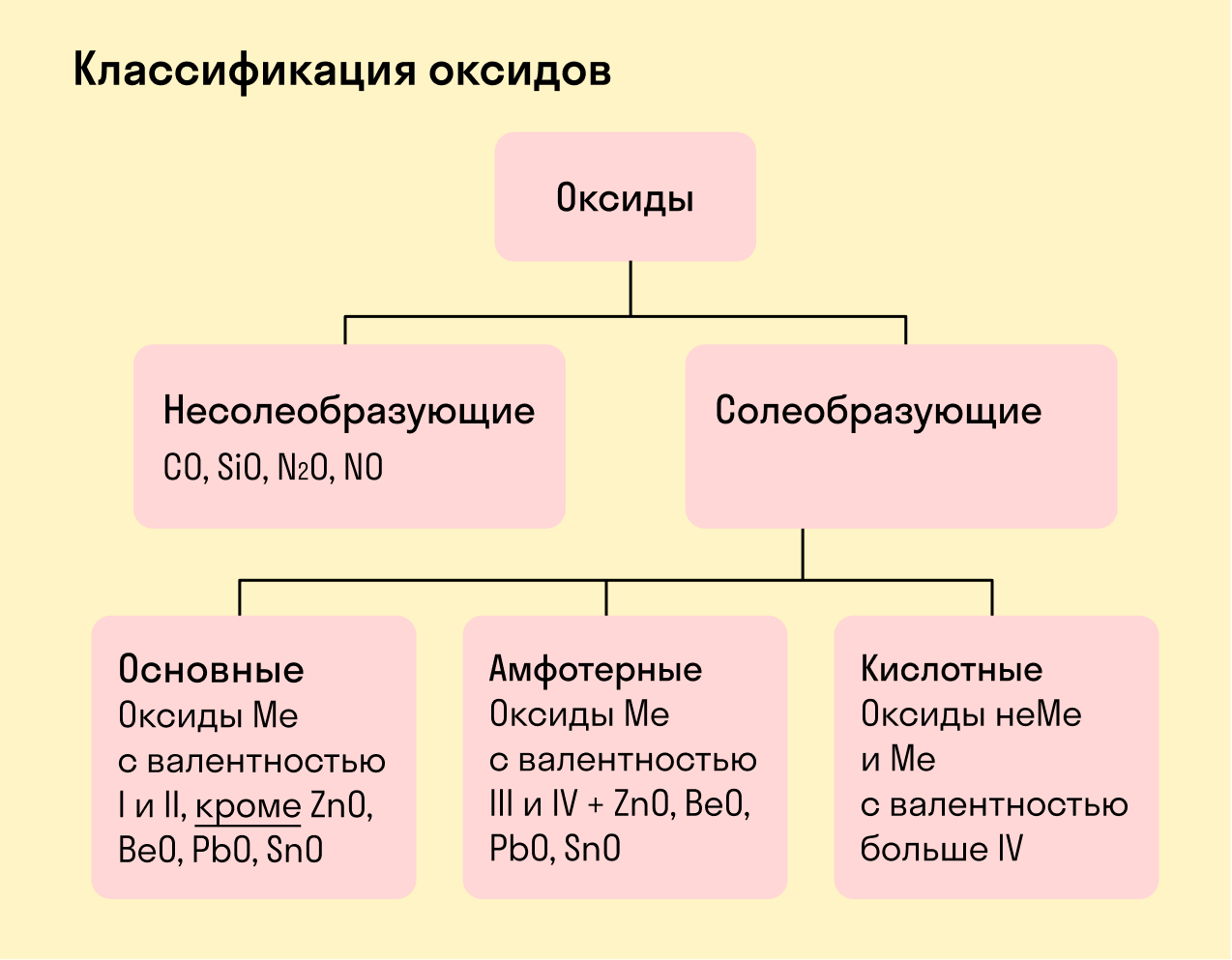
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
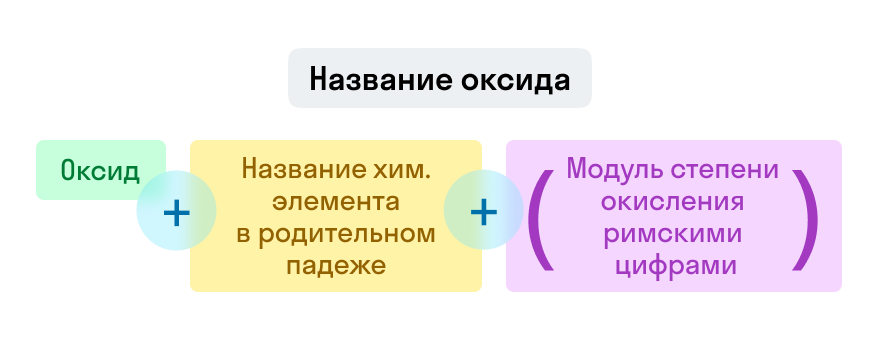
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Оксиды: классификация, получение и химические свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Тема урока: «Оксиды». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: изучение нового материала, обобщение и систематизация знаний и умений.
Цель: ввести понятие об оксидах; познакомить с важнейшими неорганическими классами; рассмотреть состав, названия, классификацию и физические свойства оксидов.
Задачи:
- Образовательная. Обобщить и закрепить знания обучающихся о физических свойствах оксидов, их нахождении в природе, применении; закрепить умения записывать уравнения реакций, характеризующих химические свойства оксидов.
- Развивающая. Развивать творческие способности при решении нестандартных задач. Развивать логическое мышление. Формировать умение представления при изучении состава, строения и свойств оксидов.
- Воспитательная. Воспитывать бережное отношение к окружающей среде. Формировать интерес к предмету, внимательность, трудолюбие, любознательность, наблюдательность.
Оборудование: Схема: «Классификация оксидов», карточки-задания, тесты, таблица «Химические свойства оксидов», таблица «Формулы и названия некоторых оксидов, схема 3, общие способы получения оксидов, карточки с формулами оксидов.
Основные формы ведения урока: рассказ, беседа, работа с учебником (общеклассная, групповая и индивидуальная), вопрос – ответ.
План урока:
- Проверка домашнего задания.
- Изучение нового материала.
- Определение и название оксидов.
- Классификация оксидов.
- Физические свойства оксидов.
- Химические свойства оксидов.
- Важнейшие оксиды.
- Способы получения оксидов.
- Способы получения оксидов.
- Закрепление изученного материала
В начале урока, мотивируя учебную деятельность учащихся, учитель рассказывает, что им предстоит изучить оксиды – вещества, образующие минералы; и на доске записывает формулу этих веществ:
| SiO2 – кремнезёмы (IV), Al2O3 – корунд, CaO – негашеная известь, Fe2O3 – красный железняк (гематит), Fe3O4 – магнитный железняк (магнитит). |
Их получают путём горения или разложения сложных веществ. В них 2 элемента, один – кислород. Я отнесу к ним также известь и лёд. Какие это вещества? (Оксиды.)
Проверка домашнего задания
Сценка «Кто я»
Я у древних химиков самым главным веществом считалась. «Начало всех начал» – говорил греческий учёный Фале, живший в VI в. до н.э. и утверждавший, что окружающий мир возник из меня – «первичной материи». Я в древности считалась матерью жизни и смерти. Мне поклонялись, а по преданиям древней Руси, во мне жили русалки и водяные. У древних народов Азии в прошлом я служила причиной войн и борьбы. Являюсь важным двигателем, который не ломается, не ржавеет, не горит, не гниёт и ни кем не уничтожается. Кто я? (Вода)
К какому классу веществ относится вода?
Какие классы неорганических веществ вы знаете?
Какие соединения (вещества) называются кислотами?
Подчеркните синим мелом формулы кислот и дайте им названия.
Как классифицируют кислоты?
Назовите кислородсодержащие и бескислородные кислоты.
Какие соединения называют основаниями?
Подчеркните жёлтым мелом формулы оснований и назовите эти вещества.
Как классифицируют основания?
Пользуясь таблицей растворимости, выберите из данных формул растворимые и нерастворимые основания.
Подчеркните красным мелом формулы солей и дайте им названия.
Какие соединения называют солями?
Как классифицируют соли?
Изучение нового материала
Итак, ребята, в 8 классе на уроках химии мы подробно разбирали состав и свойства неорганических соединений различных классов. Целью сегодняшнего урока является изучение и обобщение нового материала по теме «Оксиды».
Обращаем внимание учащихся на то, что на доске остались неподчёркнутые формулы веществ, с которыми они ещё не знакомы. Это формулы оксидов.
Вопрос 1. Какой газ необходим для фотосинтеза и выделяется при выдохе?
Ответ: углекислый газ CO2 – оксид углерода – (IV).
Вопрос 2. В стихотворении А.А. Ахматовой упомянут металл:
На рукомойнике моём
Позеленела медь
Но так играет луч на нём
Что весело глядеть.
С каким соединением реагирует водород с образованием данного металла и воды?
Ответ: оксид меди – CuO – (II)
Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления – 2 и валентности – (II).
Поскольку оксиды образуют почти все химические элементы, необходимо каждому оксиду дать своё название. Названия оксидов состоят из слова «оксид» и названия химического элемента в родительном падеже. Если элемент имеет переменную степень окисления (переменную валентность), то её указывают римскими цифрами, взятыми в скобки, после названия химического элемента.
Элементы с постоянной степенью окисления – металлы главных подгрупп I, II, III групп. Элементы с переменной степенью окисления – остальные металлы.
Таблица № 1. Формулы и названия некоторых оксидов
Упражнение «Не прерви цепочку»
Для каждого ученика приготовлена карточка с формулой оксида. Ученик показывает карточку классу и называет оксид. Работу класса учитель организует по цепочке.
Схема 1. Классификация оксидов
Учитель напоминает формулы различных веществ.
Знак, какого элемента, металла или неметалла находится на первом месте?
Кислотные оксиды, как правило, – оксиды неметаллов.
Почему эти оксиды называют кислотными?
Оксиды, которым соответствуют кислоты (независимо от того, реагируют ли они с водой или не реагируют), называют кислотными.
Впишите в «схему 1» пример кислотного оксида. Сначала назовите любой неметалл, кислоту, а затем – кислотный оксид.
Знак какого элемента, металла или неметалла находится на первом месте в формуле оксидов магния, калия?
Основными оксидами являются оксиды металлов. Если оксид бария взаимодействует с водой, то получается новое вещество Ba(OH)2 – основание.
Теперь становится понятным название «основной оксид».
Оксиды, которым соответствуют основания (независимо от того, реагируют ли они с водой или нет), называют основными.
Основные оксиды реагируют с кислотами, образуя соли.
Кислотные оксиды реагируют со щелочами, образуя соли.
Основные и кислотные оксиды относят к солеобразующим. Но есть оксиды, для которых соответствующие соли не существуют, их называют несолеобразующими или безразличными. Пример: оксид азота (II) – NO
Таким образом, можно сделать вывод, что неметаллы образуют кислотные оксиды (искл. – несолеобразующие оксиды: CO, NO, N2O, SiO )
Физические свойства оксидов
В рамках изучения физических свойств оксидов учащиеся самостоятельно работают с учебником.
Оксиды имеют различные физические свойства: оксиды бывают твёрдые, жидкие и газообразные, различного цвета.
Агрегатные состояния оксидов:
Химические свойства оксидов
Следует акцентировать внимание учащихся на правиле: оксид взаимодействует с водой, если образуется растворимый гидроксид.
Важнейшие оксиды. Оксиды широко распространены в природе. Некоторые оксиды постоянно окружают нас и находят широкое применение. Познакомимся с некоторыми из них.
Вода H2O – оксид водорода. Вода – это самой распространённоё и самое необходимое вещество на нашей планете. Без воды не было бы жизни на Земле. Всё живое нуждается в воде. Так, если без пищи человек может прожить 50 суток, то без воды смерть наступает через 5-7 дней. Вода является и важнейшей составной частью клеток животных и растений. Организм человека на 65-70 % состоит из воды, а у некоторых медуз – до 99 % массы тела составляет вода. Содержание воды в огурцах и арбузах превышает 90 %. Велики затраты воды в сельском хозяйстве. Для того чтобы вырастить 1 т. пшеницы, требуется 1500 т. воды, 1 т. риса – 7000 т. воды. Общие запасы воды на Земле – огромны и составляют 138,6 млн. км 3 . Вода покрывает почти 3/4 поверхности земного шара.
Углекислый газ СО2 – оксид углерода (IV).
Около 0,03 % по объёму углекислый газ содержится в воздухе. В природе он образуется при гниении растительных и животных останков, дыхании, сжигании топлива, в больших количествах выделяется из вулканических трещин и вод минеральных источников.
При обычных условиях диоксид углерода бесцветен, не имеет запаха. Углекислый газ значительно тяжелее воздуха. Углекислый газ применяют при изготовлении шипучих напитков, в медицине – углекислотные ванны. «Сухой лёд» применяется для хранения скоропортящихся пищевых продуктов, для производства и хранения мороженого. Углекислый газ не горит и не поддерживает горение, поэтому его применяют для тушения пожаров.
Оксид кремния (IV) SiO2 в виде песка применяется в строительстве, в производстве стекла, керамики, цемента.
Некоторые оксиды (оксид серы (IV), оксид азота и др.) образуются в промышленном производстве. В больших количествах эти оксиды попадают в атмосферу, где парами воды образуют кислоты, и выпадают в виде так называемых кислотных дождей. Кислотные дожди наносят огромный вред окружающей среде, поэтому необходимо принимать меры, способствующие снижению попадания оксидов в атмосферу.
1) при горении простых и сложных веществ;
2) при разложении сложных веществ – нерастворимых оснований, кислот, солей (схема 4)
Закрепление полученного материала
С каким классом неорганических веществ вы сегодня познакомились?
Почему они имеют такое название?
Классификация оксидов.
Какими физическими свойствами обладают оксиды?
Какими химическими свойствами обладают оксиды?
Общие способы получения оксидов?
Назовите важнейшие оксиды.
Заканчиваем урок подведением итогов, выставляем отметки и предлагаем домашнее задание.
Литература:
1. / Неорганическая химия 7 – 10 класс, Москва «Просвещение 1980 г.» С.А. Балязин, Н.Г. Ключников, В.С. Полосин, § 19, стр. 25, § 26 – 29 стр. 31 – 36, § 44, стр. 53. /
2. / Химия 10 – 12 класс, Москва «Просвещение 1989 г.» Г.Е. Рудзитис, Ф.Г. Фельдман, § 1, стр. 43. /
3. / Химия 8 класс, Москва «Оникс 21 век 2003», И.И. Новошинский, Н.С. Новошинская, § 26 стр. 83, § 45, стр. 169 – 174. /
3. / Химия в школе № 2, 2010 г., стр. 30 – 33. /
4. / Химия в школе № 7, 2012 г., стр. 24 – 25. /
6. / Химия. Первое сентября № 18, 16 – 31 сентября 2009 г., стр. 30 – 41. /
http://chemege.ru/oxides/
http://urok.1sept.ru/articles/642418