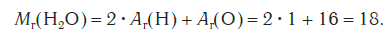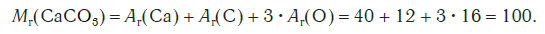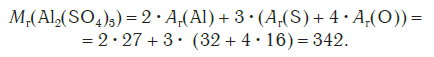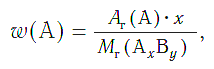Решение задач по химии
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров по данной теме.
Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества. В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12 C, т.е. 6 × 10 23 .
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.
Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества содержит 6.02 × 10 23 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 10 23 молекул воды и 12.04 × 10 23 атомов углерода.
Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 10 23 молекул), молекулярные массы отличаются. Так, 6.02 × 10 23 молекул N2 весят 28 грамм, а такое же количество молекул HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 10 23 , в их состав входят разные атомы, поэтому и массы получаются разные.
Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции. Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные массы были найдены нам уже чуть раньше, что ускорит ход решения.
ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 10 23 молекул азота, 3.01 × 10 23 молекул CaCO3 и 18.06 × 10 23 молекул HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать моль и число Авогадро.
Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества. Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом 33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ все же надо выбрать, выберем хлор — Cl2.
Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 🙂
Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере. Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5
Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по кислороду 3.5, найдите молярную массу неизвестного вещества»
Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы измерения плотности: г/мл, г/см 3 , кг/м 3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так вы точно не запутаетесь.
Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки, если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.
Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.
Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr .
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u . Например, если Mr (H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u .
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля ( w ) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А ;
Ar(А) — относительная атомная масса элемента А ;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy .
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химические формулы. Относительная молекулярная масса
Презентация к уроку
Цель урока:
Личностные:
- Развитие ответственного отношения к учению, способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
- Формирование целостного мировоззрения.
Метапредметные:
- Развитие умений определять способы действий в рамках предложенных условий и требований.
- Развитие умение осуществлять контроль своей деятельности в процессе достижения результата.
- Развитие компетентности в области использования информационно-коммуникационных технологий.
Предметные:
- Формирование первоначальных представлений о веществах: понятия “химическая формула”, “индекс”, “коэффициент”, “относительные атомная и молекулярная массы”.
- Овладение основами химической грамотности: умение писать и читать формулы веществ.
- Формирование навыков расчёта относительной молекулярной массы вещества.
Тип урока: урок введения нового материала с использованием электронно-образовательных ресурсов и самостоятельной исследовательской деятельности учащихся.
Формы работы учащихся: фронтальная, индивидуальная, мини-группы (в парах).
Оборудование: Таблица Д.И.Менделеева, ПК, экран, опорные схемы (приложение 1), карточка для организации игры “Химическое лото”, комплект шаростержневых моделей, лоток для моделей молекул, комплект цветных магнитов, магнитная доска.
ЭТАПЫ УРОКА
1. Актуализация знаний. Повторение символов химических элементов и их названий.
Учитель:
Начнём урок со строк Степана Щипачёва:
“В природе ничего другого нет,
Ни здесь, ни там, в космических глубинах.
Все от песчинок малых до планет
Из элементов состоит единых”
Все вещества окружающих нас тел живой и неживой природы состоят из химических элементов. Чтобы изучить свойства веществ и превращения одних веществ в другие, необходимо знать химический язык. Знаки химических элементов — это “буквы” химического языка. Проверим знания химических элементов.
За работу на уроке вы получаете “аурики” – показатель вашей активности. Название “Аурики” образовано от латинского названия химического элемента – драгоценного металла – Аурум (Золото). После урока вы вернёте их, в обмен на оценку.
Игра. “Химическое лото”. Работа по индивидуальным карточкам (приложение 2).
Зачеркните знак химического элемента, о котором идёт речь в строках стихотворения. (При чтении стихотворных строк ученик, выполнивший задание, держит руку на локте вместе с ручкой – сигнал выполнения работы).
Взаимопроверка (по слайду презентации), оценивание, подведение итогов игры.
Критерии оценивания:
- 16 – “5”
- 12 — 15 – “4”
- 9 – 11 – “3”
Карточки трёх учащихся (по желанию) — индивидуальная проверка учителем после урока.
| Na | H | K | Mg |
| О | Cu | Ag | P |
| N | Fe | Au | Сl |
| Hg | Ca | C | S |
| Унылая пора! Очей очарованье! Приятна мне твоя прощальная краса — Люблю я пышное природы увяданье, В багрец и в золото одетые леса. | А. С. Пушкин |
| В их стройно зыблемом строю Лоскутья сих знамен победных, Сиянье шапок этих медных, Насквозь простреленных в бою. | А. С. Пушкин |
| И квакуши, как шарики ртути, Голосами сцепляются в шар. | О. Мандельштам |
| И вспышками магния, кроя с балконов Смертельною известью лица, В агонии красных огней и вагонов В лице изменялась столица. | В. Катаев |
| О, если бы вы знали, Какой за ним уход! Он принимает калий, Ему дают азот. | Вера Инбер |
| Воды минеральные бьют из-под земли, Кальцием и натрием насыщены они. | Г. Колпакова |
| О, мощный властелин судьбы! Не так ли ты над самой бездной На высоте, уздой железной Россию поднял на дыбы? | А. С. Пушкин |
| Тогда услышал я (о диво!) запах скверный; Как будто тухлое разбилось яйцо. Иль карантинный страж курил жаровней серной. | А.С. Пушкин |
Учитель: Назовите не закрашенные элементы (за правильный ответ — дополнительный балл).
Физ.минутка. Предлагаю немного отдохнуть и устроить “Стрельбу глазами” [ 1 ]
Задание:
- В периодической системе найдите самый сильный элемент – неметалл – окислитель -7 группа, главная подгруппа, 2 период. (F)
- Переведите свой взгляд влево, на элемент, стоящий в том же периоде в 3 группе.(B)
- Переведите взгляд вниз, на самый сильный металл – 7 период. (Fr)
- Переведите взгляд вверх и вправо, на элемент 6 группы, главной подгруппы, 2 период, образующий вещество, которое поддерживает горение. (O)
- Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, содержащийся в градусниках. (Hg)
- Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5. (Cl)
- Переведите взгляд вниз и влево, на элемент, 2 группы, главной подгруппы, с порядковым номером 56. (Вa)
- Переведите взгляд на элемент, который возглавляет группу инертных газов в периодической системе Менделеева. (Не)
- Переведите свой взгляд вниз и влево, на элемент, атомы которого образуют драгоценный металл желтого цвета. (Au)
2. Введение новых знаний. Создание и решение проблемной ситуации. Исследовательское моделирование.
Учитель: Что означают знаки (символы) химических элементов?
Учащиеся: Символы химических элементов используют для обозначения атомов определённого вида; удобное международное сокращение греческих или латинских названий элементов.
Учитель: Знаки химических элементов — это знаковые модели. Давайте попробуем создать предметные модели частиц, из которых состоят вещества. Начнем с атомов. Чем отличаются друг от друга атомы разных видов, т.е. разных химических элементов?
Учащиеся: Атомы разных видов отличаются массой, размерами, строением.
Учитель: Вам выданы шаростержневые модели. Для того, чтобы показать отличие атомов друг от друга, шарики разного цвета. Это – цвет моделей, шариков, но не атомов. Атомы не окрашены. Рассмотрите их. Модели атомов кислорода красного (оранжевого) цвета. Модели атомов азота – синего цвета. Шарики чёрного цвета – обозначают атомы углерода.
Характеристика моделей атомов (инструкция на комплекте шаростержневых моделей).
водород белый углерод чёрный кислород красный (оранжевый) азот синий сера жёлтый галогены зелёный алюминий тёмно-серый
(На доске — магнитные модели, записи. Учащиеся, одновременно с учителем, делают рисунки и записи в опорном конспекте – выделенное поле для работы).
Учитель: Положите на лоток три шарика, обозначающие атомы элемента водорода. Какой символ можно использовать для обозначения?
Учащиеся: Н (аш)
Учитель: Как учесть их количество?
Учащиеся: Записать цифру три перед знаком элемента водорода.
Учитель: Вы за партой работаете в парах. Сколько атомов водорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру шесть перед знаком элемента водорода.
Учитель: Выложите в лотке модели двух атомов кислорода.
Делаем рисунок и соответствующую запись (2О). Сколько атомов кислорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру четыре перед химическим знаком элемента кислорода.
Учитель: Но во многих веществах атомы объединяются друг с другом.
Например, самый лёгкий газ водород, состоит из молекул. Каждая состоит из двух атомов элемента водорода. Создайте модель молекулы газа водорода, используя металлический стержень для соединения атомов.
1 молекула газа водорода, состоит из двух атомов (Н2).
Выложите на лоток две молекулы газа водорода.
Две молекулы газа водорода, каждая состоит из двух атомов.
Как это записать, используя знаки? (2 Н2)
- индекс
- коэффициент
Учитель: Давайте сосчитаем все молекулы газа водорода, созданные сегодня с помощью моделей? (Запись 12 Н2 )
Цифры в данной записи называются: индекс, коэффициент. Попробуйте объяснить, что означает индекс? Коэффициент? Где записывается индекс? Коэффициент?
Работа по заполнению таблицы в опорной схеме.
Учащиеся: Индекс указывает на число атомов в молекуле, коэффициент – на число отдельных частиц.
Учитель: Молекула воды состоит из одного атома кислорода и двух атомов водорода, расположенных под углом. Соберите модель на столах (на доске – магнитная модель, рисунок в тетради, запись) (Н2О)
Сколько молекул воды в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Поставим коэффициент два перед записью.
Учитель: Как вы думаете, чем модели молекул похожи? Чем модели отличаются друг от друга?
Учащиеся: В одной группе – молекула состоят из одинаковых атомов, в другой – из разных.
Учитель: Вещества, которые состоят из одинаковых атомов одного химического элемента, называют простыми. Работа по заполнению таблицы.
Учитель: Дайте определение сложным веществам.
Учащиеся: Сложные вещества состоят из атомов разного вида.
Учитель: Итак, состав веществ записывается знаковыми моделями, т.е. химическими формулами.
О чем говорит нам химическая формула?
Учащиеся: О том, из каких атомов состоит вещество, в каком количестве атомы входят в состав вещества.
Учитель: Качественный состав вещества показывает, из атомов каких химических элементов оно состоит.
Количественный состав показывает число атомов каждого химического элемента в составе вещества.
Следовательно, химическая формула описывает КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ вещества.
3. Первичное закрепление знаний, умений, навыков (с использованием слайдов №3 — №13 презентации, при необходимости осуществляется проверка в виде голосового сопровождения к презентации при нажатии на значок).
Порядок действий:
- Прочитать химическую формулу.
- Дать характеристику состава сложного вещества (качественный и количественный состав).
Чтение химических формул, определение качественного и количественного состава сложных веществ. ДЛЯ СЛОЖНЫХ ВЕЩЕСТВ (За правильный ответ — “аурик”).
4. Игра. Будь внимателен!
Учитель: На какие группы можно разделить предложенные формулы веществ? (Слайд №14 презентации).
Учащиеся: Можно разделить на простые и сложные вещества.
Учитель: Определим, где простые, а где сложные вещества в этом перечне. Если показываемое вещество простое, 1 хлопок в ладоши (поднять одну руку), если сложное – 2 хлопка (поднять две руки, работает весь класс). Слайд №15 презентации к уроку.
Встречаемся ли мы с предложенными веществами в повседневной жизни?
Рассказ учащегося о применении предложенных веществ (учебный проект). Слайд №16 презентации к уроку.
Физ.минутка. Гимнастика для глаз с использованием кружков, расположенных на окне.
Посмотреть на круг, приклеенный на стекло, на счет 1–4, потом перевести взгляд вдаль на счет 1–6. Повторить 4–5 раз.
Крепко зажмурить глаза (считать до 3), открыть глаза и посмотреть вдаль (считать до 5). Повторить 4–5 раз.
Закрыть глаза и посидеть спокойно, медленно считая до 5.
Открыть глаза, потянуться, на счёт 1-4 медленно поднимаем руки вверх, на счёт 1-4 опускаем руки, кладём на парту. Повторить 3-4 раза.
5. Введение новых знаний. Вычисление относительной молекулярной массы.
Учитель: Одной из основных характеристик вещества является его относительная молекулярная масса Mr. Слайд №17 презентации к уроку (или работа с ЭОР в сети интернет).
http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»>http://fcior.edu.ru/card/13775/otnositelnaya-molekulyarnaya-massa-veshestva.html»
Видеомодуль коллекции ЭОР http://fcior.edu.ru. 1,2 слайды.
Учитель: Молекулы также как и атомы, имеют массу, которая также очень мала, поэтому в расчётах используют относительную молекулярную массу.
Как вы считаете, как можно найти массу молекулы, зная массу атомов? Конечно, сложить атомные массы между собой, но при этом не надо забывать, что атомов в молекуле может быть не один и это тоже нужно учитывать.
Относительная молекулярная масса вещества (Mr) – это число, показывающее во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Это безразмерная величина
Мы умеем определять относительную атомную массу ХЭ. Где можно найти и проверить цифровое значение относительной атомной массы?
Учащиеся: Можно найти в периодической системе химических элементов Д.И.Менделеева.
Учитель: А как можно определить относительную массу молекулы?
Учащиеся: Относительная молекулярная масса вещества равна сумме относительных атомных масс атомов, входящих в состав молекулы с учетом их индексов.
AxByCz где A, B, C — знаки Эl x, y, z – количество атомов этих Эl
6. Первичное закрепление изученного материала (работа с опорной схемой).
Последовательность действий при определении относительной молекулярной массы.
Алгоритм. Вычисление относительной молекулярной массы по химической формуле.
1. Найти значения относительных атомных масс элементов в периодической системе.
2. Умножить число атомов на значение относительной атомной массы для каждого элемента.
3. Сложить полученные значения.
Работа с тренажёром “Вычисление относительной молекулярной массы” (http://fcior.edu.ru/card/12971/trenazher-vychislenie-otnositelnoy-molekulyarnoy-massy-veshestv.html)
Слайд №18 презентации к уроку (или работа с ЭОР в сети интернет).
Определение относительной молекулярной массы веществ по предложенным формулам (работа с опорной схемой).
| молекула | значение Мr |
| Н2О | Мr(Н2О)= 2Ar (Н) +1Ar(О)= 2·1 +1·16 = 18 |
| H2SO4 | Мr(H2SO4) = Ar( ) + Ar ( ) + Ar ( ) = |
| HNO3 | Мr(HNO3) = Ar( ) + Ar( ) + Ar( ) = |
| Fe2O3 | Мr(Fe2O3) = Ar + Ar = |
| SO3 | Мr( ) = |
| NaOH | Мr( ) = |
| H3PO4 | Мr ( ) = |
| N2 | Мr ( ) = |
| H2O2 | Мr ( ) = |
7. Закрепление знаний, умений, навыков. Cамостоятельная работа.
Сравнение относительных молекулярных масс. Вставьте знак, больше, меньше, равно, выполнив вычисления. Слайд №19 презентации к уроку.
| Mr (Н2SO4) | Mr (Н3РO4) |
| Mr (SO3) | Mr (MgO) |
| 5 Mr (CH4) | 2 Mr (NaOH) |
| Mr (NH3) | Mr (PH3) |
8. Итог. Рефлексия.
Учитель: С какими понятиями мы познакомились сегодня на уроке.
| Я узнал много нового. | |
| 2. | На уроке было над чем подумать. |
| 3. | Мне это пригодиться в жизни. |
| 4. | На все возникшие вопросы я получил(а) ответы. |
| 5. | На уроке я поработал добросовестно. |
9. Домашнее задание. П.12
Индивидуальное задание (по вариантам, приложение 3).
Сайт “Мир ХИМИИ” Раздел “Учащимся. 8 класс” Урок №14.
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ (если на уроке остаётся несколько свободных минут):
1. Найдите и запишите значения относительных молекулярных масс:
1) хлорида меди (II), состоящей из одного атома меди и двух атомов хлора;
2) оксида фосфора(V), состоящего из двух атомов фосфора и пяти атомов кислорода;
3) двухатомной молекулы хлора.
| молекула | значение Мr |
| Мr( ) = | |
| Мr( ) = | |
| Мr( ) = |
Источники информации.
- Е. П. Пак. Типы химических реакций. Игра-путешествие. 8 класс. “Первое сентября. Химия” N19 (761), 1-15.11.2008
- Баженов А.А. Тренажер к уроку химии. 8 класс. “Чтение химических формул”
http://himi4ka.ru/arhiv-urokov/urok-7-otnositelnaja-molekuljarnaja-i-otnositelnaja-formulnaja-massy.html
http://urok.1sept.ru/articles/628500