Уравнения по теме «Химические свойства металлов»
методическая разработка по химии (9 класс) на тему
Большое количество уравнений, требующих детальной проработки теоретического материала.
Скачать:
| Вложение | Размер |
|---|---|
| uravneniya_po_teme_himicheskie_svoystva_metallov.docx | 13.64 КБ |
Предварительный просмотр:
Тема: Химические свойства металлов
Дописать уравнения возможных реакций и расставить коэффициенты:
- Li + C=
- Sn + H 2 O=
- Cu + H 2 SO 4 (Конц)= Cu SO 4 + SO 2 + H 2 O
- Ba + KOH=
- Fe + PbCl 2 =
- Cu + H 2 O=
- Ba+ P=
- Al + HCl=
- Hg+ AgNO 3 =
- Na + Cl 2 =
- K + H 2 O=
- Cu + H NO 3 (Конц)=
- Zn + KOH=
- Fe + AlCl 3 =
- ZnCl 2 +Sn =
- Cu + H 2 O=
- Al+ KOH=
- Ni + MgO=
- Br 2 + Ca=
- Zn + H 2 O=
- Mg+ H 3 PO 4 =
- Fe + NaOH=
- Al + CoO=
- Sn + H 2 O=
- Ba + KOH=
- Al + FeO=
- Au + H 2 O=
- Be+ O 2 =
- Ni+ HCl=
- Sn+ AgNO 3 =
- К+ Cl 2 =
- Ca + H 2 O=
- Zn+ NaOH=
- Fe + AlCl 3 =
- Fe + H 2 O=
- Zn + H 2 SO 4 (разб)=
- Be+ KOH=
- ZnCl 2 +Sn =
- Li + I 2 =
- Ni + MgO=
- Br 2 + Ca=
- Zn + H 2 O=
- Mg+ H 3 PO 4 =
- Fe + NaOH=
По теме: методические разработки, презентации и конспекты
план-конспект урока с использованием ЭОР в 9 классе по теме «Положение металлов в ПСХЭ. Физические свойства металлов»
Цель урока: повторить положение металлов в ПСХЭ и особенности строения их атомов, обобщить и расширить знания учащихся о физических свойствах металлов.
Свойства металлов. Металлы в организме человека
Методическая разработка урока химии в 9 классе в рамках школьного методического дня «Как сделать вопросы и задания инструментом развития мышления учащихся».
Конспект урока по теме:»Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов.»
План — конспект урока разработан для учащихся 9 класса на основе Примерной программы по химии для основной школы и на основе программы авторского курса химии для 8-11 классов О.С. Габриеляна (в .
Металлы и их соединения. Общая характеристика и свойства металлов.
Данный материал будет незаменим как мультимедийное дополнение на уроке химии по теме «Металлы и их соединения» и будет полезен любому учителю, стремящемуся сделать объяснение нового материала максимал.
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов». Цели урока учебные, воспитательные и р.
Получение металлов. Физические свойства металлов.
План — конспект урока с рабочей инструкцией.
План урока химии по теме «Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов».
План урока № 62 (9кл). Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов.
Уравнение баланса металла
εα=γβ
связывает основные технологические показатели процесса и позволяет рассчитать степень извлечения металла в концентрат, которая, в свою очередь, показывает полноту перехода металла из руды в концентрат.
Выход продуктов обогащения можно определить по данным химических анализов продуктов. Если обозначить: 


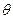

здесь за 100 принят выход исходной руды в процентах. Отсюда выход концентрата
Извлечение металла в концентрат можно подсчитать по формуле
Если выход концентрата неизвестен, то
Например, при обогащении свинцовой руды, содержащей 2,5% свинца, получен концентрат с содержанием 55% свинца и хвосты, содержащие 0,25% свинца. Подставляя результаты химических анализов в приведенные выше формулы, получим:
извлечение в концентрат
Качественно-количественные показатели обогащения характеризуют техническое совершенство технологического процесса на фабрике.
Качество конечных продуктов обогащения должно соответствовать требованиям, предъявляемым потребителями к их химическому составу. Требования к качеству концентратов называются кондициями и регламентируются ГОСТ, техническими условиями (ТУ) или временными нормами и разрабатываются с учетом технологии и экономики I переработки данного сырья и его свойств. Кондициями устанавливается минимально или максимально допустимое содержание различных составных компонентов полезного ископаемого в конечных продуктах обогащения. Если качество продуктов соответствует кондициям, то эти продукты называются кондиционными.
Выводы:
Обогатительная фабрика является промежуточным звеном между рудником (шахтой) и металлургическим заводом. Руда различной крупности, поступающая с рудника, при переработке на обогатительной фабрике проходит различные процессы, которые по своему назначению можно разделить на подготовительные, собственно обогатительные и вспомогательные.
Подготовительные процессы имеют целью подготовить руду к обогащению. Подготовка включает прежде всего операции уменьшения размеров кусков руды — дробление и измельчение и связанную с ними классификацию руды на грохотах, в классификаторах и гидроциклонах. Конечная крупность измельчения определяется крупностью вкрапленности минералов, так как при измельчении необходимо максимально раскрыть зерна ценных минералов.
К собственно обогатительным процессам относятся процессы разделения руды и других продуктов по физическим и физико-химическим свойствам минералов, входящих в их состав. К этим процессам относятся гравитационное обогащение, флотация, магнитная и электрическая сепарация и др.
Большинство процессов обогащения проводится в воде и получаемые продукты содержат большое количество ее. Поэтому возникает необходимость во вспомогательных процессах. К ним относится обезвоживание продуктов обогащения, включающее сгущение, фильтрование и сушку.
Кроме того, существуют так называемые специальные методы обогащения, к которым относятся:
рудоразработка, основанная на различии цвета и блеска отдельных минералов, их прозрачности или свечения;
адиометрическая сортировка, основанная на различии радиоактивных свойств минералов или силе их излучения;
обогащение по трению, основанное на различии коэффициентов трения минералов при движении их по плоскости;
химическое и бактериальное обогащение, основанное на способности минералов, например, сульфидов, окисляться и растворяться в сильно кислых растворах.
Процесс обогащения характеризуется технологическими показателями: содержанием металла в руде или продукте обогащения; выходом продукта; степенью сокращения и извлечением металла, что определяет основные характеристики процессов обогащения.
Контрольные вопросы:
1. На какие разделы делят методы обогащения полезных ископаемых?
2. Какие методы относятся к основным, а какие к вспомогательным методам обогащения.
3. Какие методы обогащения Вам известны?
4. Охарактеризуйте процессы грохочения, дробления, измельчения и классификации.
5. Какие процессы называют гравитационными, флотационными? Что такое магнитное и электрическое обогащение?
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
2Al + 3Cl 2 = 2AlCl 3
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Ca + N 2 = t, °C = Ca 3 N 2
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
2Al + 6H 2 O = 2Al(OH) 3 +3H 2
Магний (в горячей воде):
Mg + 2H 2 O = t°C = Mg(OH) 2 +H 2
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3Fe + 4H 2 O = t°C = FeO‧Fe 2 O 3 + 4H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
2H 2 SO 4 (конц.) + Cu = t°C = CuSO 4 + 2H 2 O + SO 2 ↑
8Na 0 + 5H 2 +6 SO 4 = 4Na 2 +1 SO 4 + H 2 S -2 ↑ + 4H 2 O
HNO 3 + Me = Нитрат + H 2 O + Х
4HNO 3 (k) + Cu = Cu(NO 3 ) 2 + 4H 2 O + 2NO 2 ↑
8HNO 3 (p) + 3Cu = 3Cu(NO 3 ) 2 + 4H 2 O + 2NO↑
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
Zn + 4HNO 3 (конц. горячий) = t˚C = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl 2 = FeCl 2 + Cu
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
http://megaobuchalka.ru/11/34457.html
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-48-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2-%D1%80%D1%8F%D0%B4-%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D0%BE%D1%81%D1%82%D0%B8-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9-%D1%80%D1%8F%D0%B4-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2












