Политропный процесс | 20+ важных часто задаваемых вопросов и числовых значений
Content
Политропный процесс
Определение политропный процесс
Политропное уравнение | Политропное уравнение состояния
Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Это метод постоянной удельной теплоемкости, при котором учитывается поглощение тепла газом из-за повышения температуры на единицу.
Политропный индекс
- п nd закон термодинамики. Эти частные случаи используются в тепловом взаимодействии для астрофизики и химической энергии.
- п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
- n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
- 1 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
- γ st закон термодинамики,
Политропный против изэнтропического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Изэнтропический процесс, также известный как обратимый адиабатический процесс, представляет собой идеальный процесс, в котором не происходит передача энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу. Т.к. теплопередача равна нулю. дQ = 0
Согласно первому закону термодинамики,
Политропный процесс против адиабатического процесса
Политропный процесс — это термодинамический процесс, который подчиняется уравнению
Этот процесс учитывает потери на трение и фактор необратимости процесса. Это реальный процесс, за которым следует газ в определенных условиях.
Адиабатический процесс — это особое и специфическое состояние политропного процесса, при котором.
Подобно изэнтропическому процессу, в этом процессе также не происходит передачи энергии или тепла через границы системы. В этом процессе предполагается, что система имеет изолированную границу.
Политропная эффективность
«Политропический КПД, точно определяемый как отношение идеальной работы сжатия для изменения перепада давления в многоступенчатом компрессоре к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре».
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
Политропная голова
Политропный напор можно определить как напор, создаваемый центробежным компрессором при политропном сжатии газа или воздуха. Величина развиваемого давления зависит от плотности сжатого газа, и это зависит от изменения плотности газа.
γ = индекс адиабаты
zсредний = Средний коэффициент сжимаемости
η = политропная эффективность
Pd = Давление нагнетания
Ps = Давление всасывания
S = удельный вес газа
Ts = Температура всасывания
Политропный процесс для воздуха | Политропный процесс для идеального газа
Считается, что воздух является идеальным газом, и поэтому законы идеального газа применимы к воздуху.
………………………. Соотношение между давлением [P] и объемом [V]
………………………. Связь между объемом [В] и температурой [Т]
………………………. Связь между давлением [P] и температурой [T]
Примеры политропных процессов
1. Рассмотрим политропный процесс с индексом политропы. п = (1.1). Начальные условия: P1 = 0, В1 = 0 и заканчивается на P2= 600 кПа, В2 = 0.01 м 3 . Оцените проделанную работу и теплоотдачу.
Ответ: Работы, выполненные политропным процессом, предоставлены
Теплопередача определяется выражением
2. Поршневой цилиндр содержит кислород при 200 кПа объемом 0.1 м. 3 и при 200 ° С. Масса добавляется так, чтобы газ сжимался с PV. 1.2 = постоянная до конечной температуры 400 ° C. Подсчитайте проделанную работу.
Ответ: Выполненная политропная работа определяется
3. Рассмотрим аргон при 600 кПа, 30 ° C, сжатый до 90 ° C в политропном процессе с n = 1.33. Найдите проделанную работу на Газе.
Ответ: Выполненная политропная работа определяется
для аргона при 30 ° C составляет 208.1 Дж / кг. K
Принимая m = 1 кг
4. Предположим, что масса 10 кг ксенона хранится в баллоне при 500 К, 2 МПа, расширение представляет собой политропный процесс (n = 1.28) с конечным давлением 100 кПа. Посчитайте проделанную работу. Учтите, что система имеет постоянную удельную теплоемкость.
Ответ: Выполненная политропная работа определяется
для ксенона при 30 ° C — 63.33 Дж / кг. K
Принимая m = 10 кг
5. Рассмотрим цилиндр-поршень с начальным объемом 0.3, содержащий 5 кг газообразного метана при давлении 200 кПа. Газ сжимают политропно (n = 1.32) до давления 1 МПа и объема 0.005. Рассчитайте теплопередачу во время процесса.
Ответ: Политропная теплопередача определяется
6. Примите во внимание цилиндр-поршень, содержащий 1 кг метана при 500 кПа, 20 ° C. Газ политропно сжимают до давления 800 кПа. Рассчитайте теплопередачу с показателем n = 1.15.
Ответ: Политропная теплопередача определяется
Мы знаем, что R для метана = 518.2 Дж / кг. K
7. 1 кг гелия хранится в системе поршень-цилиндр при 303 К, 200 кПа сжимается до 400 К в обратимом политропном процессе с показателем степени n = 1.24. Гелий является идеальным газом, поэтому удельная теплоемкость будет фиксированной. Найдите работу и теплопередачу.
Ответ: Выполненная политропная работа определяется
R для гелия составляет 2077.1 Дж / кг.
Политропная теплопередача определяется выражением
8. Предположите, что воздух хранится в баллоне объемом 0.3 литра при 3 МПа, 2000 К. Воздух расширяется в соответствии с обратимым политропным процессом с показателем степени n = 1.7, объемное соотношение в этом случае составляет 8: 1. Рассчитайте политропную работу для процесса и сравните ее с адиабатической работой, если процесс расширения следует за обратимым адиабатическим расширением.
Ответ: Нам дается
Соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
Проделанная адиабатическая работа определяется выражением
Для процесса расширения Работа, выполняемая посредством обратимого адиабатического процесса, больше, чем Работа, выполняемая посредством обратимого политропного процесса.
9. В закрытом контейнере содержится 200 л газа при 35 ° C, 120 кПа. Газ сжимается в политропном процессе до температуры 200 ° C, 800 кПа. Найти политропную работу, совершаемую воздухом для n = 1.29.
Ответ: соотношение между давлением [P] и объемом [V]
Выполненная политропная работа определяется выражением
10. Масса 12 кг газообразного метана при 150 ° C, 700 кПа подвергается политропному расширению с n = 1.1 до конечной температуры 30 ° C. Найти теплопередачу?
Ответ: Мы знаем, что R для метана = 518.2 Дж / кг. K
Политропная теплопередача определяется выражением
11. Узел цилиндр-поршень содержит R-134a при 10 ° C; объем 5 литров. Охлаждающая жидкость сжимается до 100 ° C, 3 МПа в соответствии с обратимым политропным процессом. рассчитать проделанную работу и теплоотдачу?
Ответ: Мы знаем, что R для R-134a = 81.49 Дж / кг. K
Выполненная политропная работа определяется выражением
Политропная теплопередача определяется выражением
12. Является ли политропный процесс изотермическим по своей природе?
Ответ: Когда n становится 1 для политропного процесса: согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
13. Обратим ли политропный процесс?
Ответ: политропные процессы внутренне обратимы. Вот несколько примеров:
п = 0: Р = С: Представляет собой изобарический процесс или процесс постоянного давления.
n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV γ = C представляет собой постоянную температуру или изотермический процесс.
п = γ: В предположении закона идеального газа, представляет собой постоянную энтропию, изэнтропический процесс или обратимый адиабатический процесс.
n = Бесконечность: Представляет собой изохорный процесс или процесс постоянного объема.
14. Адиабатический политропный процесс?
Ответ: когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
14. Что такое политропная эффективность?
Ответ: Политропический КПД можно определить как отношение идеальной работы сжатия к фактической работе сжатия при изменении перепада давления в многоступенчатом компрессоре. Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Проще говоря, это изоэнтропическая эффективность процесса для бесконечно малой ступени многоступенчатого компрессора.
Где, γ = индекс адиабаты
Pd = Давление нагнетания
Ps = Давление всасывания
Td = Температура подачи
Ts = Температура всасывания
15. Что такое гамма в политропном процессе?
Ответ: В политропном процессе, когда п = γ: В предположении закона идеального газа PV γ = C, представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
16. что такое политропный процесс?
Ответ: Политропный процесс можно определить уравнением
показатель степени n называется индексом политропы. Он зависит от материала и варьируется от 1.0 до 1.4. Его также называют процессом с постоянной удельной теплотой, при котором тепло, поглощаемое газом, учитываемое из-за повышения температуры на единицу, является постоянным.
17. Какие выводы можно сделать для политропного процесса с n = 1?
Ответ: когда п = 1: PV n = C : Согласно предположению об идеальном газе, закон становится PV = C представляет собой постоянную температуру или изотермический процесс.
18. Что такое неполитропный процесс?
Ответ: Политропный процесс можно определить уравнением PV n = C показатель степени n называется индексом политропы. Когда,
- п 0). Как и в циклах сжатия пара, тепло теряется в горячее окружение.
- п = γ: В предположении закона идеального газа PV γ = C представляет постоянную энтропию или изэнтропический процесс или обратимый адиабатический процесс.
- γn0). Как и в циклах сжатия пара, тепло теряется в горячее окружение. Изменение температуры происходит из-за изменения внутренней энергии, а не подводимого тепла. Произведенная работа превышает количество поданного или добавленного тепла. Таким образом, даже если при политропном расширении добавляется тепло, температура газа снижается.
21. В политропном процессе, когда PV n = константа, температура тоже постоянна?
Ответ: В политропном процессе, когда PV n = постоянная, температура остается постоянной только при показателе политропы n = 1. Для n = 1: PV = C: Согласно предположению об идеальном газовом законе, PV = C представляет постоянную температуру или изотермический процесс.
Energy
education
сайт для тех, кто хочет изучать энергетику
Термодинамика и тепломассообмен
Идеальный газ
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
4. Процессы изменения состояния идеальных газов
К основным термодинамическим процессам относят следующие четыре процесса:
- изохорный – при постоянном объеме ($v = const$);
- изобарный – при постоянном давлении ($р = const$);
- изотермический – при постоянной температуре ($Т = const$);
- адиабатный – без теплообмена с внешней средой ($\mathrm
q = 0$).
В реальных условиях указанные ограничения практически не выполняются. В связи с этим в технической термодинамике существует понятие политропного процесса как общего случая термодинамического процесса. Предполагается, что политропный процесс обратим и теплоемкость рабочего тела (идеального газа) $с_n$ в ходе данного процесса не изменяется ($c_n=const$). Уравнение политропного процесса имеет вид:
где $n=\frac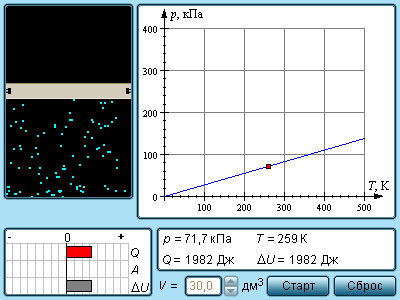
Изобарный процесс – термодинамический процесс, происходящий в системе при постоянном давлении. Параметры состояния идеального газа на изобаре связаны соотношением:
Отсюда следует, что чем выше температура газа, тем больше его удельный объем (т.е. тем меньше плотность). При этом величина v на изобаре при повышении температуры растет тем быстрее, чем меньше давление.
Работа расширения системы в изобарном процессе определяется следующим образом:
Для идеального газа работа расширения системы в изобарном процессе может быть представлена также в следующем виде:
Количество теплоты, сообщаемой системе при нагреве (или отдаваемой системой при охлаждении) в изобарном процессе, определяется следующим образом:
$$\mathrm
Изменение энтропии в изобарном процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, определяется из соотношения:
Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа давления и объемы в любых точках на изотерме связаны уравнением Бойля—Мариотта, т.е. зависимость объема от давления на изотерме для идеального газа имеет характер гиперболы:
Работа расширения системы в изотермическом процессе между точками изотермы 1 и 2 определяется с помощью общего соотношения:
Количество теплоты , подводимой к системе (или отдаваемой системой) в изотермическом процессе, определяется из известного соотношения:
Количество работы, совершаемой идеальным газом в изотермическом процессе, равно количеству теплоты, подведенной к этому газу:
Изменение энтропии в изотермическом процессе, т.е. разность энтропий, соответствующих состояниям 1 и 2, вычисляется следующим способом:
Адиабатный процесс – такой термодинамический процесс, в котором к системе не подводится и от системы не отводится теплота. Термодинамическую систему, в которой протекает адиабатный процесс, можно представить себе в виде некоторого объема, ограниченного оболочкой, снабженной идеальной теплоизоляцией, абсолютно не пропускающей теплоту. В реальных условиях процесс является адиабатным в тех случаях, когда система снабжена хорошей теплоизоляцией или когда процесс расширения (сжатия) газа происходит настолько быстро, что не успевает произойти скольконибудь заметный теплообмен газа с окружающей средой.
Поскольку для обратимого процесса $\mathrm
Для любого состояния системы в изоэнтропном процессе справедливо соотношение Пуассона:
Если показатель изоэнтропы $k$ изменяется с изменением состояния системы и известен характер зависимости $k$ на изоэнтропе, то для расчета величины $p_2$ по известным $p_1$, $v_1$ и $v_2$ следует вычислить интеграл, стоящий в правой части по известным значениям $k$.
Для идеального газа показатель изоэнтропы $k$ можно определить:
Так как для идеального газа $c_p=c_v+µR$, тогда:
Как известно, теплоемкости идеального газа слабо изменяются с температурой, поэтому и величину $k$ с высокой степенью точности можно считать практически не зависящей от температуры. Известно, что мольная изохорная теплоемкость $μс_v$ идеального газа равна примерно $13$ кДж/(кмоль·К) для одноатомного идеального газа, $21$ кДж/(кмоль·К) для двухатомного и $29$ кДж/(кмоль·К) для трех- и многоатомного газа. Поскольку $µR≈8.3$ кДж/(кмоль·К), то получаем следующие примерные значения показателя изоэнтропы $k$ идеального газа: одноатомный $k=1.67$, двухатомный $k=1.40$, трех- и многоатомный $k=1.29$. Для воздуха показатель изоэнтропы в идеально-газовом состоянии равен примерно $1.40$.
Для изоэнтропного процесса в идеальном газе можно получить соотношения, связывающие между собой значения $p$, $Т$ и $v$:
Работа расширения системы в изоэнтропном процессе определяется следующим образом:
Таким образом, в адиабатном процессе работа расширения системы совершается за счет убыли внутренней энергии системы. Это и понятно – ведь в адиабатном процессе к системе нет притока теплоты извне и единственный источник энергии для совершения работы – внутренняя энергия самой системы.
В случае идеального газа уравнения для расчета работы расширения могут быть представлены также в иной форме:
Следует подчеркнуть, что уравнение выше пригодно для расчета в том случае, если в интервале параметров между точками 1 и 2 показатель изоэнтропы $k$ сохраняется постоянным.
Политропные процессы. Политропными называют термодинамические процессы, удовлетворяющие уравнению:
при произвольном, постоянном для данного процесса значении $n$.
Понятие о политропных процессах было введено в термодинамике по аналогии с понятием об адиабатных процессах. Уравнение политропного процесса по внешнему виду сходно с уравнением адиабаты, однако существенная разница между этими уравнениями состоит в том, что если показатель изоэнтропы (адиабаты) $k$ является в общем случае величиной переменной, то уже само понятие политропного процесса основано на предположении о том, что показатель политропы n является постоянной величиной. В политропном процессе к системе может подводиться (или отводиться от нее) теплота.
Понятие о политропных процессах широко используется главным образом при изучении процессов сжатия и расширения в газовых двигателях, зачастую политропные процессы оказываются удобными для аппроксимации действительных газовых процессов в двигателях. Реальные процессы сжатия в газовых двигателях и компрессорах часто не являются ни адиабатными, ни изотермическими, а занимают промежуточное положение между этими двумя видами процессов. Поэтому обычно встречаемые на практике значения показателя n политропного процесса лежат в интервале от $1$ до $k$.
Если политропный процесс осуществляется в идеальном газе, то нетрудно получить зависимости между начальными и конечными параметрами процесса:
Работа расширения системы в политропном процессе между точками 1 и 2 определяется с помощью уравнения:
Это уравнение можно преобразовать в вид:
Количество теплоты , подводимой к системе (или отводимой от нее) в политропном процессе можно определить с помощью уравнения первого закона термодинамики:
Тогда теплоемкость идеального газа в политропном процессе:
Изменение энтропии системы в политропном процессе, т.е. разность энтропий, соответствующих точкам 1 и 2 на политропе, определяется из соотношения:
Для того чтобы определить значение показателя политропы для того или иного конкретного газового процесса, надо располагать экспериментальными данными для этого процесса.
Администратор сайта: Колосов Михаил
email:
Copyright © 2011-2022. All rights reserved.
Политропический процесс
Вы будете перенаправлены на Автор24
Что такое политропический процесс
Политропическим или политропным процессом называют процесс, который происходит при неизменной теплоемкости. Все уравнения изо процессов и адиабатный процесс можно легко получить изменяя показатель политропы. Так, при изохорном процессе молярная теплоемкость равна $<(c>_<\mu V>)$:
При изобарном ($c_<\mu p>$):
При изотермическом процессе теплоемкость равна $\pm \infty $. При адиабатическом процессе теплоемкость равна нулю.
Уравнение политропы для идеального газа
Получим уравнение политропы для идеального газа, следуя тому, что теплоемкость должна быть постоянна.
Из уравнения Менделеева — Клайперона для идеального газа:
Из соотношения Майера:
\[C_p-C_V=\nu R\ \left(5\right).\]
Подставим (5) в (4), получим:
Разделим уравнение (3) $T\ $, получим:
Очевидно, что если теплоемкость процесса постоянная, то
Уравнение интегрируем, потенцируем, получаем:
Уравнение (8) — уравнение политропы в переменных T, V. Используя уравнение Менделеева — Клайперона легко получить политропу в параметрах $p,V$ или $p,T$.
При $С=0$, $n=𝛾$. При $C=\infty ,\ n=1$ получаем уравнение Бойля — Мариотта ($T=const$). При С=$C_p$, n=0 — уравнение для $p=const$, при С=$C_V,\ n=\pm \infty $- уравнение для $V=const$.
Задание: Идеальный газ совершает политропный процесс. Найти молярную теплоемкость в этом процессе $с_<\mu n>$, если $i$ — число степеней свободы для этого газа.
Запишем первое начало термодинамики:
\[CdT=\frac<2>\nu RdT+pdV\ \left(1.1\right).\]
Разделим уравнение на $dT$, получим:
Запишем уравнение процесса:
Используем уравнение Менделеева — Клайперона:
Подставим в (1.2) результаты преобразований (1.4) и (1.5), получим:
Ответ: Выражение для молярной теплоемкости в политропном процессе: $с_<\mu n>$=$\frac<2>+\frac<1><1-n>$.
Готовые работы на аналогичную тему
Задание: Можно ли вычислить работу газа по формуле:
для адиабатного, изотермического и изобарного процессов?
Основанием для решения задачи является уравнение политропы в параметрах $p,V$ (можно и в других):
Все перечисленные в условиях задачи процессы являются частными случаями политропического процесса. Рассмотрим адиабатный процесс. Для него $n=\gamma$. Подставим показатель адиабаты в (2.1) вместо n, получим:
Сравним с уравнением работы для адиабатного процесса, которое было рассмотрено в разделе, посвященном этому процессу, имеем:
Если учесть, что из уравнения Менделеева-Клайперона:
то получаем, что выражения (2.3) и (2.4) эквивалентны.
Рассмотрим изотермический процесс. Для него $n=1$, соответственно, уравнение политропы имеет вид:
Уравнение (2.6) известный закон Бойля — Мариотта. Подставим $n=1$ в (2.1), получим:
Мы получили, что работа стремится к $\infty $. Следовательно, приведенная формула (2.1) для вычисления работы в изотермическом процессе не подходит.
Рассмотри изобарный процесс. Для него $n=0$. Уравнение политропы примет вид:
\[pV^0=const\ \to p=const\ \left(2.8\right).\]
Подставим $n=0$ в выражение для работы (2.1), получим:
Выражение (2.9) соответствует формуле вычисления работы для изобарного процесса.
Ответ: Данная формула подходит для вычисления работы в процессах: адиабатном и изобарном, не подходит для вычисления работы в изотермическом процессе.
Задание: Газ участвует в политропическом процессе. Пусть уравнение процесса задано в параметрах $p,V$ при каких значениях $n$
- Температура растет при расширении газа?
- Температура падает при увеличении объема?
- T=const при увеличении объема?
Уравнение политропы имеет вид:
Рассматривая уравнение (3.1), сразу можно дать ответ на третий вопрос: температура постоянна при n=0, так как в таком случае мы получаем закон Бойля — Мариотта:
Если перейти от (3.1) в уравнение политропы в параметрах T, V, то ответим и на два первых вопроса. Для перехода используем уравнение Менделеева — Клайперона (возьмем его для одного моля, что не нарушит общности рассуждений):
Подставим (3.3) вместо p (3.2), получим:
Для того, чтобы определить, что происходит с температурой согласно уравнению (3.4), необходимо сравнить $1-n$ с нулем. Если $1-n>0$, то с ростом $V$ растет и $T$. И наоборот.
- $1-n>0,\ \to n
- $1-n1$ при таком n, если $V\uparrow ,\ то\ T\downarrow$.
Ответ: Температура растет при расширении газа если $n1$. $T=const$ при увеличении объема, если $n=0$.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
http://www.energyed.ru/Term/GasCh05
http://spravochnick.ru/fizika/termodinamika/politropicheskiy_process/
