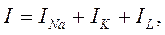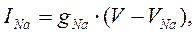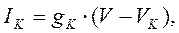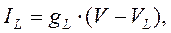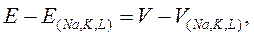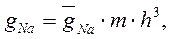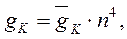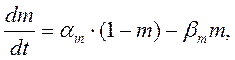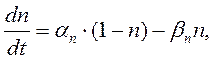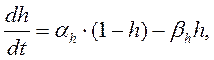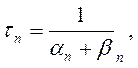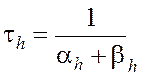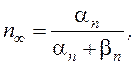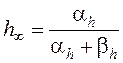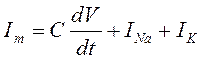Уравнение постоянного поля ионных токов
Уравнение постоянного поля
Для того чтобы вычислить точное значение мембранного потенциала для модели идеальной клетки, необходимо принять во внимание отдельные ионные токи, протекающие через мембрану. Входящий натриевый ток (i Na ) зависит от величины движущей силы для ионов натрия (Vm -ENa ), а также от натриевой проводимости мембраны (gNa ). Проводимость пропорциональна среднему количеству натриевых каналов, находящихся в открытом состоянии при потенциале покоя: чем больше открытых каналов, тем выше проводимость. Таким образом, натриевый ток равен:
Тот же подход справедлив и для калия и хлора:
Если принять i Cl , = 0 (т.е. ионы хлора находятся в равновесии), то, для сохранения неизменного значения мембранного потенциала, калиевый и натриевый токи должны быть равны по величине и противоположны по направлению:
Рассмотрим это уравнение более подробно. Предположим, что g K значительно больше g Na . Тогда, для того чтобы токи были равны, движущая сила для выхода калия должна быть значительно меньше движущей силы для натриевого входа. Другими словами, мембранный потенциал должен быть ближе к Е K, чем к ENa . Соответственно, если значение g Na велико, то мембранный потенциал будет ближе к ENa .
Преобразовав выражение, получим формулу для мембранного потенциала:
Если по той или иной причине ионы хлора не находятся в равновесии, то формула приобретает несколько более сложный вид:
Вышеприведенные расчеты были первоначально проведены Голдманом) и, независимо от него, Ходжкином и Катцем), с той лишь разницей, что вместо равновесных потенциалов и проводимостей они оперировали ионными концентрациями снаружи ([Na] 0 ,. .) и внутри ([Na] i ,. .) клетки, а также проницаемостью мембраны для каждого из ионов (p Na ···):
Так же как и ранее, хлорные компоненты выражения не рассматриваются, если ионы хлора находятся в равновесии. Уравнение называется «уравнением ГХК» по фамилиям авторов, или уравнением постоянного поля, поскольку одним из допущений при выводе уравнения является равномерное распределение градиента напряжения (т.е. «поля») на всем протяжении мембраны. Уравнение ГХК полностью аналогично уравнению проводимостей, на его основании можно сделать те же предсказания: когда проницаемости для натрия и хлора малы по сравнению с калиевой проницаемостью, хлорный и натриевый компоненты уравнения становятся пренебрежимо малы, и мембранный потенциал стремится к значению равновесного потенциала для калия: Vm = 58 log ([K] 0 / [K] 1 ). При увеличении натриевой проницаемости мембранный потенциал сдвигается в сторону натриевого равновесного потенциала.
Рис.1. Зависимость мембранного потенциала от внеклеточной концентрации калия на аксоне кальмара (полулогарифмическая шкала). Прямая линия проведена под углом наклона, равным 58 мВ на десятикратное изменение внеклеточного уровня калия, в соответствии с уравнением Нернста. Благодаря наличию мембранной проницаемости для натрия, экспериментальные данные расходятся с прямой линий, особенно при низких концентрациях калия.
Из уравнения постоянного поля следует один важный принцип. Мембранный потенциал зависит от проводимости (или проницаемости) мембраны для важнейших ионов, а также от их равновесных потенциалов. В реальных клетках проводимости для калия и хлора сравнительно· высоки, поэтому потенциал покоя клетки близок к равновесным потенциалам для этих двух ионов. При увеличении натриевой проводимости, например, во время потенциала действия или возбуждающего постсинаптического потенциала, мембранный потенциал сдвигается в сторону натриевого равновесного потенциала.
Потенциал покоя
Несмотря на то, что во многих случаях уравнение ГХК весьма полезно, оно не дает возможности правильно вычислить потенциал покоя. Дело в том, что условие равенства суммарного тока нулю неправомочно: третье условие равновесия, а именно требование, чтобы каждыйотдельный ионный ток равнялся нулю, не выполняется. В результате клетка будет постепенно терять калий и наполняться натрием и хлором. В реальных клетках концентрации натрия и калия поддерживаются на постоянном уровне при помощи натрий-калиевых насосов. В противовес непрерывному потоку натрия внутрь клетки и калия наружу, эти насосы переносят оба эти иона в определенной пропорции в направлении, противоположном их пассивному движению (рис.1). Следовательно, для поддержания клетки в стабильном состоянии затрачивается метаболическая энергия.
Чтобы получить более полную формулу потенциала покоя, необходимо принять во внимание как пассивное движение ионов, так и их активный транспорт, осуществляемый насосами. Рассмотрим сначала пассивное движение ионов натрия и калия через мембрану:
Отказавшись от предположения о том, что токи эти равны по величине и противоположны по направлению, но зная соотношение между ними, можно получить уравнение мембранного потенциала, исходя из равновесных потенциалов для натрия и калия, а также их относительных проводимостей. Здесь уже нужно учитывать влияние насоса. Поскольку насос поддерживает внутриклеточные концентрации натрия и калия на постоянном уровне, перенося ионы в соотношении 3: 2, то и пассивные токи должны находиться в том же соотношении: iNa /iK = 3/2. Имеем следующее выражение:
Соотношение имеет отрицательную величину, потому что направления натриевого и калиевого токов противоположны. Преобразовав выражение, получим:
Это уравнение похоже на полученное выше для модели идеальной клетки, и на его основании можно сделать то же предсказание: значение мембранного потенциала будет определяться относительными величинами g Na и g К . Отличие настоящей формулы состоит в том, что члены, относящиеся к калию, умножены на 1,5. Благодаря этому фактору мембранный потенциал будет ближе к E K . Таким образом, движущая сила для входа натрия возрастает, а для выхода калия, наоборот, уменьшается. В результате и пассивные токи натрия и калия будут находиться в соотношении 3: 2, а не 1: 1.4,Обобщая вышесказанное, можно сделать вывод, что потенциал покоя — это такое значение мембранного потенциала, при котором входящий натриевый ток не равен по величине выходящему калиевому, а превосходит его в 1,5раза. Пассивные токи обоих ионов определяются их равновесными потенциалами и проводимостями, в то время как соотношение токов 3: 2 продиктовано стехиометрическими характеристиками насоса.
Задачу по выводу формулы потенциала покоя для реальных клеток впервые взяли на себя Муллинс и Нода. С помощью внутриклеточных микроэлектродов они исследовали влияние изменения ионных концентраций на мембранный потенциал мышечной клетки. Подобно Голдману, Ходжкину и Катцу, они получили выражение, связывающее мембранный потенциал с проницаемостями и концентрациями отдельных ионов. Результат аналогичен только что полученному нами уравнению, основанному на проводимостях и равновесных потенциалах:
где r — абсолютное значение соотношения ионного транспорта (3: 2). Уравнение точно описывает потенциал покоя при условии, что все остальные ионы, проникающие сквозь мембрану (такие как хлор), находятся в равновесии.
Распределение хлора
Насколько применимы подобные рассуждения для хлора? Как и для других ионов, суммарный ток хлора должен быть равен нулю. Как показано выше, равновесие ионов хлора достигается путем простого изменения его внутриклеточной концентрации, без изменения при этом мембранного потенциала. Тем не менее, во многих клетках существуют транспортные системы для хлора. В аксоне кальмара и в мышце активные транспортные системы переносят ионы хлора внутрь клетки; во многих нервных клетках, напротив, хлор выводится из клетки (см. рис.1). В результате активного транспорта хлора в клетку, его внутриклеточная концентрация возрастает, что приводит к усилению выходящего пассивного тока утечки хлора, равного по величине активному входящему току. Транспорт хлора из клетки наружу производит обратное действие.
Электрическая модель мембраны
Потенциалы ENa , Е K и Е Cl показаны в виде батарей, а проводимости для натрия, калия и хлора изображены в виде сопротивлений (резисторов). Пассивные токи через сопротивления равны и противоположны токам, генерируемым соответствующими насосами, поэтому суммарный ток через мембрану для каждого иона равен нулю.
Ожидаемые значения мембранного потенциала
Для аксона кальмара соотношение констант проницаемости для натрия и калия приблизительно равно 0,04: 1,0. Воспользовавшись этими данными, а также значениями ионных концентраций, получим потенциал покоя в морской воде:
Становится очевидным, почему при изменении внеклеточной концентрации калия мембранный потенциал не строго подчиняется уравнению Нернста для калия. Если сравнить слагаемые в знаменателе, относящиеся к калию (1,5 x 10 = 15) и к натрию (0,04 x 460 = 18,4), то получится, что вклад калия составляет всего около 45%. По этой причине, увеличение внеклеточной концентрации калия вдвое не приведет к удвоению числителя (как было быв случае полного соответствия с уравнением Нернста), и, следовательно, эффект изменения уровня калия на мембранный потенциал меньше, чем в идеальной ситуации, когда калий является единственным проводящим ионом. Когда внеклеточная концентрация калия возрастает до существенных значений (100 ммоль), то роль калиевого компонента в знаменателе становится подавляющей, и кривая зависимости приближается к своему теоретическому углу наклона (58 мВ на 10-кратное увеличение концентрации калия). Многие калиевые каналы обладают чувствительностью к мембранному потенциалу и открываются при деполяризации, вызванной увеличением внеклеточной концентрации калия. В результате подобного увеличения проницаемости для калия вклад натрия в формирование мембранного потенциала дополнительно снижается.
Вообще, потенциал покоя нервных клеток приблизительно равен — 70 мВ. В некоторых клетках, например в скелетной мышце позвоночных, потенциал покоя может быть — 90 мВ или даже больше, что объясняется значительным превосходством калиевой проводимости над натриевой. Натриевая проводимость глиальных клеток настолько мала, что их потенциал покоя практически равен калиевому равновесному потенциалу. В таких клетках, как, например, нейроны ганглиев пиявки или рецепторы сетчатки, натриевая проводимость достаточно велика, а потенциал покоя составляет всего — 40 мВВклад натрий-калиевого насоса в мембранный потенциал .
Натрий-калиевый насос является электрогенным, потому что за каждый цикл его работы из клетки выводится один суммарный положительный заряд, тем самым увеличивая отрицательный заряд на внутренней поверхности мембраны клетки. Насколько велик этот вклад в заряд на мембране? Чтобы ответить на этот вопрос, представим себе, что насос не электрогенен, а нейтрален, то есть соотношение ионов, переносимых насосом внутрь и наружу клетки, равно единице. С учетом этого условия проведем вычисления:
Поскольку полученный потенциал покоя на 6 мВ менее отрицателен, то можно сделать вывод о том, что вклад насоса в потенциал покоя равен — 6 мВ. При условии транспорта ионов в соотношении 3: 2 вклад насоса в потенциал покоя не может превысить — 11 мВ. При остановке ионообмена его влияние на величину потенциала покоя прекращается, и потенциал покоя постепенно снижается по мере накопления в клетке ионов натрия и выхода из нее калия.
Ионные каналы, участвующие в формировании потенциала покоя
Наличие проводимости для натрия, калия и хлора в состоянии покоя было показано во многих клетках. Интересно отметить, что ионные каналы, обеспечивающие эти проводимости, до сих пор не были определены ни в одном типе клеток. Кандидаты на роль калиевых каналов, активных в диапазоне потенциала покоя, различны в зависимости от типа клеток. Среди них есть каналы, активируемые внутриклеточными катионами: натрий-активируемые и кальций—активируемые калиевые каналы. Кроме того, многие нервные клетки обладают так называемым калиевым каналом типа «М», которые открыты при потенциале покоя и закрываются при участии внутриклеточных посредников. Активация большого количества потенциал-зависимых калиевых каналов (то есть «замедленного выпрямителя» — delayed rectifier, и каналов типа «А») при потенциале покоя маловероятна. Однако, даже 0,1-1% от их общего числа было бы достаточно, чтобы создать проводимость, сравнимую с проводимостью в покое.
Конкретные носители натриевой проводимости в нервных клетках также неизвестны. В некоторой степени, вход натрия может происходить через калиевые каналы, для большинства из которых проницаемость для натрия составляет от 1 до 3% от калиевой проницаемости. Кроме того, открытые катионные каналы могут способствовать как выходу калия, так и входу натрия, поскольку большая часть этих каналов не обладает высокой селективностью к калию по сравнению с натриевой. Дополнительный источник входящего в клетку натрия — это натрий—зависимые вторичные активные транспортные системы. Наконец, потенциал—чувствительные натриевые каналы также вносят свой вклад в натриевую проводимость в покое, поскольку эта проводимость блокируется тетродотоксином, хотя и в небольшой степени).
Хлорные каналы семейства CLC широко распространены в нервных и мышечных клетках. Наличие хлорных каналов обеспечивает стабилизацию мембранного потенциала. Эти каналы также участвуют в установлении внутриклеточной концентрации хлора, взаимодействуя с системами хлорного транспорта. При низком уровне экспрессии каналов CLC, например, в нейронах эмбрионального гиппокампа, значение Е Cl менее отрицательно по сравнению с потенциалом покоя, благодаря вкладу активного транспорта ионов хлора внутрь клетки и их накоплению в цитоплазме. В нейронах взрослого животного экспрессия каналов CLC более выражена, и мембранная проводимость для хлора выше, поэтому накопление внутриклеточного хлора невозможно, и Е Сl равен мембранному потенциалу. В клетках центральной нервной системы до 10% проводимости мембраны при потенциале покоя обеспечивается за счет хлорных каналов.
Изменения мембранного потенциала
Равновесный мембранный потенциал представляет собой тот фоновый уровень, на котором происходят все изменения мембранного потенциала. Как они происходят? Обычно кратковременные изменения мембранного потенциала (подобные тем, которые наблюдаются при взаимодействии нейронов между собой) происходят за счет временных изменений проницаемости мембраны. Как мы знаем из уравнения постоянного поля, увеличение натриевой проницаемости (также как и снижение калиевой) приводит к деполяризации, то есть к смещению мембранного потенциала в сторону натриевого равновесного потенциала. Напротив, увеличение калиевой проницаемости вызывает гиперполяризацию. Еше один важный для сигнальных процессов клетки ион — это кальций. Внутриклеточная концентрация кальция очень низка, а ЕСа в большинстве клеток превышает +150 мВ. Следовательно, увеличение кальциевой проницаемости должно приводить к входу кальция в клетку и деполяризации мембраны.
Особый интерес представляет влияние хлорной проницаемости на мембранный потенциал. Как было отмечено выше, хлор вносит незначительный вклад в потенциал покоя. Внутриклеточная концентрация хлора подстраивается под новые условия за счет работы существующих хлорных транспортных механизмов. Влияние кратковременного увеличения хлорной проницаемости может выражаться как в гиперполяризации, так и в деполяризации, в зависимости от того, положителен или отрицателен Е С1 по отношению к потенциалу покоя. Это, в свою очередь, зависит от работы транспортного механизма, либо наполняющего клетку хлором, либо выводящего его наружу. В любом случае, влияние хлора на мембранный потенциал обычно невелико. Тем не менее, увеличение хлорной проницаемости может иметь важное значение для регулирования сигнальных процессов, поскольку оно поддерживает мембранный потенциал в диапазоне Е Cl и за счет этого ослабляет способность других процессов изменить мембранный потенциал.
Поддержание мембранного потенциала на неизменном уровне играет важную роль в регуляции возбудимости таких клеток, как скелетная мышца, хлорная проводимость которой в покое достаточно велика. В таких клетках кратковременный вход положительных ионов вызовет меньшую деполяризацию в присутствии хлорной проницаемости, нежели в ее отсутствии, поскольку их вход отчасти балансируется входом хлора через уже открытые каналы. Мутации хлорных каналов, снижающие хлорную проницаемость мембраны, приводят к некоторым мышечным заболеваниям. Потерявшие нормальную высокую хлорную проводимость мышцы находятся в состоянии повышенной возбудимости (myotonic.
Выводы
Нервные клетки обладают высокой внутриклеточной концентрацией калия и низкой концентрацией натрия и хлора, так что калий стремится выйти из клетки, а натрий и хлор стремятся войти в нее. Стремлению калия и хлора проникнуть через мембрану в направлении концентрационного градиента противостоит мембранный потенциал.
В модели идеальной клетки, обладающей только калиевой и натриевой проводимостями, мембранный потенциал может в точности уравновесить концентрационные градиенты таким образом, чтобы суммарный ток обоих ионов равнялся нулю. В этом случае мембранный потенциал соответствует равновесному потенциалу для калия и хлора.
Изменение внеклеточного уровня калия приводит к изменению его равновесного потенциала и, следовательно, мембранного потенциала. Напротив, изменение внеклеточной концентрации хлора приводит в конечном итоге к изменению его внутриклеточного уровня, так что сдвиг хлорного равновесного потенциала и мембранного потенциала от своих первоначальных значений носит кратковременный характер.
Мембрана реальных клеток обладает также натриевой проводимостью. В результате в состоянии покоя происходит постоянная диффузия натрия внутрь, а калия наружу клетки. Эти токи в точности уравновешиваются активным ионным транспортным механизмом — натрий-калиевым насосом, работающим по схеме 3 иона натрия к 2 ионам калия. В этих условиях, величина мембранного потенциала зависит от натриевого и калиевого равновесных потенциалов, относительных проводимостей для этих ионов, а также от соотношения ионов в цикле насоса.
Благодаря тому, что натрий-калиевый насос переносит больше положительных ионов наружу, чем внутрь клетки, он вносит непосредственный вклад в мембранный потенциал в размере нескольких мВ.
В зависимости от особенностей хлорных транспортных механизмов, равновесный потенциал для хлора может быть как более, так и менее отрицательным по отношению к потенциалу покоя. Несмотря на незначительное влияние распределения хлора на потенциал покоя, наличие высокой хлорной проводимости необходимо для поддержания электрической стабильности клетки.
Литература
1. Блюменфелъд Л.А. Решаемые и не решаемые проблемы биологической физики.
2. Барышников А. Ю, Шишкин Ю.В. Иммунологические проблемы апоптоза.
Ионная природа потенциала действия (ПД). Формальное описание ионных токов
ПД, регистрируемый впервые на гигантском (до 500 мкм в диаметре) аксоне кальмара, состоит из нескольких фаз (Рис. 11).
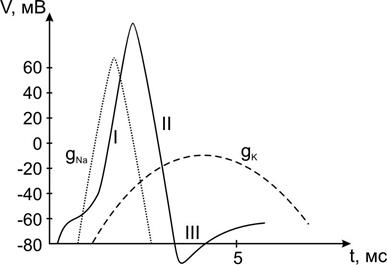 |
Исходно от уровня потенциала покоя (-90 мВ) начинается I-я фаза деполяризации, сменяющаяся на уровне нулевого (0 мВ) мембранного потенциала противоположным знаком овершутом (+ 40 мВ) и затем переходящая в II-ю фазу реполяризации по пути возвращения значений мембранного потенциала к потенциалу покоя. Отклонения от пути возвращения называют III-й фазой – следовым потенциалом:
А) положительным – при продолжающейся реполяризации.
Б) отрицательный – при развитии деполяризации.
Метод фиксации потенциала и модификации ионного состава растворов позволили вскрыть ионные механизмы каждой фазы ПД.
Основное участие в развитии фазы деполяризации принимает входящий в клетку поток положительных ионов натрия (Na + ), перезаряжающих внутреннюю поверхность мембраны. На смену быстрой активации натриевой проницаемости пороговым раздражителем приходят процессы инактивации входа Na + и активации выхода из клетки ионов калия (K + ), что проявляется фазой реполяризации – возвращения зарядов на внутренней поверхности мембраны к отрицательным значениям.
С помощью ряда упрощений Ходжкину и Хаксли (1950) в виде уравнений удалось произвести формальное (математическое) описание кинетики ионных токов электровозбудимой мембраны. По их мнению ионный ток (I) складывается из суммы натриевого (INa) калиевого (IK) и тока утечки (Il):
В отличие от натриевого и калиевого тока, ток утечки не подчиняется потенциал-зависимым механизмам активации и инактивации.
Каждый из токов рассчитывается по закону Ома:
где: gNa, gK и gl – проводимость для ионов натрия, калия и ионов утечки соответственно. (V-V(Na,K,L)) – величины электрохимических потенциалов для соответствующих ионов, где V – является отклонением от абсолютных значений мембранного потенциала Е, а V(Na,K,L)) – равновесные потенциалы, рассчитанные по уравнению Нернста.
С помощью выражений:
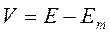
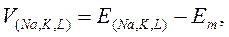
Для гигантского аксона кальмара:
В свою очередь, величины ионных проводимостей мембраны равны:
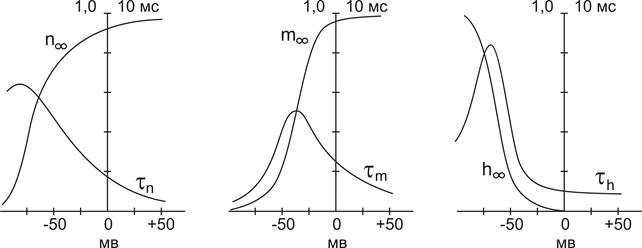
где: gNa и gK – максимальные проводимости мембраны (при сильной деполяризации ĝ Na = 120 ммо/см 2 , ĝК = 36 ммо/см 2 , gl = 0,3 ммо/см 2 ) для ионов натрия и калия соответственно.Величины m и n — переменные процесса активации, h — переменная инактивации.
Их значения в зависимости от мембранного потенциала изменяются в пределах от 0 до 1 и рассчитываются из системы дифференциальных уравнений:
где am, bm, an, bn, ah, bh— константы скоростей, зависящие от мембранного потенциала, температуры и концентрации двухвалентных ионов в наружном растворе, но не от времени. При деполяризации мембраны значения am, an и bh увеличиваются, а bm, bn и ah— уменьшаются. Решения этих уравнений проще представить в виде экспоненциальных характеристик – постоянных времени изменения m, n и h:
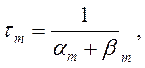
Стационарные значения переменных m, n и h будут равны:
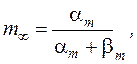
Графики зависимости стационарных значений m, n и h (m¥, n¥ и h¥) и постоянных времени tm,tn и th от мембранного потенциала представлены на Рис. 12
 |
На основании представленных выше теоретических выкладок Ходжкиным и Хаксли были рассчитаны параметры потенциала действия, которые сравнивались с экспериментальными.
В состав мембранного тока (Im) кроме ионной компоненты входит и емкостная составляющая: 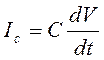
При поддержании потенциала на постоянном уровне (метод clamp-voltage) емкостная составляющая исчезает, и мембранный ток удается зарегистрировать как сумму натриевого и калиевого ионных токов (Рис.)
Использование блокаторов ионных каналов позволило получить отдельные вольт-амперные характеристики для натриевого и калиевого ионных токов и вскрыть ионные механизмы развития потенциала действия. На Рис. видно, что отличия рассчитанных и экспериментальных параметров незначительны.
Показанные изменения ионных проницаемостей (а) и ионных токов (б), рассчитанные с помощью уравнений Ходжкина-Хаксли при возникновении ПД в гигантском аксоне кальмара (Рис.) в ответ на очень короткий стимул позволили избежать емкостной составляющей мембранного тока. Видно, что первый нуль Ii соответствует моменту, когда входящий натриевый ток становится равным выходящему ионному току Il+IK. Это момент критической деполяризации, когда локальный ответ начинает переходить в ПД. В начале этого периода PNa и INa совпадают с началом развития ПД, однако, затем ход изменений их становится разным:
1. Изменения PNa имеют одну вершину, совпадающую в максимальной точке с вершиной ПД.
2. Кривая изменений INa характеризуется двумя максимумами, из которых один приходится на примерно на середину восходящего ПД, а второй- на первую треть фазы реполяризации. Вершине ПД соответствует точка наибольшего падения кривой INa в области “седла” между двумя ее вершинами.
Различия в динамике изменения между PNa и INa обусловлены тем, PNa является прямым следствием деполяризации в момент ПД, а INa зависит также от электрохимического потенциала (V-VNa), величина которого по мере деполяризации снижается. В результате продолжающего компенсаторного возрастания PNa, INa продолжает нарастать до момента выравнивания V и VNa, когда суммарный ионный ток (Ii) и изменения ПД достигают максимума. Наличие емкостных свойств мембраны позволяет ПД нарастать еще некоторое время, даже в отсутствии усиления Ii. Остановка в нарастании ПД будет происходить при равенстве плотностей выходящих и входящих ионных токов, что соответствует максимальной величине ПД.
Преобладание выходящей компоненты ионных токов будет приводить развитию фазы реполяризации, которая будет замедляться вторичным повышением INa, связанным с увеличением электрохимического потенциала (V-VNa) при еще достаточно высоком PNa. В фазу реполяризации PNa падает сначала круто, а затем, более полого из-за усиления инактивации деполяризованной мембраны.
Расчеты, проведенные позже на миелиновых нервных волокнах в области перехвата Ранвье показали, что кинетика изменений ионных проницаемостей в момент развития ПД качественно не отличается от таковой в гигантском аксоне кальмара (см.Выше). Следует отметить характерную для перехватов Раньве более высокую (3 раза) скорость нарастания ПД. Известные же отличия в скорости проведения по мякотным и безмякотным нервным волокнам определяются, как показывают дальнейшие расчеты, параметрами сопротивления и емкости мембраны с таковыми в перехватах Ранвье. При высоких сопротивлениях миелиновой оболочки (до ГОм·см 2 ), в области перехватов низко сопротивление мембраны (см. Ниже).
ОТ НЕЙРОНА К МОЗГУ. Валлас Б., Фукс П. От нейрона к мозгу Пер с англ. П. М. Балабана, А. В. Галкина, Р. А. Гиниатуллина, Р. Н. Хазипова, Л. С. Хируга
| Название | Валлас Б., Фукс П. От нейрона к мозгу Пер с англ. П. М. Балабана, А. В. Галкина, Р. А. Гиниатуллина, Р. Н. Хазипова, Л. С. Хируга |
| Анкор | ОТ НЕЙРОНА К МОЗГУ.doc |
| Дата | 31.01.2017 |
| Размер | 14.86 Mb. |
| Формат файла |  |
| Имя файла | ОТ НЕЙРОНА К МОЗГУ.doc |
| Тип | Документы #1415 |
| страница | 17 из 145 |
§ 2. Мембранный потенциал в аксоне кальмараГипотеза о том, что в основе мембранного потенциала лежит различие между внеклеточной и внутриклеточной концентрациями калия, была впервые высказана Бернштейном 1) в 1902 г. Ему не удалось проверить свое предположение экспериментально, поскольку в то время не существовало способа измерения мембранного потенциала. В наши дни можно с высокой точностью измерить мембранный потенциал, а также убедиться в том, что изменения концентрации калия внутри и снаружи клетки приводят к изменениям мембранного потенциала в соответствии с предсказаниями уравнения Нернста. Впервые такие измерения были проведены на гигантском аксоне кальмара. Аксон этот достигает 1 ммоль в диаметре 2) , что позволяет вводить в него электроды с целью прямого измерения мембранного потенциала (рис. 5.3А). Более того, аксон кальмара удивительно живуч и продолжает функционировать, даже если из него выдавить цитоплазму с помощью резинового валика и заменить ее на перфузионный раствор (рис. 5.3В и С). У исследователя есть возможность контролировать ионный состав как внеклеточного, так и внутриклеточного растворов. А. Л. Ходжкин, вместе с А. Ф. Хаксли впервые поставивший многие эксперименты на аксоне кальмара (за которые они позже были удостоены Нобелевской премии), однажды сказал 3) : Можно утверждать, что введение Юнгом в 1936 году препарата аксона кальмара имело для науки об аксоне большее значение, чем какое-либо другое открытие, сделанное за последние 40 лет. Один выдающийся нейрофизиолог заметил недавно во время ужина на одном из конгрессов (не самым тактичным образом, должен признать): «Если честно. Нобелевскую премию нужно было присвоить кальмару». Концентрации основных ионов в крови кальмара, а также в цитоплазме его аксона, приведены в табл. 5.1 (такие ионы, как магний и внутриклеточные анионы, опущены). Эксперименты на изолированном аксоне обычно проводятся в морской воде, соотношение концентраций калия во внутриклеточной и внеклеточной средах составляет при этом 40 : 1. Глава 5. Ионные механизмы потенциала покоя 93
Если бы мембранный потенциал был равен равновесному потенциалу для калия, его значение было бы –93 мВ. В действительности мембранный потенциал гораздо менее отрицателен (от –65 до –70 мВ). С другой стороны, это значение более отрицательно, чем равновесный потенциал для хлора (+55 мВ). Гипотеза Бернштейна была проверена путем измерения потенциала покоя и сравнения его с калиевым равновесным потенциалом при различных значениях внеклеточной концентрации калия. Заметим, что, как и в случае модели идеальной клетки, изменения уровня калия снаружи не влекут за собой значительных изменений его внутриклеточной концентрации. Из уравнения Нернста следует, что изменение концентрационного градиента в 10 раз при комнатной температуре приведет к изменению мембранного потенциала на 58 мВ. Результат эксперимента по варьированию внеклеточного уровня калия показан на рис. 5.4. На оси абсцисс представлен логарифм внеклеточной концентрации калия, а на оси ординат — мембранный потенциал. 94 Раздел II. Передача информации в нервной системе Таблица 5.1. Концентрации ионов снаружи и внутри аксонов кальмара. Table 5.1. Concentrations of ions inside and outside freshly isolated axons of squid.
Теоретически предсказанный угол наклона кривой (соответствующий изменению потенциала на 58 мВ при десятикратном изменении концентрации и показанный прямой линией) в действительности достигается лишь при сравнительно высоких концентрациях. Чем ниже концентрация калия, тем меньше угол наклона кривой. Данные показывают, что распределение ионов калия не является единственным фактором, формирующим мембранный потенциал. Роль натриевой проницаемостиИз экспериментов на аксоне кальмара можно заключить, что гипотеза, высказанная Бернштейном в 1902 г., была близка к истине: трансмембранный градиент калия является важным, хотя и не единственным фактором, влияющим на мембранный потенциал. Чем можно объяснить отклонение экспериментальной кривой, показанной на рис. 5.4, от уравнения Нернста? Оказывается, для этого достаточно снять ограничение с модели, состоящее в том, что мембрана непроницаема для ионов натрия. Мембрана реальной клетки действительно обладает натриевой проницаемостью, которая составляет от 1 до 10 % калиевой. Для рассмотрения роли натриевой проницаемости обратимся к модели идеальной клетки и временно исключим из поля зрения перемещение ионов хлора. Мембранный потенциал равен калиевому равновесному потенциалу, поэтому перемещение суммарного заряда через мембрану отсутствует, клетка находится в покое. Если теперь ввести в модель натриевую проницаемость, то натрий будет стремиться войти в клетку благодаря как своему концентрационному градиенту, так и мембранному потенциалу. По мере входа натрия на внутренней поверхности мембраны накапливается положительный заряд и мембрана деполяризуется. В результате ионы калия выходят из равновесия и начинают покидать клетку. С увеличением деполяризации мембраны движущая сила для входа натрия снижается, в то время как движущая сила для выхода калия возрастает. Процесс продолжается до тех пор, пока оба ионных потока не уравновесят друг друга. В этот момент изменение мембранного потенциала прекращается, поскольку какое-либо накопление заряда отсутствует. Вообще говоря, значение мембранного потенциала расположено между калиевым и натриевым равновесными потенциалами и определяется равновесием между калиевым и натриевым токами, равными по величине и направленными в противоположные стороны. Ионы хлора также участвуют в этом процессе, однако, как мы убедились ранее, равновесный потенциал для хлора подстраивается под новое значение мембранного потенциала за счет изменения внутриклеточной концентрации этого иона. По мере того как токи катионов постепенно приходят в равновесие, внутриклеточный уровень хлора возрастает до тех пор, пока суммарный хлорный ток не станет равным нулю. Уравнение постоянного поляДля того чтобы вычислить точное значение мембранного потенциала для модели идеальной клетки, необходимо принять во внимание отдельные ионные токи, протекающие через мембрану. Входящий натриевый ток (iNa) зависит от величины движущей силы для ионов натрия (Vm—ENa) (глава 2), а также от натриевой проводимости мембраны (gNa). Проводи- Глава 5. Ионные механизмы потенциала покоя 95
мость пропорциональна среднему количеству натриевых каналов, находящихся в открытом состоянии при потенциале покоя: чем больше открытых каналов, тем выше проводимость. Таким образом, натриевый ток равен: Тот же подход справедлив и для калия и хлора: Если принять iCl, = 0 (т. е. ионы хлора находятся в равновесии), то, для сохранения неизменного значения мембранного потенциала, калиевый и натриевый токи должны быть равны по величине и противоположны по направлению: Рассмотрим это уравнение более подробно. Предположим, что gKзначительно больше gNa. Тогда, для того чтобы токи были равны, движущая сила для выхода калия должна быть значительно меньше движущей силы для натриевого входа. Другими словами, мембранный потенциал должен быть ближе к ЕK , чем к ENa. Соответственно, если значение gNa велико, то мембранный потенциал будет ближе к ENa. Преобразовав выражение, получим формулу для мембранного потенциала: Если по той или иной причине ионы хлора не находятся в равновесии, то формула приобретает несколько более сложный вид: Вышеприведенные расчеты были первоначально проведены Голдманом 4 ) и, независимо от него, Ходжкином и Катцем 5 ), с той лишь разницей, что вместо равновесных потенциалов и проводимостей они оперировали ионными концентрациями снаружи ([Na]0. ) и внутри ([Na]i. ) клетки, а также проницаемостью мембраны для каждого из ионов (pNa···): Так же как и ранее, хлорные компоненты выражения не рассматриваются, если ионы хлора находятся в равновесии. Уравнение называется «уравнением ГХК» по фамилиям авторов, или уравнением постоянного поля, поскольку одним из допущений при выводе уравнения является равномерное распределение градиента напряжения (т.е. «поля») на всем протяжении мембраны. Уравнение ГХК полностью аналогично уравнению проводимостей, на его основании можно сделать те же предсказания: когда проницаемости для натрия и хлора малы по сравнению с калиевой проницаемостью, хлорный и натриевый компоненты уравнения становятся пренебрежимо малы, и мембранный потенциал стремится к значению равновесного потенциала для 96 Раздел II. Передача информации в нервной системе
Fig. 5.5. Passive Ion Fluxes and Pumps in a Steady State. Net passive ion movements across the membrane are indicated by dashed arrows, transport systems by solid arrows and circles. Lengths of arrows indicate the relative magnitudes of net ion movements. Total flux is zero for each ion. For example, the net inward leak of Na + is equal to the rate of outward transport. Na : К transport is coupled with a ratio of 3 : 2. In any particular cell. Cl—transport may be outward (as shown) or inward. калия: Vm = 58 log([K]0/[K]1). При увеличении натриевой проницаемости мембранный потенциал сдвигается в сторону натриевого равновесного потенциала. Из уравнения постоянного поля следует один важный принцип. Мембранный потенциал зависит от проводимости (или проницаемости) мембраны для важнейших ионов, а также от их равновесных потенциалов. В реальных клетках проводимости для калия и хлора сравнительно· высоки, поэтому потенциал покоя клетки близок к равновесным потенциалам для этих двух ионов. При увеличении натриевой проводимости, например, во время потенциала действия (глава 6) или возбуждающего постсинаптического потенциала (глава 9), мембранный потенциал сдвигается в сторону натриевого равновесного потенциала. Потенциал покояНесмотря на то, что во многих случаях уравнение ГХК. весьма полезно, оно не дает возможности правильно вычислить потенциал покоя. Дело в том, что условие равенства суммарного тока нулю неправомочно: третье условие равновесия, а именно требование, чтобы каждый отдельный ионный ток равнялся нулю, не выполняется. В результате клетка будет постепенно терять калий и наполняться натрием и хлором. В реальных клетках концентрации натрия и калия поддерживаются на постоянном уровне при помощи натрий-калиевых насосов (глава 4). В противовес непрерывному потоку натрия внутрь клетки и калия наружу, эти насосы переносят оба эти иона в определенной пропорции в направлении, противоположном их пассивному движению (рис. 5.5). Следовательно, для поддержания клетки в стабильном состоянии затрачивается метаболическая энергия. Чтобы получить более полную формулу потенциала покоя, необходимо принять во внимание как пассивное движение ионов, так и их активный транспорт, осуществляемый насосами. Рассмотрим сначала пассивное движение ионов натрия и калия через мембрану: Отказавшись от предположения о том, что токи эти равны по величине и противоположны по направлению, но зная соотношение между ними, можно получить уравнение мембранного потенциала, исходя из равновесных потенциалов для натрия и калия, а также их относительных проводимостей. Здесь уже нужно учитывать влияние насоса. Поскольку насос поддерживает внутриклеточные концентрации натрия и калия на постоянном уровне, перенося ионы в соотношении 3 : 2, то и пассивные токи должны находиться в том же соотношении: iNa/iK = 3/2. Имеем следующее выражение: Соотношение имеет отрицательную величину, потому что направления натриевого и калиевого токов противоположны. Преобразовав выражение, получим: Это уравнение похоже на полученное выше для модели идеальной клетки, и на его Глава 5. Ионные механизмы потенциала покоя 97 основании можно сделать то же предсказание: значение мембранного потенциала будет определяться относительными величинами gNa и gК. Отличие настоящей формулы состоит в том, что члены, относящиеся к калию, умножены на 1,5. Благодаря этому фактору мембранный потенциал будет ближе к EK . Таким образом, движущая сила для входа натрия возрастает, а для выхода калия, наоборот, уменьшается. В результате и пассивные токи натрия и калия будут находиться в соотношении 3 : 2, а не 1:1. 4, Обобщая вышесказанное, можно сделать вывод, что потенциал покоя — это такое значение мембранного потенциала, при котором входящий натриевый ток не равен по величине выходящему калиевому, а превосходит его в 1,5раза. Пассивные токи обоих ионов определяются их равновесными потенциалами и проводимостями, в то время как соотношение токов 3 : 2 продиктовано стехиометрическими характеристиками насоса. Задачу по выводу формулы потенциала покоя для реальных клеток впервые взяли на себя Муллинс и Нода 6 ). С помощью внутриклеточных микроэлектродов они исследовали влияние изменения ионных концентраций на мембранный потенциал мышечной клетки. Подобно Голдману, Ходжкину и Катцу, они получили выражение, связывающее мембранный потенциал с проницаемостями и концентрациями отдельных ионов. Результат аналогичен только что полученному нами уравнению, основанному на проводимостях и равновесных потенциалах: где r — абсолютное значение соотношения ионного транспорта (3 : 2). Уравнение точно описывает потенциал покоя при условии, что все остальные ионы, проникающие сквозь мембрану (такие как хлор), находятся в равновесии. Распределение хлораЭлектрическая модель мембраныОжидаемые значения мембранного потенциалаМожно ли, основываясь на вышеприведенных соображениях, объяснить нелинейную зависимость мембранного потенциала от концентрации калия, показанную иа рис. 5.4? Ответ станет очевидным, если подставить в формулу реальные значения. Для аксона кальмара соотношение констант проницаемости для натрия и калия приблизительно равно 0,04 : 1,0. 5 Воспользовавшись этими данными, а также значениями ионных концентраций из табл. 5.1, получим потенциал покоя в морской воде: Становится очевидным, почему при изменении внеклеточной концентрации калия мембранный потенциал не строго подчиняется уравнению Нернста для калия, как показано на рис. 5.4. Если сравнить слагаемые в знаменателе, относящиеся к калию ( 1,5 x 10 = 15) и к натрию (0,04 x 460 = 18,4), то получится, что вклад калия составляет всего около 45%. По этой причине, увеличение внеклеточной концентрации калия вдвое не приведет к удвоению числителя (как было бы 98 Раздел II. Передача информации в нервной системе
Fig. 5.6. Electrical Model oflhe Steady-State Cell Membrane shown in Figure 5.5. ЕK, ЕNa, and EClare the Nernst potentials for the individual ions. The individual ion conductances are represented by resistors (having a resistance of 1/g for each ion). The individual ion currents (iK, iNa, and iNa) are equal and opposite to the currents (i T(K), iΤ(Na)’ and iT(Cl)) supplied by the sodium-potassium exchange pump ( t na—k ), and the chloride pump (Ta), so the net flux of each ion across the membrane is zero. The resulting membrane potential is Vm. в случае полного соответствия с уравнением Нернста), и, следовательно, эффект изменения уровня калия на мембранный потенциал меньше, чем в идеальной ситуации, когда калий является единственным проводящим ионом. Когда внеклеточная концентрация калия возрастает до существенных значений (100 ммоль на рис. 5.4), то роль калиевого компонента в знаменателе становится подавляющей, и кривая зависимости приближается к своему теоретическому углу наклона (58 мВ на 10-кратное увеличение концентрации калия). Этот эффект усиливается благодаря свойству калиевых каналов, обсуждавшемуся в главе 3. Многие калиевые каналы обладают чувствительностью к мембранному потенциалу и открываются при деполяризации, вызванной увеличением внеклеточной концентрации калия. В результате подобного увеличения проницаемости для калия вклад натрия в формирование мембранного потенциала дополнительно снижается. Вообще, потенциал покоя нервных клеток приблизительно равен -70 мВ. В некоторых клетках, например в скелетной мышце позвоночных 8 ), потенциал покоя может быть -90 мВ или даже больше, что объясняется значительным превосходством калиевой проводимости над натриевой. Натриевая проводимость глиальных клеток настолько мала, что их потенциал покоя практически равен калиевому равновесному потенциалу (глава 8). В таких клетках, как, например, нейроны ганглиев пиявки 9) или рецепторы сетчатки 10) , натриевая проводимость достаточно велика, а потенциал покоя составляет всего —40 мВ. Вклад натрий-калиевого насоса в мембранный потенциалНатрий-калиевый насос является электрогенным, потому что за каждый цикл его работы из клетки выводится один суммарный положительный заряд, тем самым увеличивая отрицательный заряд на внутренней поверхности мембраны клетки. Насколько велик этот вклад в заряд на мембране? Чтобы ответить на этот вопрос, представим себе, что насос не электрогенен, а нейтрален, то есть соотношение ионов, переносимых насосом внутрь и наружу клетки, равно единице. С учетом этого условия проведем вычисления: Поскольку полученный потенциал покоя на 6 мВ менее отрицателен, то можно сделать вывод о том, что вклад насоса в потенциал покоя равен -6 мВ. При условии транспорта ионов в соотношении 3 : 2 вклад насоса в потенциал покоя не может превысить -11 мВ 11) . При остановке ионообмена его влияние на величину потенциала покоя прекращается, и потенциал покоя постепенно снижается по мере накопления в клетке ионов натрия и выхода из нее калия. Ионные каналы, участвующие в формировании потенциала покояНаличие проводимости для натрия, калия и хлора в состоянии покоя было показано во многих клетках. Интересно отметить, что ионные каналы, обеспечивающие эти проводимости, до сих пор не были определены ни в одном типе клеток. Кандидаты Глава 5. Ионные механизмы потенциала покоя 99 на роль калиевых каналов, активных в диапазоне потенциала покоя, различны в зависимости от типа клеток. Среди них есть каналы, активируемые внутриклеточными катионами: натрий-активируемые и кальций—активируемые калиевые каналы. Кроме того, многие нервные клетки обладают так называемым калиевым каналом типа «М», которые открыты при потенциале покоя и закрываются при участии внутриклеточных посредников (глава 16). Активация большого количества потенциалзависимых калиевых каналов (то есть «замедленного выпрямителя» — delayed rectifier, и каналов типа «А») при потенциале покоя маловероятна. Однако, даже 0,1-1 % от их общего числа было бы достаточно, чтобы создать проводимость, сравнимую с проводимостью в покое 12) . Конкретные носители натриевой проводимости в нервных клетках также неизвестны. В некоторой степени, вход натрия может происходить через калиевые каналы, для большинства из которых проницаемость для натрия составляет от 1 до 3 % от калиевой проницаемости 13) . Кроме того, открытые катионные каналы могут способствовать как выходу калия, так и входу натрия, поскольку большая часть этих каналов не обладает высокой селективностью к калию по сравнению с натриевой 14, 15) . Дополнительный источник входящего в клетку натрия — это натрий—зависимые вторичные активные транспортные системы (глава 4). Наконец, потенциал—чувствительные натриевые каналы также вносят свой вклад в натриевую проводимость в покое, поскольку эта проводимость блокируется тетродотоксином, хотя и в небольшой степени 9 ). Хлорные каналы семейства CLC (глава 3) широко распространены в нервных и мышечных клетках. Наличие хлорных каналов обеспечивает стабилизацию мембранного потенциала (см. ниже). Эти каналы также участвуют в установлении внутриклеточной концентрации хлора, взаимодействуя с системами хлорного транспорта 16, 17) . При низком уровне экспрессии каналов CLC, например, в нейронах эмбрионального гиппокампа, значение ЕClменее отрицательно по сравнению с потенциалом покоя, благодаря вкладу активного транспорта ионов хлора внутрь клетки и их накоплению в цитоплазме. В нейронах взрослого животного экспрессия каналов CLC более выражена, и мембранная проводимость для хлора выше, поэтому накопление внутриклеточного хлора невозможно, и ЕСl равен мембранному потенциалу. В клетках центральной нервной системы до 10% проводимости мембраны при потенциале покоя обеспечивается за счет хлорных каналов 18) . §3. Изменения мембранного потенциалаНеобходимо помнить, что, обсуждая потенциал покоя, мы всегда говорим о состоянии равновесия. Например, выше было сказано, что изменение внеклеточной концентрации хлора не оказывает значительного влияния на мембранный потенциал, потому что внутриклеточная концентрация при этом подстраивается под новые условия. В конце концов это действительно происходит, но процесс занимает какое-то время, и в течение этого времени изменение внеклеточного уровня хлора оказывает влияние на мембранный потенциал. Равновесный мембранный потенциал представляет собой тот фоновый уровень, на котором происходят все изменения мембранного потенциала. Как они происходят? Обычно кратковременные изменения мембранного потенциала (подобные тем, которые наблюдаются при взаимодействии нейронов между собой) происходят за счет временных изменений проницаемости мембраны. Как мы знаем из уравнения постоянного поля, увеличение натриевой проницаемости (также как и снижение калиевой) приводит к деполяризации, то есть к смещению мембранного потенциала в сторону натриевого равновесного потенциала. Напротив, увеличение калиевой проницаемости вызывает гиперполяризацию. Еше один важный для сигнальных процессов клетки ион — это кальций. Внутриклеточная концентрация кальция очень низка (глава 4), а ЕСа в большинстве клеток превышает +150 мВ. Следовательно, увеличение кальциевой проницаемости должно приводить к входу кальция в клетку и деполяризации мембраны. Особый интерес представляет влияние хлорной проницаемости на мембранный потенциал. Как было отмечено выше, хлор вносит незначительный вклад в потенциал покоя. Внутриклеточная концентрация хлора подстраивается под новые условия за счет работы существующих хлорных транспортных механизмов. Влияние кратковременного увеличе- 100 Раздел II. Передача информации в нервной системе ния хлорной проницаемости может выражаться как в гиперполяризации, так и в деполяризации, в зависимости от того, положителен или отрицателен ЕС1по отношению к потенциалу покоя. Это, в свою очередь, зависит от работы транспортного механизма, либо наполняющего клетку хлором, либо выводящего его наружу. В любом случае, влияние хлора на мембранный потенциал обычно невелико. Тем не менее, увеличение хлорной проницаемости может иметь важное значение для регулирования сигнальных процессов, поскольку оно поддерживает мембранный потенциал в диапазоне ЕClи за счет этого ослабляет способность других процессов изменить мембранный потенциал. Поддержание мембранного потенциала на неизменном уровне играет важную роль в регуляции возбудимости таких клеток, как скелетная мышца, хлорная проводимость которой в покое достаточно велика. В таких клетках кратковременный вход положительных ионов вызовет меньшую деполяризацию в присутствии хлорной проницаемости, нежели в ее отсутствии, поскольку их вход отчасти балансируется входом хлора через уже открытые каналы. Мутации хлорных каналов, снижающие хлорную проницаемость мембраны, приводят к некоторым мышечным заболеваниям. Потерявшие нормальную высокую хлорную проводимость мышцы находятся в состоянии повышенной возбудимости (myotonic) 19, 20) . Выводы∙ Нервные клетки обладают высокой внутриклеточной концентрацией калия и низкой концентрацией натрия и хлора, так что калий стремится выйти из клетки, а натрий и хлор стремятся войти в нее. Стремлению калия и хлора проникнуть через мембрану в направлении концентрационного градиента противостоит мембранный потенциал. ∙ В модели идеальной клетки, обладающей только калиевой и натриевой проводи- мостями, мембранный потенциал может в точности уравновесить концентрационные градиенты таким образом, чтобы суммарный ток обоих ионов равнялся нулю. В этом случае мембранный потенциал соответствует равновесному потенциалу для калия и хлора. ∙ Изменение внеклеточного уровня калия приводит к изменению его равновесного потенциала и, следовательно, мембранного потенциала. Напротив, изменение внеклеточной концентрации хлора приводит в конечном итоге к изменению его внутриклеточного уровня, так что сдвиг хлорного равновесного потенциала и мембранного потенциала от своих первоначальных значений носит кратковременный характер. ∙ Мембрана реальных клеток обладает также натриевой проводимостью. В результате в состоянии покоя происходит постоянная диффузия натрия внутрь, а калия наружу клетки. Эти токи в точности уравновешиваются активным ионным транспортным механизмом — натрий-калиевым насосом, работающим по схеме 3 иона натрия к 2 ионам калия. В этих условиях, величина мембранного потенциала зависит от натриевого и калиевого равновесных потенциалов, относительных проводимостей для этих ионов, а также от соотношения ионов в цикле насоса. ∙ Благодаря тому, что натрий-калиевый насос переносит больше положительных ионов наружу, чем внутрь клетки, он вносит непосредственный вклад в мембранный потенциал в размере нескольких мВ. ∙ В зависимости от особенностей хлорных транспортных механизмов, равновесный потенциал для хлора может быть как более, так и менее отрицательным по отношению к потенциалу покоя. Несмотря на незначительное влияние распределения хлора на потенциал покоя, наличие высокой хлорной проводимости необходимо для поддержания электрической стабильности клетки. Рекомендуемая литературао Hodgkin , A . L ., and Katz , В. 1949. The effect of sodium ions on the electrical activity of the giant axon of the squid. J. P h ys io l. 108 : 37-77. (The constant field equation is derived in Appendix A of i his paper.) Глава 5. Ионные механизмы потенциала пок о я 101 о J un ge, D. 1992. Nerve and Muscle Excita t ion, 3rd Ed. Smaller A s sociates, S u n d e r lan d , MA, Chapters 1-3. о M u llins, L.J., and Noda, K. 1963. The influence of sodium-free sol u tions on membrane potential of frog muscle fi bers. J . Gen. P h ys io l. 47: 11 7 -1 32. Цитированная литература1. Bernstein , J . 1902. P flu ge r s Arch. 92: 521-562. 2. Young, J .Z . 1936. Q.J. M icrosc. S ci . 78: 367-386. 4. Goldman, D. E. 1943. J.Gen. Physiol. 27: 37-60. 5. Hodgkin, A .L ., and Katz, R 1949. J . Physiol. 108: 37-77. 6. Mullins, L. J ., and Noda, K. 1963. J . G en. Physiol. 47: 11 7-132. 7. Matthews, G., and Wi ckelgren, W. O. 1979. J . Physiol. 293 :3 93-414, Appendix (by A. R. Martin). 8. Fa n , P., and Katz, B. 1951. J . Physiol. 115: 320-370. 9. Nicholls, J .G ., and Baylor, D .A . 1968. J . Neuro-p h ysiol. 31 :7 40-756. 10. Baylor, D. A ., and Fuo rt es, M. G. F. 1970. J . Physiol. 207: 77-92. 11. Martin, A. R ., and L evins o n, S. R. 1985. Muscle Nerve 8: 354-362. 12. Edwards, C. 1982. Neuroscience 7: 1335-1366. 13. Hi ll e, B. 1992. Ionic Channels of Excitable Membranes, 2nd Ed. Sinauer Associates, Sunderland, MA, p. 352. 14. Ye ll en, G. 1982. Nature 296: 357-359. 15. C hu a, M., and Betz, W.J. 1991. B iophys. J. 59: 1251-1260. 16. Staley, K ., et al. 1996. Neuron 17: 543-551. 17. M l adini c , M ., et al. 1999. Proc. A Soc. L a nd. В 266: 12 07-1213. 18. Gold, M. R ., and Martin, A. R. 1983. J . Physiol. 342 :9 9- 11 7. 20. Cannon, S .C . 1996. Trends Neu ro sci. 19: 3-10. источники: http://helpiks.org/3-93710.html http://topuch.ru/vallas-b-fuks-p-ot-nejrona-k-mozgu—per-s-angl-p-m-balabana-a/index17.html | |||||||||||||||||||||||||||||||||||||||