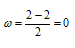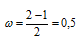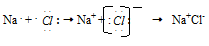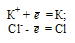Составление энергетических схем образования молекул
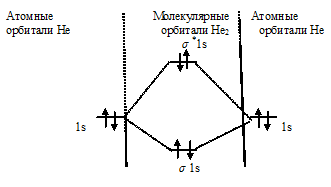
Энергетические схемы образования молекулы гелия и иона гелия
Задание 71.
Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2 + по методу молекулярных орбиталей. Как метод МО объясняет устойчивость нона Не2 + и невозможность существования молекулы Не2.
Решение:
Заполнение МО происходит при соблюдении принципа Паулии правила Хунда : сначала заполняется та орбиталь, которой соответствует наиболее низкая энергия, затем — орбитали с большими значениями полной энергии.
Схема образования молекулы Не2 имеет вид:
Определим порядок связи:
Так как порядок связи равен нулю, то молекула Не2 должна быть энергетически неустойчивой, поскольку здесь из четырёх электронов, которые должны разместиться на МО, два займут связывающую ( 1s), а два – разрыхляющую ( *1s) МО. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Действительно молекулы Не экспериментально не получены.
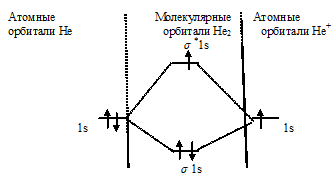
Схема образования иона Не2 + имеет вид:
Определим порядок связи:
В молекулярном ионе Не2 + порядок связи равен 0,5, следовательно, образование данного иона будет сопровождаться выделением энергии. При его образовании два электрона занимают связывающую МО, а третий электрон – занимает разрыхляющую МО, что и приводит данную частицу к устойчивому существованию. Действительно существование иона Не2 + экспериментально подтверждено и установлено, что при его образовании выделяется энергия.
Водородная связь
Задание 72.
Какую химическую связь называют водородной? Между молекулами, каких веществ она образуется? Почему Н2О и НЕ, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
Решение:
Водородной связью называют связь, которая возникает между молекулами, в которых атомы водорода связаны с атомами фтора, кислорода, азота. Она характерна для молекул HF, H2O, NH3, молекул карбоновых кислот, спиртов, аминокислот, амидов, сахаров, аминов фенолов. Например, при образовании молекулы HF возникает связь H — F, осуществляемая общей электронной парой, которая смещена к атому более электроотрицательного элемента – фтора: 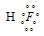
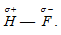
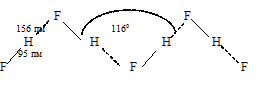
Вещества, молекулы которых соединены водородными связями, образуют системы, отличающиеся от аналогичных веществ, но не образующих водородные связи, некоторыми свойствами (температурами кипения, плавления и молекулярной массой). Обычно их температуры кипения и плавления выше, а молярные массы – больше. Объясняется это тем, что вещества, образующие водородные связи представляют собой высокомолекулярные структуры, например, фтороводород образует ассоциации из бесконечных плоских зигзагообразных цепей.
Ионная связь
Задание 73.
Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
Решение:
Ионная связь образуется противоположно заряжёнными ионами, притягиваемыми друг к другу электростатическими силами. Связь этого типа осуществляется в результате взаимного электростатического притяжения противоположно заряжённых ионов. Положительно заряжённые ионы – катионы образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп 1-й и 2-й группы. Металлы других групп и подгрупп тоже способны образовывать катионы. Анионы образуются из атомов – типичных неметаллов, обладающих большим сродством к электрону, например, Cl — , Br — , S 2- .
Так, электростатическое взаимодействие в вакууме катиона Na + и аниона Cl — приводит к образованию существующей в парах двухатомной молекулы NaCl. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия NaCl. И в молекуле Na + Cl — , и в кристаллах NaCl почти не происходит обобществления электронов: атом натрия почти полностью отдаёт электрон атому хлора. Оба атома при этом приобретают устойчивые конфигурации благородных газов:
В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Ионная связь не обладает насыщаемостью. Это объясняется тем, что система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создаёт в окружающем пространстве электрическое поле. Это означает, что два разноимённых иона, притянувшиеся друг к другу, сохраняют электростатически взаимодействовать с другими ионами.
Типичными ионными соединениями являются KCl и NaBr. Схемы превращения ионов в нейтральные атомы:
Степень окисления атома
Задание 74.
Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях: СН4, СН3ОН, НСООН, СО2.
Решение:
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов. Валентность атома элементов определяется числом его химических связей в соединении.
СН4 – степень окисления углерода равна -4;
СН3ОН — степень окисления углерода равна -2;
НСООН — степень окисления углерода равна +2;
СО2 — степень окисления углерода равна +4.
Валентность углерода во всех этих соединениях равна четырём.
Конденсированное состояние вещества
Задание 75.
Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы, и какова их природа?
Решение:
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещество состоит из полярных молекул, например, молекул Н2О или НСI, то в конденсированном состоянии соседние молекулярные диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение. Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с ростом температуры ориентационный эффект ослабевает.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например, СО2, наблюдается возникновение наведенных или индуцированных диполей. Причина их появления обычно состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы. В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Наконец, движение электронов в атомах, а также колебание ядер, и связанное с этим не-прерывное изменение взаимного положения электронов и ядер вызывает появление мгновенных диполей. Мгновенные диполи возникают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению. Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обусловливает переход благородных газов при низких температурах в жидкое состояние.
Чем больше полярность молекул, тем больше ориентационные силы. Чем больше деформируемость, чем слабее связаны внешние электроны атомов, т.е. чем эти атомы крупнее, тем значительнее дисперсионные силы. Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ. Например, в случае НСI на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для НВг эта величина составляет 95%, а для НI 99,5%. Индукционные силы почти всегда малы.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6debe1f0284215f2 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Моль. Эквиваленты и молярные массы эквивалентов простых и сложных веществ. Закон эквивалентов 2 часть
Соединяющиеся атомы не могут образовывать между собой более одной s-связи. Поэтому одинарная связь С — С – это одна s-связь с энергией 348,6 кДж. 
Пример 3.Как изменяется полярность связи и прочность молекул в ряду HF, HCl, HBr, HI?
Решение. Если ковалентная связь образована при взаимодействии разных атомов, то электронное облако связи всегда смещается к атому с большей относительной электроотрицательностью и связь будет полярной, т. е. полярность связи зависит от электроотрицательности атомов. Чем больше разность относительных электроотрицательностей, тем полярнее связь. Элементы F, Cl, Br, I находятся в одной группе периодической системы Д. И. Менделеева. В группе электроотрицательность сверху вниз падает, значит, самый электроотрицательный элемент — фтор и поэтому связь в молекуле будет самой полярной.
Приведенные в условии задачи молекулы двухатомны, и прочность их определяется прочностью связи водород-галоген. Прочность же связи при прочих равных условиях зависит от длины связи, т. е. от радиуса атома галогена. По группе сверху вниз радиусы атомов увеличиваются, длина связи галогена с водородом растет, а прочность связи соответственно падает, так как чем длиннее связь, тем она менее прочна. Уменьшается и прочность молекул.
41.Постройте графическую формулу гидросульфата натрия. Укажите виды химической связи вэтой молекуле *:
1) ионная, 2) ковалентная полярная, 3) ковалентная неполярная,
4) металлическая, 5) водородная.
Пример: графическая формула сульфата натрия.
Связь Na–О ионная; связь О–S ковалентная полярная.
42. Ваше задание карбонат алюминия*.
43. Ваше задание тиосульфат натрия *
44. Ваше задание гидрокарбонат кальция*.
45. Ваше задание — гидросульфит натрия*.
46. Ваше задание дигидрофосфат кальция *,
47. Ваше задание гидрофосфат кальция*. .
48. Ваше задание нитрит аммония*.
49. Ваше задание гидроксонитрат кальция*.
50. Ваше задание фосфат аллюминия*.
* Смотрите условие задачи №41.
51. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
52. Какая ковалентная связь называется s-связью и какая полярной? Что служит количественной мерой полярности ковалентной связи? Составьте электронные схемы строения молекул N2, H2O, HJ. Какие из них являются диполями?
53. Какая ковалентная связь называется s-связью и какая p-связью? Разберите на примере строения молекулы азота.
54. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
55. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
56. Составьте электронные схемы строения молекул Сl2, H2S, ССl4. В каких молекулах ковалентная связь является полярной? Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S?
57. Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Почему Н2O и НF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
58. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают её от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
59. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов в соединениях СН4, СН3ОН, НСООН, СО2.
60. Какая химическая связь называется металлической? Каков механизм ее образования? Какие свойства металлической связи отличают её от ковалентной?
1.4. Энергетика химических процессов
(термохимические расчеты)
Пример 1.Вычислите энтальпию образования хлорида меди, если известно, что при образовании 8,10 г этой соли выделилось 13,39 кДж тепла.
Решение. Раздел химии, в котором изложено количественное изучение тепловых эффектов реакций, называется термохимией. Было установлено, что если при образовании соединения выделяется какое-то количество теплоты, то при разложении этого соединения в тех же условиях то же количество теплоты поглощается. Таким образом, в любом процессе соблюдается закон сохранения энергии:
Это равенство показывает, что если к системе подвести теплоту Q, то она расходуется на изменение ее внутренней энергии DU = U2 — U1 и на совершение работы A. Если давление постоянно, то Qp = DU + PDV. Сумму DU + PDV обозначили H и назвали энтальпией (теплосодержанием) системы.
Стандартной энтальпией образования DH 0 называется изменение энтальпии в реакции образования 1 моля химического соединения из простых веществ при стандартных условиях (298 К, 101325 Па). Энтальпия образования простых веществ приравнивается к нулю.
Запишем термохимическое уравнение реакции образования хлорида меди:
Мольная масса хлорида меди — 134,44 г/моль. При образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Чтобы найти стандартную энтальпию, рассчитаем количество теплоты, выделяющееся при образовании 134,44 г (1 моля) хлорида меди:
DH 0 = 
Пример 2.Вычислите теплоту образования оксида железа, исходя из уравнения
Энтальпия образования оксида алюминия равна 1669 кДж/моль.
Решение. В основе термохимических расчетов лежит закон Гесса: «Тепловой эффект реакции зависит только от конечного и начального состояния веществ и не зависит от промежуточных стадий процесса». Часто в термохимических расчетах используется следствие из закона Гесса: «Тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом коэффициентов реакции»:
DH 0 х.р. = 

Распишем тепловой эффект реакции восстановления железа, используя следствие из закона Гесса:
DH 0 х.р. = (9 · DH 0 (Fe) + 4 · DH 0 (Al2O3) — (8 · DH 0 (Al) + 3 · DH 0 (Fe3O4).
Поскольку энтальпии образования простых веществ равны нулю, а теп-ловой эффект реакции и энтальпия образования оксида алюминия даны в условии задачи, то можно рассчитать энтальпию образования оксида железа.
-3326 = [9 · 0 + 4 · (-1669)] — (2 · 0 + 3DH 0 (Fe3O4),
DH 0 (Fe3O4) = 
Пример 3.Вычислите изменение энтропии в реакции горения этана:
Решение. Термодинамическая функция энтропия (S) характеризует возможные состояния вещества и их непрерывные изменения. Частицы вещества — атомы, молекулы, ионы и. т. д. совершают непрерывные колебательные и другие виды движения, переходя в каждый момент времени из одного микросостояния в другое. Чем больше таких изменений, тем больше беспорядок в системе, количественной характеристикой которого и служит энтропия.
Так, газообразное состояние более неупорядочено по сравнению с жидким, поэтому переход жидкости в газ (испарениe, кипение) сопровождается увеличением энтропии. Энтропия возрастает также в реакциях, идущих с увеличением объема, усложнением состава молекул, повышением температуры.
Чтобы можно было сравнивать энтропии различных веществ, пользуются стандартной энтропией S 0 . Величины стандартных энтропий приведены в термодинамических таблицах 4.
Энтропия, как и энтальпия, является функцией состояния, т. е. подчиняется закону Гесса и следствию из него:
DS 0 х.р. = 

По условию задачи нужно вычислить DS 0 реакции горения этана. Для этого из таблицы [1] выпишем энтропии образования веществ и подставим их в уравнение:
S 0 , Дж/моль×К 219,45 205,03 213,65 188,72,
= (2 × 188,72 + 2 × 213,65) — (219,45 + 3 × 205,03) = -29,80 Дж×K.
Пример 4.Возможна ли в стандартных условиях реакция
Решение. Для процессов, протекающих в природе самопроизвольно, характерно стремление к минимуму энергии, т. е. понижение энтальпии и стремление перейти в наиболее вероятное состояние с максимально допустимой в данных условиях степенью беспорядка, т. е. повышение энтропии.
Для реакций, протекающих при постоянном давлении и температуре, введена термодинамическая функция DG — энергия Гиббса (изобарно-изотермический потенциал), определяющая влияние энтальпии и энтропии на ход реакции. Энергия Гиббса является функцией состояния и расчет ее ведут по формулам:
DG 0 х.р. = 

По знаку и величине энергии Гиббса можно судить о направлении реакции. Если DG 0 0 = 0, то в системе наступает состояние равновесия.
Чтобы ответить на вопрос, поставленный в условии задачи, необходимо рассчитать энергию Гиббса реакции горения хлороводорода. Выпишем из справочных таблиц [1] необходимые данные:
DH 0 , кДж/моль -92,31 0 0 -241,83,
S 0 , Дж/моль×К -186,68 205,03 222,95 188,72,
= [(2 × (-241,83) + 2 × 0] — [4 × (-92,31) + 0] = -112 кДж,
= (2 × 188,72 + 2 × 222,95) — (4 × 186,68 + 205,03) = -130 Дж×K =
DG 0 х.р. = (-112) — 298 ´ (-0,13) = -73,36 кДж.
Энергия Гиббса химической реакции меньше нуля, следовательно, в стандартных условиях эта реакция возможна.
Пример 5.При какой температуре наступит равновесие в системе
если DH 0 х.р. = -81,51 кДж, а DS 0 х.р. = -0,11 кДж×К?
Решение. В состоянии равновесия энергия Гиббса равна нулю, DG = DH — TDS, если DG = 0, то DH = TDS. Из этого равенства можно рассчитать температуру, при которой наступит равновесие в системе:
Тр = 

61–70. Сформулируйте закон Гесса и следствия из него. В каких условиях теплота реакции может быть заменена изменением энтальпии процесса? Найдите энтальпию реакции по величинам энтальпий образования исходных веществ и продуктов реакции (в соответствии со своим вариантом).
Таблица №4 – Данные для задач 61–70
| № задачи | Процесс |
| 2C2H2 + 5O2 = 4CO2 + 2H2O | |
| CH4 + 2O2 = CO2 + H2O | |
| 2CH3OH + 3O2 = 2CO2 + 4H2O | |
| CH3COOH + 2O2 = 2CO2 + 2H2O | |
| CaO + H2O = Ca(OH)2 | |
| 2CO + 4H2 = C2H5OH + H2O | |
| Al2O3 + 3SO3 = Al2(SO4)3 | |
| 4NH3 + 5O2 =4NO + 6H2O | |
| Fe2O3 + 2Al = 2Fe + Al2O3 | |
| Fe2O3 + 3CO = 2Fe + 3CO2 |
71–75. Какая термодинамическая функция называется энтропией? Каково ее статистическое толкование? Как вычисляется изменение энтропии в равновесном изотермическом процессе? Найдите изменение энтропии в указанных ниже процессах при стандартных условиях.
Таблица №5 – Данные для задач 71–75
| № задачи | Процессы |
| N2+3H2=2NH | |
| H2+J2=2HJ | |
| 2NO + О2=2NО2 | |
| Н2+С12=2НС1 | |
| CH4 + 2O2 = CO2 + H2O |
16–20. Как определить возможность протекания реакции в стандартных условиях по знаку энергии Гиббса? Найдите энергию Гиббса реакции по закону Гесса и определите её направление.
Таблица №6 – Данные для задач 76–80
| № задачи | Процесс |
| Fe2O3 + 3CO = 2Fe + 3CO2 | |
| CH4 + 2O2 = CO2 + H2O | |
| 2CO + 4H2 = C2H5OH + H2O | |
| Fe2O3 + 2Al = 2Fe + Al2O3 | |
| CaO + H2O = Ca(OH)2 |
1.5. Химическая кинетика и равновесие
Пример 1.Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если увеличить давление в системе в два раза и увеличить объем газовой смеси в три раза?
Решение. Для того чтобы началась химическая реакция, необходимо выполнение условия DG a × [B] b ,
где k — константа скорости реакции, равная скорости реакции при концентрации компонентов равной единице. Запишем уравнение реакции и по закону действующих масс выразим скорость реакции:
Чтобы увеличить давление в системе в два раза, можно в два раза уменьшить объем, при этом во столько же раз увеличится концентрация каждого компонента и скорость реакции в этих случаях будет представлена формулой
Найдем отношение скоростей реакций до и после увеличения давления:
Таким образом, при увеличении давления в два раза скорость реакции увеличится в 16 раз.
Увеличение объема газовой смеси в три раза равносильно уменьшению концентрации компонентов во столько же раз, и скорость реакции будет представлена формулой
Найдем отношение скоростей до и после увеличения объема:

Итак, при увеличении объема газовой смеси в три раза, скорость химической реакции уменьшится в 81 раз.
Пример 2.Вычислите температурный коэффициент скорости реакции, зная, что с повышением температуры на 60 °С скорость возрастает в 128 раз.
Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа: «При повышении температуры на каждые 10 °С скорость большинства реакций увеличивается в два — четыре раза».

где Vt2 — скорость реакции при температуре t2; Vt1 — скорость реакции при температуре t1; g — температурный коэффициент скорости реакции:


Пример 3.Равновесие системы 2SO2 + O2 D 2SO3 установилось, когда концентрации компонентов (моль/л) были: [SO2]равн. = 0,6; [O2]равн. = 0,24; [SO3]равн. = 0,21.
Вычислите константу равновесия этой реакции и исходные концентрации кислорода и диоксида серы.
Решение. Химическим равновесием называется такое состояние, когда скорости прямой и обратной реакций равны. Характеризуется химическое равновесие константой К, она имеет вид
aA + bB D cC + dD,

В условии задачи даны равновесные концентрации. Поэтому сразу можно рассчитать константу химического равновесия для реакции:
Чтобы рассчитать исходные концентрации кислорода и диоксида серы, необходимо найти, сколько этих компонентов было израсходовано на получение 0,21 моля триоксида серы и сложить с равновесными концентрациями. Согласно уравнению реакции для получения 2 молей триоксида серы требуется 2 моля диоксида серы, а для получения 0,21 моля триоксида серы — Х молей диоксида серы. Отсюда
X = 
На получение SO3 было израсходовано 0,21 моля SO2, тогда
Для получения 2 молей SO3 требуется 1 моль O2.
Для получения 0,21 моля SO3 — X молей O2.
X = 
Пример 4.В каком направлении сместится равновесие в реакциях:
при повышении температуры, понижении давления и увеличении концентрации водорода?
Решение. Химическое равновесие в системе устанавливается при постоянстве внешних параметров (Р, С, Т и др. ) Если эти параметры меняются, то система выходит из состояния равновесия и начинает преобладать прямая или обратная реакции. Влияние различных факторов на смещение равновесия отражено в принципе Ле Шателье: «Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие уменьшится». Используем этот принцип для решения задачи.
При повышении температуры равновесие смещается в сторону эндотермической реакции, т. е. реакции, идущей с поглощением тепла. Первая и третья реакции — экзотермические (DH 0 0 > 0) — в сторону прямой реакции.
При понижении давления равновесие смещается в сторону возрастания числа молей газов, то есть в сторону большего давления. В первой и третьей реакциях в левой и правой частях уравнения одинаковое число молей газов (2-2 и 1-1 соответственно). Поэтому изменение давления не вызовет смещения равновесия в системе. Во второй реакции в левой части 4 моля газов, в правой — 2 моля, поэтому при понижении давления равновесие сместится в сторону обратной реакции.
При увеличении концентрации компонентов реакции равновесие смещается в сторону их расхода. В первой реакции водород находится в продуктах, и увеличение его концентрации усилит обратную реакцию, в ходе которой он расходуется. Во второй и третьей реакциях водород входит в число исходных веществ, поэтому увеличение его концентрации смещает равновесие в сторону прямой реакции, идущей с расходом водорода.
81. Окисление серы и ее диоксида протекает по уравнениям:
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
82. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 D 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
83. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакция были: [N2] = 0,049 моль/л;
[О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO]=0,005 моль/л. Ответ: [N2] = 0465 моль/л; [О2] = 0,0075 моль/л.
84. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л, [Н2] = 1,5 моль/л; [NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [NH3] = 0,7 моль/л; [H2 ] = 0,60 моль/л.
85. В системе, где происходит реакция Н2 + Cl2 = 2HCl увеличили давление в 3 раза. Во сколько раз при этом возросла скорость синтеза хлороводорода?
86. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции 3.
87. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2?
88. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 30 °С, если температурный коэффициент скорости данной реакции 3?
89. Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 D 2SO3. Как изменится скорость прямой реакции – образования SO3, если увеличить концентрацию SO2 в три раза?
90. Напишите выражения для константы равновесия гомогенной системы CH4 + CO2 D 2CO + 2H2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Реакция образования водорода эндотермическая.
91. Реакция идет по уравнению 2NО + О2 = 2NО2. Концентрации исходных веществ: [NO] = 0,03 моль/л; [О2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до
0,10 моль/л и концентрацию NO до 0,06 моль/л?
92. Напишите выражение для константы равновесия гетерогенной системы CО2 + С D 2CO. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
93. Напишите выражение для константы равновесия гетерогенной системы C + H2O (г) D СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водных паров?
94. Какие из ниже перечисленных факторов вызовут в системе
С (т) + О2 (г) D СО2 (г) смещение равновесия влево?
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/73.html
http://allrefrs.ru/4-36934.html