Уравнения протолитических реакций в водном растворе
1. Предположим, что растворенное вещество — катион оксония, растворитель — вода. Найдите, чему равна константа данного протолитического равновесия, а также константа кислотности пары . При оценке используйте моляльную концентрацию воды.
2. В результате растворения щелочи образуется раствор гидроксид-ионов в воде (катион щелочи протолитом не является и во внимание не принимается). Рассчитайте значение константы протолитического равновесия и константы кислотности пары . При оценке используйте моляльную концентрацию воды.
3. Составьте уравнения протолитических реакций между основанием – жидким аммиаком и безводными кислотами HCl, CH 3 COOH, HCOOH, HSO 4 — , HClO 4 . Как Вы считаете, будут ли эти реакции практически необратимыми? При подготовке ответа используйте справочную и учебную литературу.
4. Объясните, почему следующие аквакатионы не образуются и не существуют в водном растворе:
а) [Ti(H 2 O) 6 ] 4+ , б) [Ce (H 2 O) 8 ] 4+ , в) [Sn(H 2 O) 4 ] 4+
5. Используя справочные данные, укажите, какой протолит в каждой из приведенных пар аквакатионов обладает большей кислотной функцией по отношению к воде при 25 ° С:
а) [Al(H 2 O) 6 ] 3+ , [Zn(H 2 O) 4 ] 2+ в) [Ti(H 2 O) 6 ] 3+ , [Be(H 2 O) 4 ] 2+
б) [Cr(H 2 O) 6 ] 3+ , [Cu(H 2 O) 4 ] 2+ г) [Fe(H 2 O) 6 ] 3+ , [U(H 2 O) 8 ] 4+
Составьте уравнение протолитической реакции для каждого иона в водном растворе.
6. Руководствуясь справочной и учебной литературой, установите, каковы протолитические функции ионов в следующих реакциях:
а) HSO 4 — + H 2 O →
б) ZnOH + . H 2 O + H 2 O →
в) SO 3 2 — + H 2 O →
г) HF 2 — + H 2 O →
д) Fe 3+ . H 2 O + H 2 O →
е) UO 2 2+ . H 2 O + H 2 O →
ж) HPO 4 2 — + H 2 O →
з) HSeO 4 — + H 2 O →
7. Объясните, почему степень протолиза не является универсальной характеристикой кислотно-оснόвного равновесия в протонной теории (в отличие от констант кислотности и основности). Если степень протолиза слабой кислоты HA в воде равна 0,27%, а слабой кислоты HB — 8,3%, можно ли (да или нет) утверждать, что кислота HB сильнее кислоты HA? Если да, то при каком дополнительном условии?
8. Составьте уравнения протолитических реакций в водном растворе для следующих веществ:
HNO 2 , HNO 3 , H 2 SeO 3 , H 2 SeO 4 , HF, HBr, NH 3 . H 2 O
Какое значение ( > 1 , 1, = 1) будет иметь степень протолиза в каждом случае?
9. Для оценки рН раствора сероводорода студент записал следующие уравнения реакций:
H 2 S = 2H + + S 2 —
S 2 — + H 2 O HS — + OH —
Таким образом, студент сделал вывод, что среда щелочная (рН > 7). Найдите ошибки в его рассуждениях.
10. Используя справочные данные, определите, водный раствор какой соли в каждом наборе (при одинаковых температуре и концентрации) будут иметь большее значение рН:
а) KBrO, KCl, KClO д) AlCl 3 , FeCl 3 , GaCl 3
б) NH 4 NO 3 , NH 4 Cl, (NH 4 ) 2 SO 4 е) CsNO 2 , CsCN, CsNO 3
в) Cu(NO 3 ) 2 , Fe(NO 3 ) 2 , Ba(NO 3 ) 2 ж) Li 2 CO 3 , Rb 2 CO 3 , Cs 2 CO 3
г) Rb 2 S, Rb 2 SO 3 , Rb 2 CO 3 з) NaH 2 PO 4 , Na 2 HPO 4 Na 3 PO 4
Составьте уравнения реакций, протекающих в разбавленных водных растворах этих солей.
11. Составьте уравнения гидролиза солей:
а) карбонат калия; нитрат цинка
б) сульфит натрия; сульфат никеля(II)
в) сульфид натрия; сульфат аммония
г) селенит калия; сульфат хрома(III)-калия
д) нитрит калия; нитрат алюминия.
е) хлорид железа(II); cульфид калия
ж) сульфит калия; сульфат цинка
з) сульфат железа(II); нитрит натрия
и) карбонат цезия; хлорид никеля(II).
Используя справочные данные, укажите, какое значение рН ( 7, > 7, =7) имеет водный раствор каждой соли. Для каждого набора солей определите, в каком растворе (при одинаковых молярности и температуре) степень протолиза выше.
12. Составьте уравнение протолиза ортофосфорной кислоты и уравнения гидролиза сульфата железа(III) в водном растворе. Используя справочные данные, укажите, в каком из растворов при одинаковых молярности и температуре значение рН будет ниже.
13. Используя справочные данные, определите, в водном растворе какой соли каждого набора (при одинаковых температуре и концентрации) степень протолиза больше:
а) Rb 2 CO 3 , RbHCO 3 д) NH 4 ClO 4 , NH 4 Br
б) ScCl 3 , LaCl 3 е) BaS, Ba(HS) 2
в) Na 2 S, NaHS ж) K 3 PO 4 , Na 3 PO 4
г) K 2 SO 3 , K 2 TeO 3 з) FeCl 2 , NiCl 2
Составьте уравнения реакций, протекающих при приготовлении разбавленных растворов из твердой соли и воды.
14. Приготовлены водные растворы карбоната, сульфита и нитрита натрия при 25 ° С. Оказалось, что для всех растворов рН = 9. Не проводя расчета, расположите соли по уменьшению их молярной концентрации в данных растворах.
15. Водные растворы сульфатов аммония, железа(II) и индия(III) имеют одинаковое значение рН, равное 5 при 25 ° С. Каково соотношение молярных концентраций солей в этих растворах? Дайте обоснованный ответ, не проводя соответствующих расчетов.
17. Составьте уравнения гидролиза хлоридов аммония и алюминия в водном растворе. Используя справочные данные, укажите, в каком из растворов при одинаковых молярности и температуре значение рН будет ниже. Как изменится степень протолиза в растворе AlCl 3 при добавлении хлороводородной кислоты? Дайте обоснованный ответ
18. Запишите уравнения реакций, протекающих при растворении в воде:
а) хлорида хрома(III)
б) хлорида железа(II)
в) хлороводорода.
Сравните значения рН полученных разбавленных растворов при одинаковых концентрациях и температуре. Как уменьшить степень протолиза для соли (а)?
19. Значение рН 0,01М водного раствора хлорной кислоты при 25 ° С равно 2. Определите, какое значение рН имеет 2,5 . 10 — 8 М раствор той же кислоты. Изобразите (в общем виде) графическую зависимость рН от объема раствора кислоты при n (HClO 4 ) = const.
20. Студент рассчитал для 4,3 . 10 — 9 М водного раствора гидроксида бария значение рН при 25 ° С и получил неожиданный ответ: 5,93. Однако в растворе гидроксида бария среда не может быть кислотной! Проанализируйте расчет и укажите ошибку.
Изобразите (в общем виде) графическую зависимость рН от объема раствора щелочи при n
21. Исходный 0,1М раствор азотной кислоты разбавляют водой в 1000000 раз. Укажите, чему будет равен рН конечного раствора и изменится ли ответ, если вместо азотной кислоты взять:
а) азотистую кислоту
б) уксусную кислоту
в) серную кислоту
г) циановодородную кислоту
22. Имеется 1 . 10 — 9 М раствор хлорной кислоты HClO 4 . Используя формулу рН = — lg[H 3 O + ], студент рассчитал, что в этом растворе рН 9. Проанализируйте ответ (очевидно неверный), укажите правильный ответ и допущенные в расчете ошибки.
23. К 1 л воды добавили 0,05 мл раствора гидроксида калия с концентрацией 0,002 моль/л. Укажите, чему будет равна молярная концентрация гидроксид-ионов в конечном растворе. Изменится ли ответ, если вместо гидроксида калия взять гидрат аммиака?
24. Имеется 1 . 10 — 8 М раствор гидроксида натрия NaOH. Используя формулу рН = 14 + lg[OH — ], студент рассчитал, что в этом растворе рН 6. Проанализируйте ответ (очевидно неверный), укажите правильный ответ и допущенные в расчете ошибки.
25. Используя справочные данные, объясните, почему ионы HS — , H 2 PO 4 — и HPO 4 2 — не являются амфолитами в водных растворах H 2 S и H 3 PO 4 соответственно. Приведите уравнения реакций.
26. Не проводя расчета, укажите, какое значение рН (рН 7 или рН > 7) будет иметь раствор, содержащий одновременно два вещества в эквимолярных количествах:
а) Rb 2 SeO 3 , H 2 SeO 3 д) NH 4 ClO 4 , HClO 4
б) HBrO, KBrO е) BaS, H 2 S
в) HF, NaF ж) K 3 PO 4 , H 3 PO 4
г) NH 3 . H 2 O, NH 4 Cl з) Li(CH 3 COO), CH 3 COOH
27. Определили, что при 25 ° С циановодородная кислота имеет рН 7. Если в эту кислоту добавлять (небольшими порциями) цианид калия, то среда становится сначала менее кислотной, затем нейтральной и при избытке соли щелочной (рН > 7). Приведите все возможные доводы для объяснения полученных результатов опыта.
28. Раствор хлорноватистой кислоты при 25 ° С имеет рН 7. Если в этот раствор порциями добавлять гипохлорит натрия, то среда становится сначала менее кислотной, затем нейтральной и при избытке соли щелочной (рН > 7). Объясните результаты опыта.
29. Раствор аммиака при 25 ° С имеет рН > 7. Если в этот раствор порциями добавлять хлорид аммония, то среда становится сначала менее щелочной, затем нейтральной и наконец кислотной (рН 7). Объясните результаты опыта.
30. Объясните, почему при повышении температуры значение рН раствора гидрокарбоната натрия увеличивается.
31. Раствор хлорида железа(III) имеет при 25 ° С рН 7. После длительного кипячения из раствора выпадает осадок метагидроксида железа FeO(OH), а среда раствора становится почти нейтральной. Объясните все наблюдаемые результаты этого опыта.
32. Раствор сульфида калия смешивают с растворами квасцов: а) алюмокалиевых, б) хромокалиевых. После длительного кипячения среда становится почти нейтральной. Объясните результаты опыта.
33. К концентрированному водному раствору AlCl 3 добавляют цинк и смесь нагревают. Наблюдается выделение газа. Составьте уравнения протекающих реакций и поясните, почему:
а) для опыта берут концентрированный раствор
б) реакцию проводят при нагревании
34. К концентрированному водному раствору Na 3 PO 4 добавляют алюминий и смесь нагревают. Наблюдается выделение газа. Составьте уравнения протекающих реакций и поясните, почему:
а) для опыта берут концентрированный раствор
б) реакцию проводят при нагревании
35. В жидком аммиаке протекают следующие реакции:
NH 4 Cl + KNH 2 = 2NH 3 + KCl
Ba(NO 3 ) 2 + 2AgCl = 2AgNO 3 + BaCl 2 (т)
Укажите аналогичные реакции, протекающие в водном растворе.
36. Многие бинарные соединения полностью гидролизуются в водном растворе. Составьте уравнения реакций, протекающих при введении в воду следующих веществ:
а) SiCl 4 , Li 3 N, BeS д) PCl 3 O, Mg 3 N 2 , SF 4
б) Al 2 S 3 , Cl 3 N, SCl 2 O 2 е) SCl 2 O, TeF 6 , NH 2 Cl
в) CaC 2 , BCl 3 , NF 3 ж) ClO 2 F, HSO 3 Cl, Zn 3 N 2
г) Al 4 C 3 , PCl 3 , SiF 4 з) BeC 2 , IF 5 , SeCl 4
Тема №3 Протолитическое равновесие в водных растворах слабых кислот, слабых оснований и солей
ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ СЛАБЫХ КИСЛОТ, СЛАБЫХ ОСНОВАНИй И СОЛЕЙ
Типовые задачи по данной теме
1. Расчет степени ионизации и концентрации ионов в водных
растворах слабых электролитов.
2. Расчет рН водных растворов слабых кислот и оснований.
3. Расчет концентрации слабых кислот и оснований по
величине рН раствора.
4. Расчет рН водных растворов солей.
Основные теоретические положения
Кислотно-основные реакции — это частный случай равновесия в гомогенной системе, поэтому расчеты равновесных концентраций компонентов реакции базируются на законе действующих масс и условии материального баланса.
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Согласно протолитической теории Бренстеда-Лоури кислота – это вещество, являющееся донором протонов, а основание — акцептором протонов. Вещества, способные и отдавать, и принимать протоны, называются амфолитами.
Кислоты могут быть молекулярными (HNO2, HCN, H2CO3), катионными (H3O+, NH4+, Al(H2O)63+) и анионными (HC2O4-, HCO3-, H2PO4-).
Основания могут быть молекулярными (NH3, CH3NH2), катионными (AlOH(H2O)5)2+, BaOH+) и анионными (CN-, CO32-, OH-).
Амфолиты могут быть нейтральными (H2O, NH2CH2COOH) и заряженными (HCO3-, HC2O4-, HS-, H2PO4-, AlOH(H2O)52+).
Растворы слабых кислот
Сила слабой монопротонной (одноосновной) кислоты НАn, ионизация которой в водном растворе протекает согласно уравнению
НАn + Н2О 
характеризуется константой кислотности Ка(НАn) или силовым показателем рКа(НАn):

При записи уравнения (1) в виде Н3О+ + Аn- 

Константа кислотности Ка(НАn) и константа протонирования Кн(Аn–) имеют постоянные значения при постоянной температуре и любой ионной силе раствора.
Обозначим молярную концентрацию слабой монопротонной кислоты НАn, ионизация которой в водном растворе описывается уравнением (1), через Са, а степень ее ионизации как αа. С учетом того, что в растворах слабых электролитов концентрация ионов мала, будем считать активности ионов равными их концентрациям (Ic = 0, f(An–) = f(H3O+) = 1).
Если кислота НАn не является очень слабой (Ка(НАn) > 10–6), а ее раствор не очень разбавленным (Са(НАn) > 10–4 моль/л), то конкурирующей реакцией автопротолиза воды можно пренебречь.
Тогда при подстановке значений
в формулу (2) получим формулу (4), связывающую Ка, Са и αа:

Если для раствора кислоты НАn отношение Са/Ка ≥ 400, то степень ее ионизации меньше или равна 5% (αа ≤ 0,05, 1 – α ≈ 1). В этом случае [HAn] = Са, Ка = Са αа2 и справедливы соотношения (5-7):

а(Н3О+) = 
pH = – 

Если для раствора кислоты НАn отношение Са/Ка 0,05, 1–α ≠ 1). В этом случае [НАn] ≠ Са и после преобразования формулы (4) получим соотношения (8,9):

а(Н3О+) = [H3O+] =Саαа= 
Выражения (5-9) справедливы для растворов средних солей, образованных остатками слабых оснований (NH4Cl, CuCl2, FeCl3 и т. п.) и для слабых полипротонных кислот (Н3PO4, H2SO3 и т. п.), для которых Ka(HmAn) » Ka(Hm-1An-).
Растворы слабых оснований
Сила слабого основания Аn-, ионизация которого в водном растворе описывается уравнением:
Аn — + Н2О 

Как было показано выше, для характеристики силы основания Аn — может использоваться константа протонирования Кн(Аn-):
Кн(Аn-) =
Аналогично предыдущим рассуждениям легко получить формулы для вычисления степени ионизации, равновесных концентраций и рН растворов слабых оснований.
Для слабого однокислотного основания Аn — с молярной концентрацией Сb и степенью ионизации αb ≤ 0,05 (Cb/Kb ≥ 400) в случае, когда ионизацией воды можно пренебречь, получаем:

a(OH-) = [OH-] = [HAn] = αbCb = 
рН = 14 — рОН = 14 – 
Если αb > 0,05 (Cb/Kb 400, то αа 5% и для расчета αа и рН воспользуемся формулами (8,9):

=
рН = – lg [H3O+] = – lg 2,33·10-2 = 1,63
Пример 3. Рассчитайте степень ионизации аммиака, концентрацию ионов аммония и оксония и рН 0,100 моль/л водного раствора аммиака.
Решение: Ионизация аммиака в водном растворе описывается уравнением:
NH3(b) + HOH = NH4+(a) + OH-
Константа основности Кb равна:

Так как Cb/Kb = 0,100/1,76·10-5 > 400, то степень ионизации аммиака αb
Протолитическая теория кислот и оснований
С признанием теории Аррениуса возникла возможность классификации кислот и оснований по характеру их диссоциации в растворах. С этой точки зрения кислотой следует считать электролит, в водном растворе, которого присутствуют гидратированные ионы водорода (ионы гидроксония). Основания в водных растворах отщепляют гидроксид – ион.
Характер кислотно-основного равновесия в неводных растворах имеет свои особенности.
В соответствии с теорией сольвосистем это равновесие должно удовлетворять условию.
Эти представления позволили дать определенную классификацию взаимодействий в неводных растворителях, но такой подход был формальным и теория сольвосистем не получила широкого распространения.
В основу современных теорий кислот и оснований положены представления Бренстеда-Лоури и Льюиса.
По протонной теории кислот и оснований Бренстеда-Лоури, (1923 г.), кислота является донором протона, а основание – акцептором протона. Протон не может существовать в растворе самостоятельно, он должен быть принят основанием, поэтому, чтобы кислота могла отдать протон, необходимо присутствие основания, к которому протон переходит. Возникают кислотно- основные пары, которые называют сопряженными. Следовательно, каждая кислота имеет сопряженное с ней основание и каждое основание — сопряженную с ним кислоту.
Реакция отдачи протона выражается схемой:

Реакция принятия протона выражается схемой:
Основание 2 + H + = Кислота 2



кислота 1 основание2 основание 1 кислота 2

основание2 кислота 2
В приведенном равновесии участвуют две пары кислот и оснований: сопряженными кислотой и основанием являются:
К кислотам и основаниям по теории Бренстеда-Лоури относятся не только молекулы, но и ионы.
Например, ионы аммония и гидросульфат-ион является кислотами, так как они способны отщеплять протоны:


Ацетат – ион является основанием, так как он принимает протон

Одно и тоже вещество при растворении в разных растворителях может проявлять амфотерные свойства, то есть быть кислотой и основанием.
Например, в жидком аммиаке гидросульфид – ион HS — проявляет свойства кислоты:

находясь же в бромоводороде HS — , будет основанием:

основание кислота кислота основание
Во всех этих реакциях протон играет особую роль при взаимодействии кислот и оснований, поэтому, согласно теории Бренстеда-Лоури, кислоты и основания носят общие название – ПРОТОЛИТЫ, а реакции между ними — протолитические.
К протолитическим реакциям относят реакции нейтрализации, гидролиза, диссоциации кислот и оснований.

основание2 кислота1 кислота 2 основание 1

кислота 1 основание2 основание 1 кислота 2
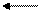

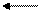

основание1 кислота2 кислота 1 основание 2

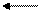

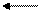
кислота 1 основание 2 кислота 2 основание 1
Механизм этих реакций один и тот же – в реакциях происходит перемещение протона от одних молекул или ионов к другим молекулам или ионом.
Протонная теория кислот и оснований Бренстеда-Лоури позволила достаточно четко разграничить эти два класса веществ и сделать целый ряд количественных выводов, касающихся характера кислотно-основного равновесия. Однако существуют вещества, которые обладают сильно выраженными кислотными и основными свойствами, но не могут быть отнесены к кислотам и основаниям из-за отсутствия протона по теории Бренстеда-Лоури. К числу таких веществ относятся, в частности, галогениды бора, алюминия, кремния, олова, обладающие кислотными свойствами.
Согласно электронной теории кислот и оснований Льюиса, кислота –акцептор электронной пары, а основание – донор.
Взаимодействие между кислотой и основанием с этой точки зрения заключается в возникновении ковалентной связи по донорно-акцепторному механизму:
Здесь донором электронной пары, т.е. основанием по Льюису, является аммиак, а в качестве кислоты выступает акцептор BF3
Протонная теория кислот и оснований Бренстеда-Лоури и электронная теория Льюиса дополняют друг друга и имеют глубокую внутреннюю связь. В определенном смысле кислоты, по Бренстеда-Лоури, представляют собой частный случай льнеисовских, поскольку протон характеризуется большим сродством к электронной паре и, по Льюису, может рассматриваться как сильная кислота.
Таким образом, общее свойство кислот и оснований, по Льюису и Бренстеду-Лоури, — способность к взаимной нейтрализации с образованием стабильных ковалентно – насыщенных соединений.
Вопросы для самоконтроля
1. Дать понятие: электролиты и неэлектролиты.
2. Сформулировать основные положения ТЭД.
3. Показать механизм ЭД на примере хлорида натрия.
4. Что называется степенью диссоциации?
5. Что называется константой диссоциации?
6. Как измениться степень диссоциации цеановодородной кислоты, если к раствору прибавить ее соль – цианид натрия?
7. Как измениться степень диссоциации гидрата аммиака, если к его раствору добавить нитрат аммония?
8. Что называется кислотой по теории Бренстеда-Лоури?
9. Что называется основанием Бренстеда-Лоури?
Лекция №12
Тема: Ионные реакции обмена. Гидролиз солей.
1. Химические реакции между электролитами.
2. Вода как слабый электролит. Понятие о рН растворов.
3. Гидролиз солей.
а) Понятие гидролиза и его значение.
б) Гидролиз соли, образованный катионом сильного основания и анионом
слабой кислоты
в) Гидролиз соли, образованный катионом слабого основания и анионом
сильной кислоты
г) Гидролиз соли образованный катионом слабого основания и анионом
слабой кислоты
д) Гидролиз соли образованный катионом сильного основания и анионом
сильной кислоты
е) Ступенчатый гидролиз
ж) Необратимый или полный гидролиз
1. Химические реакции между электролитами.
Многие химические реакции протекают в вводных растворах. Электролиты в водных растворах находятся в диссоциированном состоянии, т.е. или только в виде ионов (сильные электролиты) и частично в виде молекул (слабые электролиты). Следовательно, реакции между водными растворами электролитов — это реакции, в которых участвуют ионы. Взаимодействие ионов в растворе называется ионной реакцией.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Эти реакции возможны только в том случае, если между ионами происходит химическое взаимодействие, т.е. какие либо ионы одного электролита и какие либо ионы другого электролита связываются друг с другом и образуют:
— Малодиссоциирующие вещества (слабый электролит);
Ионное уравнение составляют в определенной последовательности:
— Пишут в ионном виде формулы диссоциирующих исходных веществ и в молекулярном — недиссоциирующих;
— То же правило соблюдается и для продуктов реакции;
— Проверяют, совпадают ли друг с другом по абсолютной величине суммы положительных и отрицательных зарядов ионов в левой части равенства, а затем в правой;
— Проверяют, совпадает ли число одноименных ионов в левой и правой частях равенства, учитывая атомы, входящие в состав недиссоциирующего вещества;
— Для составления сокращенного ионного уравнения исключают одноименные ионы из правой и левой частей уравнения, а затем записывают полученное сокращенное ионное уравнение, которое выражает сущность реакции.
Пример; написать уравнение реакции взаимодействия растворов хлорида бария и сульфата натрия в молекулярной, ионной и сокращенной ионной формах:
1. Записываем уравнение реакции в молекулярной форме:
2. Переписываем это уравнение в виде ионов (диссоциирующие вещества) и
в виде молекул (вещества, уходящие из сферы реакции):
Ва 2+ + 2С1 — + 2Na + + SO4 2 — = BaSO4 ↓ + 2Na + + 2Сl — полное ионное уравнение
3. Исключаем из обеих частей равенство одинаковые ионы, т.е. не
участвующие в реакции:
|
Ва 2+ + + 2Na + SO4 2- = BaSO4 + 2Na + +
4. Выписываем уравнение реакции в окончательном виде:
Сущность данной реакции — взаимодействии ионов Ва 2+ и SO4 2- с образованием осадка BaSO4.
Многочисленные реакции обмена в растворах электролитов могут быть обратимыми или необратимыми. Необратимые реакции характеризуются:
Ag + + NO — 3 + Н + + Cl — = AgCl + H + + NO — 3
— Образованием газообразных малорастворимых веществ
2Na + + CO 2- + 2Н + + SO 2 — 4 = 2Na + + SO 2 — 4 = 2Na + + SO 2 — 4 + CO2↑ + H2O
— Образованием малодиссоциирующих веществ (слабых электролитов)
НСl + КОН = КС1 + Н2O
Н + + Сl — + К + + ОН — = К + + С1 — + Н2O
— Образованием комплексных соединений (ионов)
Если в результате реакции образуется оба хорошо диссоциирующие вещества, реакция не протекает, т.к. никаких изменений с ионами не происходит:
2К + + 2Сl — + 2Na + SO 2 — 4 ≠2Na + + 2СГ + 2К + SO 2 — 4
2. Вода как слабый электролит. Понятие о рН растворов.
Вода как слабый электролит в малой степени диссоциирует на ионы, которые
находятся в равновесии с недиссоциированными молекулами:
концентрации ионов [Н + ] и [ОН — ] одинаковы. Опытным путем установлено, что в 1 л воды при t° = 22 °С диссоциации подвергаются лишь 10 -7 моль и при этом
образуется 10 -7 моль/л ионов Н + и 10 -7 моль/л ионов ОН — .
Произведение концентраций [Н + ] и [ОН — ] в воде называется ионным произведением воды (Кв). При t° = 22 °С численное значение Кв равно 10 -14 , это величина постоянная.
Кв = [Н + ] ∙ [ОН — ] = 10 -7 ∙ 10 -7 = 10 — 14
Постоянство произведения [Н + ] и [ОН — ] означает, что в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксид — ионов не может быть равна нулю. Для чистой воды [Н + ] = [ОН — ] = 10 -7 моль/л. Из постоянства произведения [Н + ] и [ОН — ] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять [Н + ], если известные [ОН — ] и наоборот. Например, если в водном растворе [Н + ] = 10 -3 моль/л, то
[ОН — ] = Кв : [Н + ] = 10 — 14 : 10 — 3 = 10 -11 моль/л, следовательно кислотность и щелочность раствора можно выразить через [H + ] либо [ОН — ]. Для кислого раствора [Н + ] > 10 -7 и для щелочного [Н + ] -7 моль/л.
Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН («пэ — аш»). Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов: рН = — lg[H + ], где [Н + ] концентрация ионов водорода, моль/л. С помощью рН реакция растворов характеризуется следующим образом: нейтральная рН = 7, кислая рН 7. Чем меньше рН, тем больше концентрация ионов Н + , т.е. выше кислотность среды; чем больше рН, тем меньше концентрация ионов Н + , т.е. выше щелочность среды.
Качественно реакцию среды и рН водных растворов электронов определяют с помощью индикаторов, меняющих свою окраску в определенном интервале рН.
Индикаторами называют вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора, т.е. рН раствора.
Индикаторный метод основан на сравнении окраски индикатора в испытуемом водном растворе с окраской его в условиях известной величины
Цвета индикаторов в различных средах
| Индикаторы | Среда раствора | ||
| Кислая рН 7 | |||
| Метилоранж | Красный | Оранжевый | Желтый |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
3. Гидролиз солей.
а) понятие гидролиза и его значение
Гидролизом соли называется взаимодействие ионов соли с ионами воды, которое приводит к образованию слабых электролитов.
Вода является слабым электролитом и диссоциирует по уравнению
В результате гидролиза солей их водные растворы показывают, кислую, щелочную или нейтральную реакцию среды. Реакция среды зависит от концентрации ионов водорода Н + или гидроксид-ионов ОН».
Появление избытка ионов Н + или ОН» в растворе объясняется тем, что
ионы соли реагируют с ионами воды. Равновесие диссоциации воды
смещается вправо, так как при гидролизе солей образуются слабые электролиты.
В зависимости от природы соли в растворе накапливаются либо ионы Н + , либо ОН — , которые и определяют реакцию среды.
Гидролиз соли — это реакция, обратная реакции нейтрализации, поэтому каждую соль можно представить себе как соединение, образованное основанием и кислотой. Кислоты и основания бывают сильными и слабыми электролитами. В зависимости от силы исходной кислоты и исходного основания различают четыре типа солей:
. образованные сильным основанием и слабой кислотой;
. образованные слабым основанием и сильной кислотой;
. образованные слабым основанием и слабой кислотой;
. образованные сильным основанием и сильной кислотой.
б) гидролиз соли, образованной катионом сильного основания и анионом слабой кислоты
В водном растворе цианида калия соль полностью распадается на ионы калия К + и цианид — ионы CN — . Ионы калия К + и гидроксид-ионы ОН — могут находиться в растворе одновременно в значительных количествах. Ионы водорода Н + и цианид — ионы CN — взаимодействуют между собой с образованием цианидводородной кислоты (Kq = 6,0 г х 10 -10 )
В результате гидролиза такой соли в растворе находятся полностью продиссоциированная щелочь и слабо диссоциированная кислота. Эта кислота частично диссоциирует на ионы и возвращает в раствор часть ионов Н + и CN». Возникает обратная реакция и устанавливается динамическое химическое равновесие.
Следовательно, реакция между цианидом калия и водой является обратимой и проходит не полностью. Такое явление называется обратимым гидролизом.
В результате того, что в растворе образуется сильный электролит гидроксид калия, концентрация гидроксид-ионов ОН — будет значительно больше концентрации ионов водорода Н + . В растворе соли возникает щелочная среда, т.е. рН > 7. Эксперимент показывает, что 0,1М раствор этой соли имеет рН 11,
1. Гидролиз цианида калия в сокращенной ионной форме:
Гидролиз соли, образованной катионом сильного основания и анионом слабой кислоты, идет по аниону слабой кислоты, и реакция среды становится щелочной.
в) гидролиз соли, образованной катионом слабого основания и анионом
сильной кислоты
Рассмотрим гидролиз соли — йодид аммония NH4J. При растворении этой соли в воде катион аммония связывает гидроксид-ион ОН — воды и ионы водорода накапливаются в растворе:

В результате гидролиза данной соли в растворе образуются слабое основание NH4OH и сильная кислота HJ. Йодоводородная кислота является сильным электролитом и в водном растворе полностью распадается на ионы. Концентрация ионов водорода становится значительно больше, чем концентрация гидроксид-ионов, и раствор соли имеет, кислую среду, т.е. рН — и Н + воды связываются с образованием слабой кислоты и слабого основания.
Гидролиз соли идет одновременно и по катиону и по аниону. В зависимости от константы диссоциации продуктов гидролиза (кислоты и основания) реакция среды растворов таких солей может быть слабокислой, слабощелочной или нейтральной. Реакция среды в случае гидролиза ацетата аммония CH3COONH4 — нейтральная, поскольку константы диссоциации СН3СООН и NH4OH равны.
Таким образом, гидролиз соли, образованной катионом слабого основания и анионом слабой кислоты, идет одновременно и по катиону и по аниону. Реакция среды зависит от констант диссоциации продуктов гидролиза.
д) гидролиз соли, образованной катионом сильного основания и анионом
сильной кислоты
Солиэтого типагидролизу не подвергаются, потому что катионы и анионы этих солей не связываются с ионами Н + и ОН», воды и в растворе не образуются молекулы слабых электролитов, поскольку связывания ионов воды не происходит, реакция среды растворов этих солей остается нейтральной.
Ионы соли не участвуют в реакции и среда остается нейтральной. Следовательно, соли, образованные катионом сильного основания и анионом сильной кислоты, при растворении в воде гидролизу не подвергаются , а реакция среды остается нейтральной.
е) ступенчатый гидролиз
Гидролиз соли, образованной анионом многоосновной кислоты или катионом слабого многокислотного основания протекает ступенчато. Число ступеней гидролиза зависит от основности слабой кислоты и кислотности слабого основания.
Рассмотрим гидролиз соли, образованной катионом сильного основания и анионом слабой многоосновной кислоты. На первой ступени гидролиза этой соли образуется кислая соль вместо кислоты и сильное основание.
Гидролиз протекает по аниону. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени. Среда раствора соли карбоната натрия — щелочная (рН>7), так как в растворе увеличивается концентрация гидроксид-ионов ОН — .
Гидролиз соли, образованной катионом слабого многокислотного основания и анионом сильной кислоты. В водных растворах таких солей на первой ступени образуется основная соль вместо основания и сильная кислота.
Дата добавления: 2016-11-22 ; просмотров: 2490 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://pandia.ru/text/80/167/16767.php
http://helpiks.org/8-75271.html