Химическое равновесие
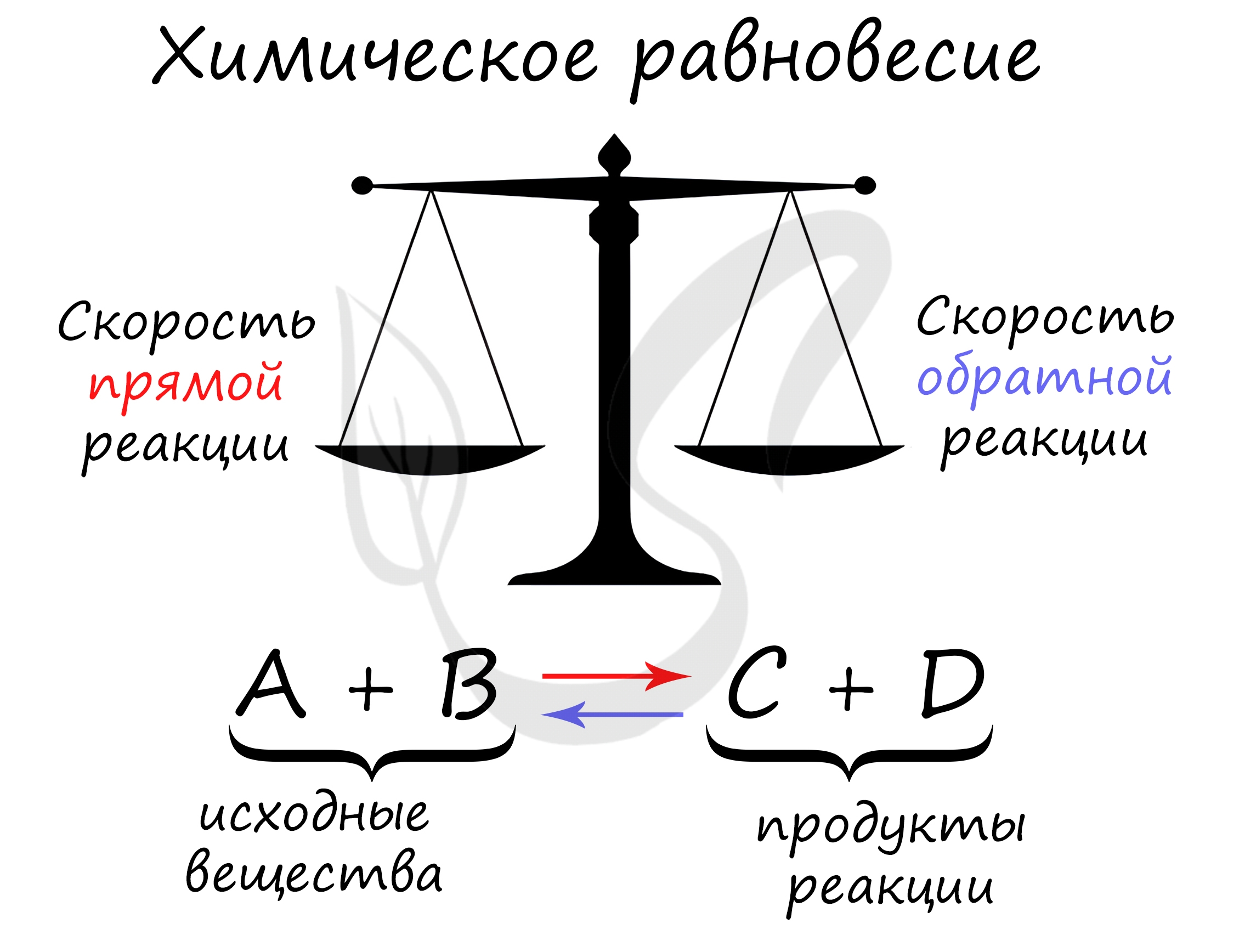
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
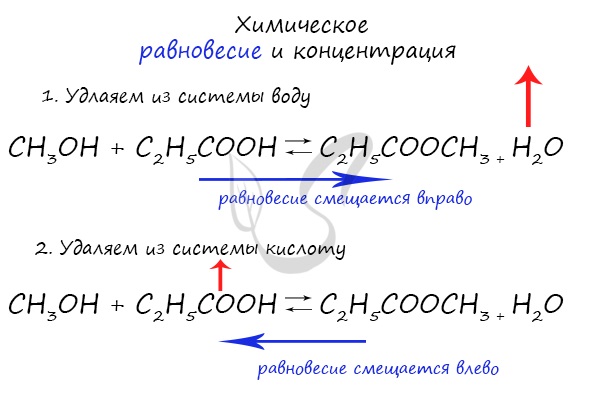
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
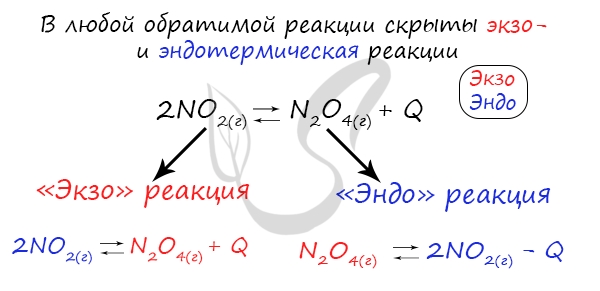
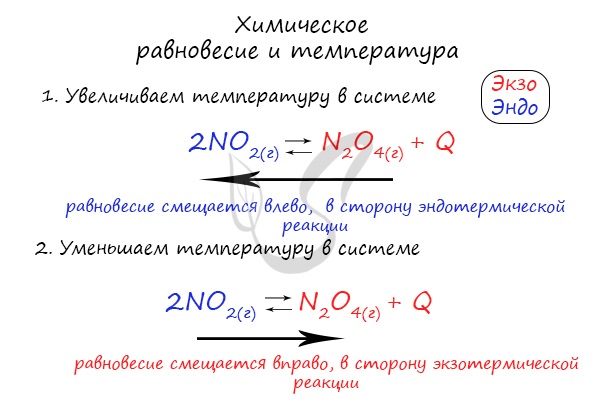
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Химическое равновесие
Содержание:
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическое равновесие
Как известно, по направлению реакции бывают обратными и необратимыми , Большая часть химических реакций обратима, т. е. протекает одновременно во взаимно противоположных направлениях.
Реакцию, протекающую слева направо, называют прямой « а справа налево — обратной.
Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия— концентрации всех реагирующих веществ перестанут изменяться во времени. На рисунке 45 показано изменение скоростей прямой и
обратной реакций с течением времени. Сначала при смещения исходных веществ скорость прямой реакции велика, а скорость обратной — равна нулю. По мере протекания реакции исходные вещества расходуются и их концентрации падают. В результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакций и их концентрация возрастает. Вследствие этого начинает
идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. В состоянии равновесия за единицу времени образуется такое же количество молекул продуктов реакции, какое превращается в исходные вещества.
Химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакций становятся равными.
Прямая и обратная реакции идут дальше, не прекращаясь, поэтому равновесие называют динамичным
При постоянных температуре и давление равновесие обратимой реакций может сохраняться неопределенно долгое время. Состояние равновесия обратимого процесса характеризуется константой равновесия.
Например, для записанной в общем виде обратимой химической реакции;
согласно закону действия масс, скорости прямой

Концентрации реагентов и продуктов. отвечающие состоянию равновесия. называют равновесными н обозначают символами 


следовательно. 
Отношение константы скоростей прямой и обратной реакций при постоянной температуре называют константой химического равновесия
Данное уравнение является математическим выражением закона действующих масс при химическом равновесии.
Напишем выражение константы равновесия для реакции синтеза нодоводорода:
откуда
В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции;

константа равновесия имеет вид:
Численное значение константы равновесия характеризует выход продуктов реакции. Чем больше константа равновесия, тем полнее исходные вещества (А и В) превращаются в продукты реакции (С и D), т. е. тем больше выход продуктов реакции. Таким образом, при

Большая часть химических реакций обратима, т. е. протекает одновременно во взаимно противоположных направлениях.
Обратимыми называют химические реакции, протекающие в данной температуре одновременно как в сторону образования проектов (прямая), так и в сторону их распада (обратная). В состоянии равновесия за еденицу времени образуется такое же количество молекул продуктов реакции, какое превращается в исходные вещества. Химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реации становятся равными. Состояние равновесия обратимого процесса характеризуется константой равновесия . Численное значение константы равновесия характеризует выход продуктов реакции.
Факторы, влияющие на смещение химического равновесия
Химическое равновесие при неизменных условиях может сохраняться сколько угодно долго, но при изменении температуры, давления или концентрации реагентов равновесие может “сместиться” в ту или иную сторону протекания процесса. Направление смешения равновесия сформулировал в 1885 г. французский ученый Ле Шателье. а в 1887 г. теоретически обосновал немецкий ученый Ф, Браун: если изменишь одно из условий (температуру, давление юн концентрацию^, при котором система находится в равновесие смещается в реакции, которая противодействует этому изменению. Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением или сдвигам равновесия.
Рассмотрим применение принципа Ле Шателье — Брауна к различным типам воздействия.
Влияние изменения концентрации
Если в равновесной системе увеличить концентрацию одного из реагирующих веществ, то равновесие сдвинется в направлении той реакции, при которой количество этого вещества уменьшается. Например, при введении дополнительного количества азота равновесие реакции синтеза аммиака сместится вправо — в направлении уменьшения концентрации азота и образования большого количества аммиака:
Влияние изменения давления
Синтез аммиака из водорода и азота сопровождается уменьшением объема. При повышении давления равновесие реакции смещается в направлении образования аммиака, и. наоборот, понижение давления способствует смешению равновесия влево — в направление разложения аммиака.
При повышении давления равновесие реакции смещается в направлении образования веществ, занимающих меньший объем, и, наоборот, понижение давления способствует процессу, сопровождающемуся увеличением объема.
Влияние изменения температуры
При повышении температуры ускоряются как прямая, так и обратная реакции, но в различной степени. При этом эндотермический процесс ускоряется больше, чем экзотермический. При понижении температуры в системе из двух реакции быстрее протекает экзотермическая, поэтому равновесие экзотермической реакции при повышении температуры смещается в сторону исходных веществ, а эндотермической — в сторону продуктов реакции. Рассмотрим реакцию синтеза аммиака:
Из уравнения реакции видим, что процесс образования аммиака является экзотермическим. а разложение аммиака — эндотермическим. При повышении температуры равновесие этой реакции смешается влево. в направлении реакции разложения аммиака, которая проходит с поглощением тепла. Наоборот, охлаждение смешает равновесие вправо, в направлении образования аммиака. Эта реакция идет с выделением тепла и противодействует охлаждению.
Влияние катализаторов
Катализаторы одинаково ускоряют как прямую, так л обратную реакции, поэтому на смещение химического равновесия не влияют, а только способствуют более быстрому его установлению.
Необходимо отметить, что равновесие под влиянием изменения давления смещается лишь в том случае, когда в реакции происходит газообразование вещества и реакция сопровождается изменением общего числа молекул. Если общее число молекул в процессе реакции не изменяется, то увеличение или уменьшение давления не влияет на равновесие этой реакции. Например, в реакции синтеза бромо-водорода:
Принцип Ле Шателье — Брауна можно применить к таким реакциям. в которых реагирующие вещества находятся в разных агрегатных состояниях. Например, в обратимой химической реакции:
Повышение температуры будет смещать равновесие этой реакшш в направлении эндотермического процесса — образования монооксида углерода.
Повышение давления будет смещать равновесие в направлении превращения монооксида углерода в его диоксид.
Что же касается влияния изменения концентрации компонентов на равновесие системы, то на смешении равновесия будут сказываться только концентрации газообразных веществ реакции.
Принцип Ле Шателье — Брауна применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации. плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье — Брау на и расчеты, вытекающие то закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход целевых продуктов.
При увеличении концентрации одного из реагирующих веществ равновесие сдвинется в сторону образования продуктов реакции. При повышении давления ф равновесие реакции смещается в направлении образования вешеств, занимающих меньший объем, и. наоборот. понижение давления способствует процессу, сопровождающемуся увеличением объема. Повышение температуры смешает химическое равновесие в сторону эндотермического. а понижение температуры — в направлении экзотермического процессов. Катализаторы одинаково ускоряют как прямую, так и обратную реакции, поэтому на смещение химического равновесия не влияют, а только способствуют более быстрому его установлению.
Химическое равновесие и его определение
Обратимые и необратимые реакции. Константа химического равновесия, ее зависимость от температуры и природы реагирующих веществ. Энтропия и изменение энтропии. Энергия Гиббса.
Обратимые и необратимые реакции
Термохимические уравнения реакций являются количественным выражением закона сохранения массы-энергии и позволяют глубже проанализировать характер химических превращений, чем это доступно при использовании уравнений баланса массы веществ, вступающих в реакцию и образующихся после нее. По величине и знаку теплового эффекта реакции, вычисленного по таблицам, можно, не проводя опыта, установить, будет ли идти при обычной температуре тот или иной процесс.
Мысль о том, что в системе из всех возможных реакций преимущественной будет та, которая сопровождается наибольшим экзотермическим эффектом, высказывалась еще Ю. Томсеном (1854) и М. Бертло (1867). Этот критерий осуществимости процессов был назван принципом наибольшей работы или принципом Бертло, отождествляющим тем самым теплоту и работу. В ряде случаев принцип Бертло действительно подтверждается экспериментом. Например, при образовании галогенидов углерода 
экзотермичность взаимодействия переходит в эндотерми-чность, что согласуется с активностью этих процессов и с термической прочностью галогенидов. Так, 

Наиболее отчетливо принцип Бертло получил подтверждение на примерах необратимых реакций, идущих до конца и не способных изменить направление при изменении температуры и давления. Примером таких реакций может служить экзотермическое разложение нитроглицерина 
Этот процесс имеет характер взрыва, сопровождается выделением теплоты
Однако наряду с необратимыми превращениями существует бесчисленное множество химически обратимых реакций. Эти реакции, не объясняемые с позиций принципа Бертло, при одних условиях температуры и давления идут в одном направлении, а при других — в обратном. Эти процессы нн в одном из направлений не идут до конца, а лишь до строго определенных соотношений исходных и получившихся продуктов. Такое состояние получило название химического равновесия.
Примерами химически обратимых процессов, идущих при постоянной температуре до состояния равновесия, могут служить термическое разложение гидроксида кальция (химический процесс)
и испарение воды (фазовое превращение)
В этих процессах каждому значению температуры соответствуют строго определенные значения давления водяного пара. При диссоциации 
Аналогичным примером обратимого процесса может служить растворение в воде азотнокислого аммония:
Этот процесс эндотермический и, согласно принципу Бертло, не должен идти. Опыт же показывает, что равновесная растворимость 
Эти и подобные им примеры иллюстрируют истинное химическое равновесие, которое характеризуется следующими признаками:
1) при отсутствии внешних воздействий состояние равновесия системы сохраняется во времени неизменным;
2) при изменении внешних воздействий (давления, температуры, концентрации веществ и т. д.) состояние системы изменяется, но при восстановлении исходных условий восстанавливается и исходное состояние.
Кроме истинного часто встречается так называемое ложное или замороженное равновесие. Примерами могут служить экзотермические процессы, лежащие в основе синтезов аммиака и серной кислоты:
Эти процессы при обычных условиях должны были бы идти, но не идут, создавая впечатление равновесных газовых смесей. Однако с введением соответствующих катализаторов эти реакции интенсивно развиваются вплоть до установления истинного химического равновесия.
Константа химического равновесия
Все приведенные выше примеры убеждают в том, что тепловой эффект реакции не может служить количественным критерием осуществимости химических реакций, мерой работы химических процессов. В поисках такого критерия было создано и развито стройное учение о химическом равновесии, основные положения которого будут изложены в этой и последующих главах. Одним из примеров равновесных химических превращений в смеси газообразных веществ может служить взаимодействие

Очевидно, для акта химического взаимодействия необходимы столкновения молекул 
Положим, имеется 





Точно так же общее число столкновений 

Здесь 


Вместо числа частиц 

где 

Однако столкновения частиц еще не определяют возможности их химического взаимодействия. Большинство таких столкновений носит упругий характер, похожий на столкновения биллиардных шаров. И только соударения наиболее энергичных молекул, которые за счет энергии столкновения возбуждаются, приводят к химическому взаимодействию и химической перестройке молекул.
Каждый сорт молекул требует для такого возбуждения определенную энергию Е*. Схематически возбуждение молекул при соударении можно изобразить следующим образом:
Если кинетическая энергия соударений молекул углекислого газа и водорода будет меньше суммы то столкнувшиеся молекулы не перейдут в достаточно активное состояние и произойдет простое упругое столкновение частиц. Лишь те столкновения, энергия которых равна или больше суммы 
Из физики известен закон Максвелла — Больцмана, который в количественной форме характеризует распределение частиц по величинам их энергии. Согласно этому закону число частиц n*, обладающих энергией E*, выражается соотношением 
где n*—число частиц, обладающих энергией Е*, n — общее число частиц, R—газовая постоянная, Т—температура, е—основание натуральных логарифмов.
Объединив уравнения (5.2), (5.3) и (5.4), получим выражение для числа активных столкновений:
приводящих к образованию продуктов реакции (5.1). Поскольку эта реакция обратима, с появлением конечных продуктов 

где 

в основном определяются совокупностью двойных соударений реагирующих молекул, тройные соударения весьма редки.
Если общее количество вещества в рассматриваемой системе постоянно, то число химически активных соударений молекул, характеризующих прямую реакцию, со временем должно уменьшаться из-за снижения концентраций 



Таким образом, равновесное состояние характеризуется условием

следовательно, 
Перенесем символы равновесных концентраций в одну сторону от знака равенства, а все остальные — в другую: 
В таком случае левая часть уравнения (5.5) для данной системы веществ при заданной температуре представляет собой постоянную величину, получившую название константы химического равновесия (К). Константа равновесия зависит только от природы реагирующих веществ и температуры и не зависит от давления и концентрации реагирующих веществ. Следовательно, правая часть уравнения (5.5) может быть приравнена к величине константы химического равновесия, т. е. 
Уравнение (5.6) отражает объективный закон природы, получивший название закона действующих масс, который эмпирически был установлен К. Гульдбергом и П. Вааге (1864 —1867). Этот закон является фундаментом учения о химическом равновесии и важнейшей составной частью дисциплины, называемой термодинамикой.
Одно из следствий закона действующих масс—правило смещения равновесий Ле Шателье (1884), которое формулируется следующим образом: если на равновесную систему произвести внешнее воздействие, то равновесие будет смещаться в направлении этого воздействия до тех пор, пока нарастающее в системе противодействие не станет равным внешнему действию.
Энтропия и изменение энтропии
Возвратимся к анализу выражения (5.5), его логарифмирование приводит к виду 
Умножив правую и левую части уравнения (5.7) на —RT, получим 
Рассмотрим подробнее слагаемые правой части уравнения (5.8). По условию 

Активным комплексом называют некоторую комбинацию атомов взаимодействующих веществ, обладающих максимумом энергии, которая с энергетическим выигрышем самопроизвольно распадается на продукты реакции.
Сочетая прямую и обратную реакции, получаем уравнение
Сравнение равновесия (5.9) с термохимическим уравнением
показывает, что 
что иное, как тепловой эффект реакции (5.1), т. е.

Вторым слагаемым в правой части уравнения (5.8) является произведение 

Следовательно, произведение 


Энтропия имеет размерность — Дж 
Неупорядоченность движения частиц, образующих данное вещество, принято характеризовать с помощью вероятности состояния (W), под которой понимают число осуществляющихся в каждый данный момент времени мимолетных состояний. Между вероятностью данного состояния вещества и его энтропией установлена количественная взаимосвязь (формула А. Больцмана):
где 
Само по себе число соударений характеризует лишь поступательное движение частиц газа и отвечающую ему энтропию поступательного движения. Внутри молекул образующие их атомы всегда находятся в относительном колебательном движении (даже при абсолютном нуле температуры сохраняются «нулевые» колебания). Этому внутримолекулярному колебательному движению соответствует колебательная составляющая энтропии, которая существенно зависит от числа атомов в молекуле, характера связей атомов в молекуле, и геометрии их взаимного расположения. Кроме этого, молекулы в целом или их части могут вращаться, этому вращательному движению соответствует вращательная составляющая энтропия.
Полная энтропия складывается из поступательной, колебательной и вращательной составляющих (в валентно-ненасыщенных соединениях есть еще так называемая электронная энтропия)
т. е. каждое вещество в соответствующем агрегатном состоянии наделено определенным, присущим только ему значением энтропии. Наиболее упорядоченное состояние вещества—кристаллическое, для него характерно наименьшее значение энтропии. Для жидкого и парообразного состояний соответствуют более высокие значения энтропии, так как в этом случае беспорядочность движения частиц возрастает. Например, энтропия 1 моль льда равна 47,95 э. е. при 0°С; жидкой воды—69,96 э. е., а водяного пара — 188,74 э. е. при 25 °С.
Энтропия как мера хаоса связана не только с движением, но и с числом частиц вещества, их массой и характером взаимного расположения. Так, 1 моль газообразного двухатомного фосфора 

С увеличением массы одинаковых по форме газообразных молекул в ряду 
Таким образом, в уравнении (5.8) выражение 

подставив стандартные значения энтропий, получаем
Если стехиометрические коэффициенты в уравнении реакции отличаются от единицы, то значение энтропии, относящееся к 1 моль, следует умножить на стехиометрический коэффициент.
Например, для процесса
изменение энтропии 

Энергия Гиббса. Учитывая все изложенное выше, равенство (5.8) можно записать так:

Левая часть уравнения (5.12) — 

второе состояние должно быть неравновесным и ему должен соответствовать другой, исходный уровень энергии 
здесь 
Символ 

Следовательно, величина работы зависит не только от равновесных концентраций, строго определенных природой реагирующих веществ и температурой, но и от значений исходных концентраций, которые могут быть выбраны произвольно. Для исключения такой неопределенности вводят условие стандартности исходных концентраций реагирующих веществ 

сравнивая которое с уравнением (5.12) и вводя условие температурной зависимости 
или приближенно (так как зависимость от температуры невелика)

Выражение (5.16) называют основным уравнением термодинамики, оно количественно связывает между собой закон действующих масс (К), тепловой эффект реакции 


Если равновесие устанавливается в газовой фазе или с участием газов, то при небольших давлениях, используя уравнение Менделеева — Клапейрона, можно перейти от парциальных молярных концентраций 
где

При условии 



где
в уравнении реакции перед газообразными компонентами [для реакции (
Следовательно, для газовых реакций (равновесий) основное уравнение термодинамики (5.12) принимает вид 
или
Смещение химического равновесия
Термодинамический анализ химических превращений. Смещение равновесия в системах при изменении температуры, давления и концентраций реагирующих веществ.
Учение о химическом равновесии, некоторые положения которого были изложены в предыдущей главе, являются составной частью термодинамики. В настоящее время наряду с термодинамикой равновесных систем успешно развивается термодинамика необратимых процессов, приобретающая большое значение в самых различных областях науки и техники, в частности при изучении биологических процессов. Химическая термодинамика—один из разделов термодинамики равновесных систем — вскрывает основные законы энергетики химического равновесия.
Термодинамический анализ химических и фазовых превращений позволяет, не прибегая к эксперименту, из всей совокупности возможных реакций сделать выбор реально осуществимых процессов и количественно определить их направление и глубину. Связь между термодинамическими характеристиками и равновесными концентрациями реагирующих веществ осуществляется с помощью константы химического равновесия (см. гл. 5).
Для понимания смысла константы химического или фазового равновесия и правильного использования этой характеристики необходимо ввести некоторые дополнительные понятия. Совокупность веек веществ, принимающих участие в химическом равновесии, принято называть системой. Систему называют равновесной, если в ней при одних и тех же температуре и давлении в течение дли-
тельного времени не происходят видимые химические или фазовые превращения, и если это состояние равновесия достигается в результате как прямой, так и обратной реакции.
Если вся совокупность свойств строго одинакова во всех частях системы, ее считают гомогенной. Например, равновесие 
устанавливается в гомогенной газовой системе. Точно так же для уксусной кислоты 
Этот раствор представляет единую равновесную, гомогенную систему молекулярных и ионных форм.
Систему, состоящую из двух и более фаз, называют гетерогенной. Например, термическое разложение кристаллического карбоната кальция

приводит к образованию новых веществ, которые в системе строго обособлены и образуют самостоятельные фазы с характерными для них наборами свойств, это одна газообразная фаза 

Фазы, входящие в состав любой системы, могут быть постоянной и переменной концентрации. Фазы постоянной концентрации —эхо индивидуальные химические соединения в твердом или жидком состояниях, для которых характерно постоянство относительных концентраций составных частей данной фазы (при постоянной температуре). С этих позиций индивидуальное вещество в газообразном состоянии 

Фаза переменной концентрации—это твердый, жидкий или газообразный раствор, концентрации составных частей
которого переменны в результате реакций, протекающих в растворе, или за счет внесения их извне, при условии неизменной гомогенности. Так, в гомогенной системе (6.1) в зависимости от температуры будут изменяться соотношения между концентрациями ионов 




Другим примером гетерогенного равновесия может служить восстановление твердого хлористого железа водородом при температурах 300—600°С: 
Металлическое железо и дихлорид железа не образуют твердых растворов, поэтому они индивидуальны. Являясь постоянными величинами, концентрации этих соединений не учитываются в величине константы равновесия. Следовательно, для процесса (6.3)
(6.3)

Численное значение константы равновесия зависит от способа выражения концентрации веществ:
1. Молярную концентрацию определяют числом молей растворенного вещества в единице объема раствора, в этом случае константу равновесия выражают через молярные концентрации и обозначают
2. Молярную долю 


а для идеального газового раствора 
Константу равновесия выражают через молярные доли, обозначая
3. Состав идеального газового раствора чаще характеризуют парциальными давлениями р;, сумма которых в газовой фазе равна общему давлению (закон Дальтона):
Константу равновесия, выраженную парциальными давлениями реагирующих веществ, обозначают 

а равновесие (6.2)—
Между константами К
где х, у, m, n—стехиометрические коэффициенты; А, В, D, Е — химические соединения. Согласно закону действующих масс 
Если система представляет собой идеальный газовый раствор и на нее распространяется закон Менделеева — Клапейрона, то парциальные давления и концентрации связаны соотношением
p=CRT. (6.7)
Подставив в выражение (6.6) значения С из уравнения (6.7), получим
а при вынесении общего множителя —
К системам, представленным жидкими или твердыми растворами, уравнение газового состояния (6.7) неприменимо, показатель степени в уравнении (6.8) теряет смысл, становясь равным нулю. Таким образом, для равновесий в конденсированных системах
Соотношение между 
Решим несколько конкретных задач.
Задача 1, Пользуясь табличными значениями для энтропии 
Запишем уравнение реакции и выражение для константы равновесия:
Теплоты образования и энтропии всех индивидуальных соединений этой системы, найденные из таблиц, имеют следующие значения:
Исходя из этих значений, вычислим 
Подставив численные значения 

получаем температуру разложения кальцита:
Экспериментальное определение температуры дает величину 989 °С, т. е. на 63° выше. Причина этой ошибки кроется в том, что в решении задачи не учтена температурная зависимость 
Задача 2. Определить значения 
Известно, что в нормальной точке кипения, т. е. при 373 К, давление насыщенного пара воды равно 

Работа, необходимая для осуществления процесса испарения при заданном условии, будет равна

Решая совместно систему уравнений (6.9) и (6.10) для процесса испарения воды при температуре 20 °С, находим
Задача 3. Определить, при каком общем давлении выход аммиака при его синтезе из азота и водорода составит молярных 90%, считая газ идеальным при любых давлениях. Температура реакционной смеси 400 °С. Соотношение парциальных давлений водорода и азота в исходной смеси равно 3.
Напишем уравнение реакции синтеза аммиака и выражение его константы равновесия:

Используя термодинамические характеристики всех участников процесса:
получаем
Подставив значения 
Значение 
Выход аммиака по условию составляет 90%, следовательно, 
По условию задачи в исходной смеси отношение парциальных давлений водорода 
С образованием аммиака равновесные значения давления водорода и азота будут меньше исходных, т. е.
Решая систему уравнений (6.11), (6.12) и (6.13), находим парциальные давления 
Смещение равновесия в системах
Ранее было сформулировано правило смещения равновесия Ле Шателье, оно справедливо в отношении всех равновесных систем. Из основного уравнения термодинамики 
где второй сомножитель—бестемпературный коэффициент. Знак (+ или —) величины 

Степень и направление температурного смещения равновесия, как это видно из уравнения (6.14), зависит только от знака и величины 


В качестве примера рассмотрим процесс разложения карбоната кадмия. Этот процесс зндотермичен и сопровождается ростом энтропии (реакция идет с увеличением числа газовых молей):

Используя основное уравнение термодинамики (5.12), находим
При подстановке численных значений температуры в уравнение (6.16) получаем значения константы равновесия (в Па): 
Для сравнения рассмотрим процесс, характеризующийся близким к процессу (6.15) значением теплового эффекта, но резко отличной величиной
Используя имеющиеся данные, напишем основное уравнение термодинамики и определим величину константы равновесия:
В процессе (6.17) значение 

Рассмотрим, как смещаются равновесия под воздействием изменения давления и концентраций. Выше отмечалось, что в пределах не очень больших давлений и концентраций константа равновесия не зависит от их изменения. Но входящие в выражение константы равновесия значения равновесных давлений газообразных соединений могут существенно изменяться, т. е. равновесие может смещаться в ту или иную сторону.
Рассмотрим в качестве примера реакцию получения водяного газа:

Запишем для этого процесса уравнение 

Общее давление в системе идеальных газов согласно закону Дальтона выражается суммой парциальных давлений:

Из стехиометрии процесса (6.19) следует, что
Решая систему уравнений (6.20), (6.21) и (6.22), определим парциальные давления всех компонентов системы и вычислим степени взаимодействия:
После подстановки вычисленных значений парциальных давлений получается выражение
Как видно из уравнения (6.23) степень прохождения реакции а должна зависеть от


Из примера следует, что с ростом давления уменьшается степень (или глубина) прохождения реакции и равновесие смещается в направлении исходных веществ.
Особенностью реакции (6.19) является то, что она идет слева направо с увеличением числа газообразных молекул. Именно поэтому возрастание общего давления в системе приводит к смещению равновесия в направлении уменьшения числа газовых частиц.
Если реакция идет без изменения числа газовых молекул, то степень ее прохождения не зависит от общего давления, например:
Решая совместно три уравнения (6.24) и (6.25), находим
т. е. в выражении для степени прохождения реакции (6.24) отсутствует характеристика общего давления.
Если реакция идет не в газовой фазе, а в растворе, то вместо характеристики исходного давления в системе следует использовать исходную концентрацию вещества 
характеризуется следующим выражением для константы равновесия:
Поскольку уксусная кислота является слабым электролитом и процесс (6.26) идет неглубоко, можно приближенно считать, что 


Необратимые процессы
Разновидностью химических реакций являются необратимые процессы, которые будучи проведены в прямом направлении не могут быть смещены в обратном только за счет изменения температуры и давления. В качестве примера рассмотрим широко известную необратимую реакцию горения угля в смеси с бертолетовой солью:
Для этого процесса, согласно данным таблиц, 




С необратимыми реакциями не следует смешивать процессы обратимые, но при данных условиях практически до конца смещенные в одну из сторон. Например, при комнатной температуре невозможно заметить даже следов атомарного кислорода, образующегося за счет реакции
Однако при высоких температурах порядка 3000 К и выше это равновесие смещается в направлении образования атомарного кислорода и процесс этот обратим
Одной из важнейших особенностей химического равновесия в сложных системах, где одновременно устанавливается не одно, а несколько равновесий, является взаимная зависимость этих равновесий, их аддитивность (простое сложение). Например, мало растворимая соль
Константа этого равновесия при 25 °С равна 
а энергия Гиббса, вычисленная с использованием этого значения, составит
Но комплексный аннон 

* Процессы могут быть экзо- или эндоэргичными, если они характеризуются отрицательными или положительными знаками 
Константа равновесия (6.29) равна:
Равновесия (6.27) и (6.29) связаны между собой общей для них концентрацией 
Константа равновесия (6.31) равна произведению констант равновесий (6.28) и (6.30):
а энергия Гиббса 

Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://chemege.ru/ravnovesie/
http://natalibrilenova.ru/himicheskoe-ravnovesie/