Уравнения реакции для которых в стандартных изобарно
Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1% разбавили водой до объема 400 мл. Молярная концентрация эквивалентов 
Уравнения реакций, для которых в стандартных изобарно-изотермических условиях 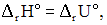
Процесс, протекающий при постоянном значении количества теплоты в системе, называется …
Уравнения реакций, в результате которых происходит образование коллоидных растворов методом химической конденсации, имеют вид …
Процесс нейтрализации электрического заряда и удаления гидратной оболочки коллоидных частиц, в результате которого происходит образование осадка, называется …
Уравнения реакций, в которых при изменении давления не происходит смещения равновесия, имеют вид …
Противоионы, не входящие в состав коллоидной частицы (гранулы), образуют слой, который называется …
Уравнения процессов, для которых при увеличении температуры равновесие смещается в сторону продуктов реакции, имеют вид …
При этерификации пропионовой кислоты этанолом в качестве органического продукта реакции образуется …
Уравнение 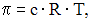
Тема заданий 15. Основы химической термодинамики (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 |
Дидактическая единица 4. Физическая и коллоидная химия
Тема заданий 15. Основы химической термодинамики
ЗАДАНИЕ N 15.1 ( — выберите один вариант ответа)
Система, для которой термодинамические параметры во всех точках сохраняют свое постоянное значение, находится в _______ состоянии.
ЗАДАНИЕ N 15.2 ( — выберите один вариант ответа)
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает ________ закон термодинамики.
ЗАДАНИЕ N 15.3 ( — выберите один вариант ответа)
Из первого начала термодинамики следует, что в любой изолированной системе запас внутренней энергии ______ .
совершает колебательные изменения
ЗАДАНИЕ N 15.4 ( — выберите один вариант ответа)
Согласно второму началу термодинамики в изолированных системах самопроизвольно протекают процессы, для которых справедливо выражение… ВАРИАНТЫ ОТВЕТОВ:
ΔH — выберите один вариант ответа)
Согласно второму началу термодинамики, состояние равновесия реализуется в изолированных системах, для которых справедливо выражение…
ЗАДАНИЕ N 15.6 ( — выберите один вариант ответа)
Согласно второму началу термодинамики в изобарно-изотермических системах самопроизвольно протекают процессы, для которых справедливо выражение… ВАРИАНТЫ ОТВЕТОВ:
ΔH — выберите один вариант ответа)
Согласно основным положениям термодинамики, для состояния равновесия в изобарно-изотермических системах справедливо выражение…
ΔG — выберите один вариант ответа)
Процесс перехода системы из одного состояния в другое при постоянном давлении называется …
ЗАДАНИЕ N 15.9( — выберите один вариант ответа)
Процесс, протекающий при постоянном значении количества теплоты в системе, называется …
ЗАДАНИЕ N 15.10 ( -укажите не менее двух вариантов ответа)
Уравнения реакций, для которых в изобарно-изотермических условиях ∆rH = ∆rU, имеют вид…
Fe2O3(т) + 3C(т) = 2Fe(т) + 3CO(г)
CO(г) + 2H2(г) = CH3OH(г)
ЗАДАНИЕ N 15.11 ( — выберите один вариант ответа)
Энтальпия образования СаСО3 соответствует тепловому эффекту реакции …
ЗАДАНИЕ N 15.12 ( — выберите один вариант ответа)
Исходя из уравнения реакции 

ЗАДАНИЕ N 15.13 ( — выберите один вариант ответа)
Формула для расчета теплового эффекта химической реакции 
1)
2)
3)
4)
ЗАДАНИЕ N 15.14 ( — выберите один вариант ответа)
Если энтальпия образования SO2 равна -297 кДж/моль, тогда количество теплоты, выделяемое при сгорании 16 г серы, равно…
Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
http://pandia.ru/text/80/136/33116.php
http://chemege.ru/energy-zakon-gessa/










