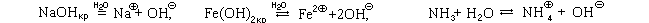Химические свойства основных классов неорганических соединений
Кислотные оксиды
Кислотный оксид + вода = кислота (исключение — SiO 2 )
SO 3 + H 2 O = H 2 SO 4
Cl 2 O 7 + H 2 O = 2HClO 4
Кислотный оксид + щелочь = соль + вода
SO 2 + 2NaOH = Na 2 SO 3 + H 2 O
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
Кислотный оксид + основный оксид = соль
CO 2 + BaO = BaCO 3
SiO 2 + K 2 O = K 2 SiO 3
Основные оксиды
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H 2 O = Ca(OH) 2
Na 2 O + H 2 O = 2NaOH
Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl 2 + H 2 O
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Основный оксид + кислотный оксид = соль
MgO + CO 2 = MgCO 3
Na 2 O + N 2 O 5 = 2NaNO 3
Амфотерные оксиды
Амфотерный оксид + кислота = соль + вода
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K 2 ZnO 2 + H 2 O (Правильнее: ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ])
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O (Правильнее: Al 2 O 3 + 2NaOH + 3H 2 O = 2Na[Al(OH) 4 ])
Амфотерный оксид + кислотный оксид = соль
ZnO + CO 2 = ZnCO 3
Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na 2 O = Na 2 ZnO 2
Al 2 O 3 + K 2 O = 2KAlO 2
Cr 2 O 3 + CaO = Ca(CrO 2 ) 2
Кислоты
Кислота + основный оксид = соль + вода
2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
3H 2 SO 4 + Fe 2 O 3 = Fe 2 (SO 4 ) 3 + 3H 2 O
Кислота + амфотерный оксид = соль + вода
3H 2 SO 4 + Cr 2 O 3 = Cr 2 (SO 4 ) 3 + 3H 2 O
2HBr + ZnO = ZnBr 2 + H 2 O
Кислота + основание = соль + вода
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O
2HBr + Ni(OH) 2 = NiBr 2 + 2H 2 O
Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH) 3 = CrCl 3 + 3H 2 O
2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO 3 = CaBr 2 + H 2 O + CO 2
H 2 S + K 2 SiO 3 = K 2 S + H 2 SiO 3
2HCl + Zn = ZnCl 2 + H 2
H 2 SO 4 (разб.) + Fe = FeSO 4 + H 2
Важно: кислоты-окислители (HNO 3 , конц. H 2 SO 4 ) реагируют с металлами по-другому.
Амфотерные гидроксиды
Амфотерный гидроксид + кислота = соль + вода
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 6H 2 O
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH) 2 + 2NaOH = Na 2 ZnO 2 + 2H 2 O
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O
Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
Sn(OH) 2 + 2NaOH = Na 2 [Sn(OH) 4 ]
Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
Щелочи
Щелочь + кислотный оксид = соль + вода
Ba(OH) 2 + N 2 O 5 = Ba(NO 3 ) 2 + H 2 O
2NaOH + CO 2 = Na 2 СO 3 + H 2 O
Щелочь + кислота = соль + вода
3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O
Bа(OH) 2 + 2HNO 3 = Ba(NO 3 ) 2 + 2H 2 O
Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na 2 ZnO 2 + H 2 O (Правильнее: 2NaOH + ZnO + H 2 O = Na 2 [Zn(OH) 4 ])
Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH) 2 = Na 2 [Zn(OH) 4 ]
NaOH + Al(OH) 3 = Na[Al(OH) 4 ]
Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH) 2 + Cu(NO 3 ) 2 = Cu(OH) 2 + Ca(NO 3 ) 2
3KOH + FeCl 3 = Fe(OH) 3 + 3KCl
Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H 2 O = Na 2 [Zn(OH) 4 ] + H 2
2KOH + 2Al + 6H 2 O = 2K[Al(OH) 4 ] + 3H 2
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na 2 SiO 3 + 2HNO 3 = 2NaNO 3 + H 2 SiO 3
BaCO 3 + 2HCl = BaCl 2 + H 2 O + CO 2 (H 2 CO 3 )
Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO 3 ) 2 + K 2 S = PbS + 2KNO 3
СaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl
Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO 3 ) 2 + 2NaOH = 2NaNO 3 + Cu(OH) 2
2FeCl 3 + 3Ba(OH) 2 = 3BaCl 2 + 2Fe(OH) 3
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO 4 = ZnSO 4 + Cu
Cu + 2AgNO 3 = Cu(NO 3 ) 2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Уравнения реакции характеризующие химические свойства веществ
К основаниям относятся:
а) ионные гидроксиды, соответствующие основным оксидам (см. § 13.4);
б) некоторые не содержащие гидроксидных ионов вещества, молекулы которых способны принимать протон (аммиак NH3, гидразин N2H4 и некоторые другие соединения).
Частицами-основаниями в этих веществах являются или гидроксид-ионы (а), или сами молекулы оснований (б).
Все основания удобно разделить на три группы: I — растворимые ионные основания (щелочи), II — нерастворимые (то есть очень мало растворимые) основания и III — молекулярные основания.
Все растворимые ионные основания (щелочи) являются сильными основаниями. Из нерастворимых гидроксидов слабыми являются только те, которые в той или иной степени проявляют амфотерные свойства. Все молекулярные основания — слабые.
Основания I группы в воде химически растворяются, основания II группы также химически растворяются в воде, но крайне незначительно, а растворение оснований III группы — отчасти физическое, а отчасти химическое (часть растворившихся молекул обратимо реагирует с водой):
.
По той или иной причине в растворах оснований присутствуют гидроксид-ионы, поэтому растворы оснований I и III группы изменяют окраску кислотно-основных индикаторов.
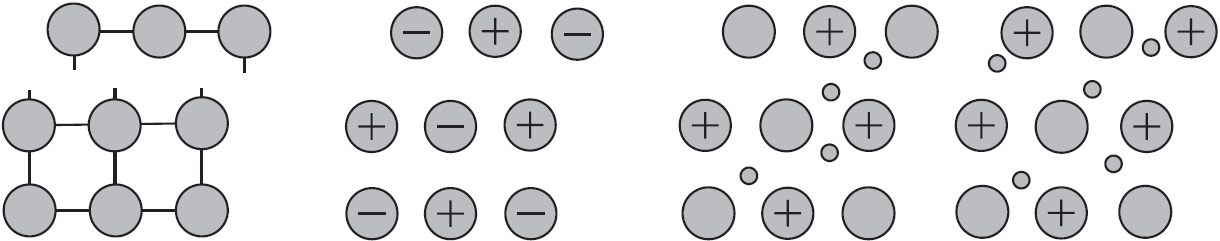
Реакции, характеризующие химические свойства оснований, распадаются на две группы. К первой относятся КОР, связанные с наличием в составе оснований частиц, способных принимать протон (частиц-оснований). Это реакции с веществами, содержащими частицы-кислоты или амфолиты (см. рис. 12.1): с сильными кислотами, со слабыми кислотами (в том числе с катионными) и с кислыми солями.
1) Все основания реагируют с растворами сильных кислот, то есть с растворами, содержащими ионы оксония.
OH + H3O
= 2H2O, Fe(OH)2 + 2H3O
= Fe 2
+ 4H2O, NH3 + H3O
= NH4
+ H2O,
NaOHр + HNO3р = NaNO3р + H2O, Fe(OH)2 + 2HClр = FeCl2р + 2H2O, NH3 + HClO4р = NH4ClO4р.
1а) Сильные основания реагируют и со слабыми кислотами:
OH + HNO2 = H2O + NO2
, 2OH
+ H2SiO3 = 2H2O + SiO3 2
,
KOHp + HNO2p = H2O + KNO2p, 2KOHp + H2SiO3 = 2H2O + K2SiO3p.
Возможность реакции слабого основания со слабой кислотой определяется общим правилом, определяющим направление протекания КОР.
Кислотно-основные реакции между веществами-основаниями и веществами-кислотами могут протекать и в отсутствие воды:
KOHкр + H3PO4ж = KH2PO4кр + H2O; Mg(OH)2кр + 2HClг = MgCl2кр + 2H2O; NH3г + HClг = NH4Clкр.
Правда, практическое значение эти реакции имеют только для оснований III группы, так как в остальных случаях вода образуется сразу после начала реакции.
2) Растворимые основания реагируют с растворами кислых солей, содержащими как анионы-амфолиты, так и гидросульфат-ион и подобные ему частицы-кислоты:
OH + HCO3
= H2O + CO3 2
, NH3 + HSO4
= NH4
+ SO4 2
,
NaOHр + NaHCO3р = H2O + Na2CO3р; 2NH3 + 2NaHSO4р = Na2SO4p + (NH4)2SO4p.
Гидросульфаты, кроме того, реагируют и с нерастворимыми основаниями.
3) Растворимые основания реагируют с растворами солей, в состав которых входят катионные кислоты:
| 2OH |
| 2OH |
| 2NaOHp + FeSO4p = Fe(OH)2 |
| 2NH3 + [Mg(H2O)4] 2 |
| 2NH3 + 2H2O + Mg 2 |
| 2NH3 + 2H2O + MgSO4aq = Mg(OH)2 |
Упрощенно эти реакции можно рассматривать как реакции осаждения из растворов нерастворимых гидроксидов.
Растворы щелочей реагируют с растворами солей, в состав которых входят катионные кислоты и другого типа, иными словами, в том случае, когда при реакции образуется растворимое слабое основание:
OH + NH4
= H2O + NH3, 2KOH + (NH4)2SO4 = K2SO4 + 2NH3 + 2H2O.
В приведенной реакции из концентрированных растворов или при нагревании аммиак может выделяться в виде газа. Выделение аммиака происходит полнее, если концентрированным раствором щелочи обработать твердый сульфат аммония.
Ко второй группе реакций относятся реакции, не являющиеся кислотно-основными и вызванные стремлением к делокализации заряда. Это реакции с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами.
4) Щелочи (и малорастворимые основания) реагируют с кислотными и амфотерными оксидами, при этом в реакции могут вступать, как твердые щелочи (или расплавы)
2KOH + SO3 = K2SO4 + H2O, 2NaOH + Cr2O3 = 2NaCrO2 + H2O (при нагревании),
так и их растворы
2OH + CO2 = CO3 2
+ H2O, 2OH
+ ZnO + H2O = [Zn(OH)4] 2
,
2NaOH + CO2 = Na2CO3 + H2O, 2KOH + ZnO + H2O = K2[Zn(OH)4].
Диоксид кремния с заметной скоростью реагирует только с расплавами щелочей:
SiO2кр + 2NaOHж = Na2SiO3 + H2O (при нагревании).
5) Щелочи реагируют с амфотерными гидроксидами:
2OH + Zn(OH)2 = [Zn(OH)4] 2
, 3OH
+ Cr(OH)3 = [Cr(OH)6] 3
,
2NaOHр + Zn(OH)2 = Na2[Zn(OH)4]р, 3KOHр + Cr(OH)3 = K3[Cr(OH)6]р.
В случае, когда гидроксид гидратирован (свежеосажденный и не высушенный), эти реакции относятся к кислотно-основным.
6) Особняком от первых двух групп реакций стоят реакции, в которых с концентрированными растворами щелочей реагируют амфотерные металлы и некоторые неметаллы:
2OH + Be + 2H2O = [Be(OH)4] 2
+H2
, 2OH
+ Cl2 = Cl
+ ClO
+ H2O,
2NaOHк + Be +2H2O = Na2[Be(OH)4]р +H2 , 2KOHк + Cl2 = KClр + KClOр + H2O.
7) Все нерастворимые гидроксиды (в том числе и основания) легко разлагаются при нагревании (примеры см. в § 2.5).
Растворимые и малорастворимые основания можно получить при взаимодействии с водой соответствующих металлов или оксидов, а нерастворимые — осаждением щелочью из растворов солей.

2.Составьте схему механизма реакции хлора с раствором щелочи (см. гл. 11.4)
3.Получите двумя способами а) гидроксид натрия, б) гидроксид кальция, в) гидроксид лития. 4.Получите из двух различных веществ а) гидроксид магния, б) гидроксид марганца(II), в) гидроксид меди(II).
5.Осуществите превращения: NiO NiSO4
Ni(OH)2
Ni(NO3)2.
6.Определите концентрацию гидроксида лития в растворе, 200 мл которого потребовалось для осаждения из раствора соли 1, 427 г гидроксида железа(III).

К кислотам относятся:
а) ковалентные гидроксиды, соответствующие кислотным оксидам (см. § 13.5) — кислородсодержащие кислоты;
б) ковалентные гидриды — бескислородные кислоты.(По традиции «кислотами» называют водные растворы ковалентных гидридов, например, раствор хлороводорода называют соляной (хлороводородной) кислотой, раствор сероводорода — сероводородной кислотой и т.п. Соответствующие безводные газообразные соединения «кислотами» не называют)
Кроме того, кислотами также являются некоторые ионные вещества, содержащие ионы оксония. Это устойчивые только при низких температурах » соли оксония» : (H3O)Cl, (H3O)Br, (H3O)2SO4 и некоторые другие. По химическим свойствам растворы этих » солей оксония» ничем не отличаются от растворов соответствующих молекулярных кислот — соляной, бромоводородной, серной и т. д.
Большинство кислотных гидроксидов (оксокислот) — молекулярные вещества. Исключение составляет нерастворимая в воде кремниевая кислота (ее состав только упрощенно отражается формулой H2SiO3) и некоторые другие кислоты.
Растворение кислот в воде — химическое растворение. При растворении кислоты в воде протекает КОР, необратимая в случае сильной кислоты и обратимая в случае слабой:
HNO3 + H2O = H3O + NO3
CH3COOH + H2O 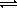
+ CH3COO
Способность кислот отдавать протоны определяет наиболее характерные химические свойства этих веществ:
1) Все кислоты реагируют с веществами, содержащими очень сильные частицы-основания: O 2 , N 3
и т. п. (см. рис. 12.2), то есть прежде всего с основными и амфотерными оксидами (примеры в § 13.4).
2) Все кислоты реагируют с растворами щелочей (примеры в § 13.7).
3) Растворы сильных кислот реагируют с солями и их растворами (содержат анионные основания)
H3O + NO2
= HNO2 + H2O,
H3O + CH3COONa = CH3COOH + Na
+ H2O,
HClр + KNO2р = HNO2р + KClр;
HClp + CH3COONaкр = CH3COOHp + NaClp.
Образующаяся слабая кислота может быть еще и нерастворимой или летучей:
2H3O + SiO3 2
= H2SiO3
+ 2H2O,
2H3O + FeS = Fe 2
+ H2O + H2S
,
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4,
2HBr + FeS = FeBr2 + H2S , что еще более способствует смещению равновесия вправо.
Летучие кислоты выделяются из реакционной смеси и в том случае, когда с безводной солью этой кислоты реагирует нелетучая (точнее, значительно менее летучая) кислота:
H2SO4конц + NaClкр = NaHSO4кр + HCl ,
H3PO4ж + CH3COONaкр = NaH2PO4кр + CH3COOH .
Если образующаяся слабая кислота неустойчива, при реакции выделяется газообразный кислотный оксид. В этом случае растворы сильных кислот реагируют и с нерастворимыми солями:
2H3O + CaCO3 = Ca 2
+ CO2
+ 3H2O,
2HNO3р + CaCO3кр = Ca(NO3)2р + CO2 + H2O.
Реакции между растворами солей и сильных кислот протекают и в тех случаях, когда образуется нерастворимая соль (§ 12.1):
Cl + Ag
= AgCl
,
HCl + AgNO3 = AgCl + HNO3.
4) Растворы сильных кислот реагируют с металлами, стоящими в ряду напряжений левее водорода (примеры в § 13.2).
5) Многие кислоты при нагревании разлагаются (примеры см. в § 2.5). Некоторые кислоты легко разлагаются даже в водных растворах:
H2CO3 = CO2 + H2O (при образовании практически полностью разлагается),
H2SO3 = SO2 + H2O (неустойчива в концентрированных растворах и при нагревании).
Растворимые оксокислоты можно получить при взаимодействии соответствующего кислотного оксида с водой. Слабые кислоты получаются из солей под действием сильных кислот.
Бескислородные кислоты получают, растворяя соответствующие гидриды в воде.

2.Приведите уравнения реакций, характеризующие химические свойства а) серной кислоты, б) кремниевой кислоты, в) соляной кислоты.
3.Осуществите превращения: Cl2 HCl
CaCl2
AgCl.
4.Сколько тонн 96 %-ной серной кислоты можно получить из 3 тонн серы при общем выходе продукта, равном 80 %?

Как амфотерные оксиды по свойствам близки к основным оксидам, так и амфотерные гидроксиды близки по свойствам к основным гидроксидам (основаниям). Отличие амфотерных гидроксидов — только в том, что они способны реагировать со щелочами.
Непосредственно эти реакции протекают только в растворах:
Zn(OH)2 + 2OH = [Zn(OH)4] 2
, Cr(OH)3 + 3OH
= [Cr(OH)6]3
,
Zn(OH)2 + 2NaOHр = Na2[Zn(OH)4]р, Cr(OH)3 + 3KOHр = K3[Cr(OH)6]р.
Конечно, амфотерные гидроксиды реагируют и с расплавами щелочей, но при этих температурах они разлагаются, и со щелочью реагируют уже соответствующие амфотерные оксиды (см. § 13.6).
Так как все амфотерные гидроксиды — нерастворимые вещества, получить их можно осаждением из растворов солей:
Zn 2 + 2OH
= Zn(OH)2
[Zn(OH)4] 2 + 2H3O
= Zn(OH)2
+ 4H2O.

а) Be BeO
Na2BeO2
BeCl2
Be(OH)2
Na2[Be(OH)4]
BeSO4;
б) Al Na[Al(H2O)2(OH)4]
Al(OH)3
Na3[Al(OH)6]
AlCl3
Al(OH)3
Al2O3 .

Как трудно провести границу между веществами с ионными и ковалентными связями, так не менее трудно выделить среди множества соединений те, которые мы называем солями. Тем не менее, все соединения, которые заведомо относятся к солям, представляют собой твердые (обычно кристаллические) вещества. По определению, связь в этих соединениях ионная. При этом не следует забывать, что в сложных катионах и анионах связь между атомами ковалентная.
Химические свойства солей определяются только свойствами ионов, входящих в их состав.
Важнейшие химические свойства средних солей:
1) растворимые соли могут реагировать с металлами (см § 13.2);
2) некоторые соли могут окисляться активными неметаллами:
2KI + Cl2 = 2KCl + I2,
2K2SO3 + O2 = 2K2SO4 (в растворе, медленно);
3) растворимые соли могут реагировать с растворами щелочей (см. § 13.7);
4) соли слабых кислот реагируют с сильными кислотами (см § 13.8);
5) в растворе соли могут реагировать между собой:
Ba 2 + SO4 2
= BaSO4
, Ag
+ Cl
= AgCl
,
BaCl2 + Na2SO4 = BaSO4 + 2NaCl,
AgNO3 + NaCl = AgCl + NaNO3;
6) некоторые соли при нагревании легко разлагаются
2KNO3 = 2KNO2 + O2 , MgCO3 = MgO + CO2
, NH4Cl = NH3
+ HCl
,
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
, NH4NO2 = N2
+ 2H2O
.
Как видно из приведенных примеров, реакции термического разложения разных солей очень сильно отличаются друг от друга, поэтому подробно с некоторыми типами этих реакций вы познакомитесь при изучении химии отдельных элементов.
Особенности химических свойств кислых и основных солей связаны с наличием в их составе ионов-амфолитов и заключаются в возможности реакций с растворами кислот и оснований:
NaHSO4р + NaOHр = Na2SO4р + H2O,
NaHCO3р + HClр = NaClр + CO2 + H2O,
Mg(OH)Cl + NaOHр = Mg(OH)2 + NaClр,
Mg(OH)Cl + HClр = MgCl2р + H2O.
Все кислые и основные соли разлагаются при нагревании. Здесь также много различных типов реакций:
2NaHCO3 = Na2CO3 + H2O + CO2
,
NH4HCO3 = NH3 + H2O
+ CO2
,
2Na2HPO4 = Na4P2O7 + H2O ,
(CuOH)2CO3 = 2CuO + CO2 + H2O
.
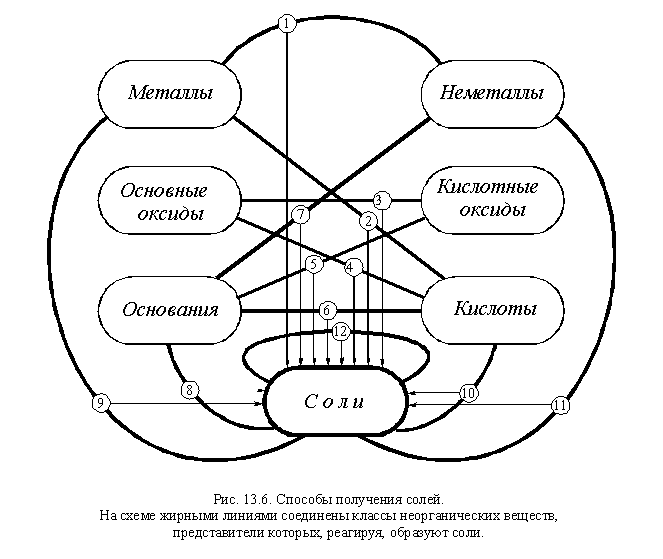
Изучая предыдущие параграфы этой главы, вы убедились в том, что соли образуются при самых разнообразных реакциях. Важнейшие способы получения средних солей в виде схемы представлены на рис. 13.6.
Таким образом, соли можно получить 12 важнейшими способами:
1) при взаимодействии металлов с неметаллами,
2) при взаимодействии металлов с кислотами,
3) при взаимодействии основных оксидов с кислотными оксидами,
4) при взаимодействии основных оксидов с кислотами,
5) при взаимодействии кислотных оксидов с основаниями,
6) при взаимодействии оснований с кислотами,
7) при взаимодействии неметаллов с основаниями,
8) при взаимодействии оснований с солями,
9) при взаимодействии металлов с солями,
10) при взаимодействии кислот с солями,
11) при взаимодействии неметаллов с солями,
12) при взаимодействии солей друг с другом.
Не все эти способы применимы к каждой соли, например: соли бескислородных кислот нельзя получить, используя способы 3 и 5, а соли металлов, стоящих в ряду напряжений правее водорода нельзя получить, используя способ 2. И наоборот, существует множество способов получения отдельных солей, не включенных в этот перечень.

2.Какими из 12 приведенных в тексте параграфа способами нельзя получить хлорид натрия? 
Вы изучили характерные свойства веществ, относящихся к важнейшим классам простых веществ и соединений. Но как определить, к какому классу относится данное конкретное вещество? Очень часто в этом может помочь естественная система элементов. Кроме того, ЕСЭ может помочь проследить усиление или ослабление тех или иных свойств аналогичных соединений разных элементов.
а) Простые вещества
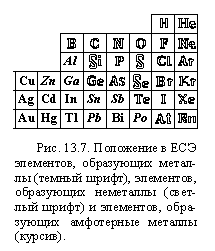
Где в таблице элементов проходит граница между простыми веществами-металлами и неметаллами, вы знаете (§ 2.5, § 7.14). Основываясь на типе химической связи, уточним эту границу. На рисунке 13.7 светлыми символами показаны элементы, в обычных условиях образующие простые вещества с ковалентными связями между атомами — неметаллы. Такими же символами обозначены элементы благородных газов, связи между атомами в которых — межмолекулярные. В простых веществах остальных элементов — связь металлическая.
По способности реагировать со щелочами среди металлов выделяют амфотерные металлы (символы их элементов набраны курсивом)(Кроме отмеченных в таблице слабо выраженные амфотерные свойства проявляют железо, титан и ниобий.Эти вещества могут реагировать со щелочью, но в очень жестких условиях. Некоторые металлы (например, кобальт) реагируют с расплавами щелочей в присутствии кислорода , то есть окисляются кислородом в шелочной среде, но это свойство уже не имеет отношение к амфотерности). Как видно из рисунка, они находятся на границе между металлами и неметаллами.
Важнейшие свойства металлов — восстановительные. При всей неравномерности изменения этих свойств в системе элементов самые сильные металлы-восстановители образованы элементами, расположенными в левом нижнем углу таблицы (их атомы наиболее склонны отдавать электроны).
Важнейшие свойства неметаллов — окислительные. Исключая VIIIА группу, окислительные свойства неметаллов возрастают снизу вверх и слева направо (в соответствии с возрастанием склонности к присоединению электронов их атомами).
Определение характера оксида по положению элемента в ЕСЭ осложнено тем, что элементы, как правило, образуют несколько оксидов (в разных степенях окисления). Например, хром образует следующие устойчивые оксиды:
CrO, оксид хрома(II) — основный оксид;
Cr2O3, оксид хрома(III) — амфотерный оксид;
CrO3, оксид хрома(VI) — кислотный оксид.
Как видите, с увеличением степени окисления характер оксида меняется, переходя от основного к кислотному. Эта закономерность наблюдается и у других элементов.
Состав высших оксидов (за исключением элементов VIIIВ и IB группы) зависит от номера группы:
Химические свойства простых веществ. Химические свойства сложных вещест
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
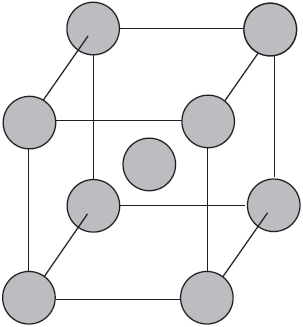
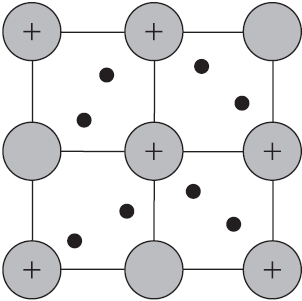
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
http://www.chem.msu.su/rus/school/zhukov1/13a.html
http://examer.ru/oge_po_himii/teoriya/himicheskie_svojstva_prostyh_veshhestv