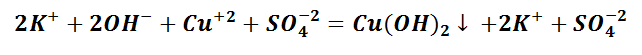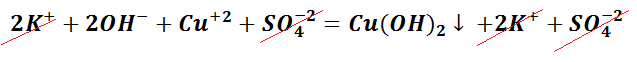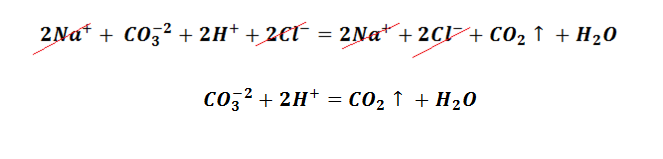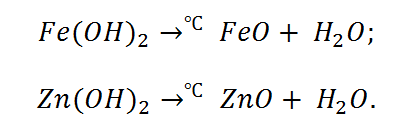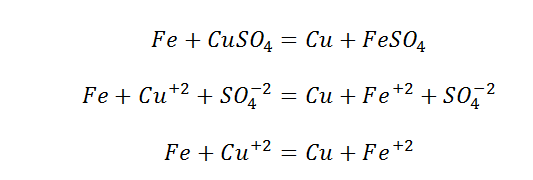Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей:
Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так:
Такое уравнение называется полным ионным уравнением.

Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения:
Полученное уравнение называется сокращенным ионным уравнением. Оно показывает, что в ходе данной реакции происходит связывание ионов SO4 2- , которые находились в растворе NaSО4, и ионов Ва 2+ , которые находились в растворе ВаCl2, и в результате образовалась нерастворимая соль BaSО4.
Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций:
Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы:
В виде молекул записывают формулы:
— малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.;
Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы.
В виде молекул также записывают:
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
или, сокращая коэффициенты, получим: ОН — + Н + = Н2О.
В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
Химия
План урока:
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К + и ОН − .
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K + и SO4 −2 .
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO4 2− и К + .
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа. Для примера возьмём взаимодействие соды и соляной кислоты. Составим молекулярное уравнение.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н + и ОН — ), образуют нейтральное вещество Н2О.
Кислоты и их свойства
Если посмотреть на состав этого класса соединений, то абсолютно во всех содержаться ионы водорода.
Следует заметить, что уравнение диссоциации кислот похожи, но отличие будет по кислотному остатку.Рассмотрим на примерах следующих многоосновных кислот –сернойН2SО4 и фосфорной Н3РО4.Характерной особенностью диссоциации многоосновных кислот – это ступенчатая диссоциация. Это означает, что ионы водорода будут отрываться не сразу все (2 или 3), а по одному.
Следствием этого является способность многоосновных кислот образовывать кислые соли.
Рассмотрим химические свойства кислот, за которые отвечают ионы Н + .
Каким образом можно доказать, что неизвестное вещество относится к кислотам. Для этих целей создали индикаторы, которые как настоящие сыщики, ищут ионы Н + или ОН — (в основаниях). Найдя их, они моментально меняют свою окраску. Кислая среда обусловлена наличием Н + .
В реакциях обмена на их место могут стать только ионы металла, поэтому кислоты реагируют со следующими веществами.
Следственно, при реакции кислот с основными оксидами образуется соль и вода.
Атомы металла входят в состав оснований, в результате реакции нейтрализации, аналогично, как и основными оксидами, продуктом реакции является соль (может быть и кислая, и средняя) и вода.
Исходя из этого, кислая соль образуется, если «не хватает» атомов металла, чтобы обменять их на атомы водорода.
Взаимодействие кислот с солями возможно только в случае, когда соль образована слабой или летучей кислотой, а также в продукте будет газ или осадок.
Особенно хочется отметить взаимодействие металлов с кислотами, поскольку это будет реакция замещения со сменой степени окисления. Не все металлы способны реагировать с кислотами, а только те, что стоят в ряду напряжения до водорода и способны его вытеснить.
Действие концентрированных серной и азотной кислот на металлы отличается от их растворов, при этом происходит образование не водорода, а воды и других продуктов. Детально со свойствами азотной кислоты Вы познакомитесь чуть позже, однако сейчас необходимо запомнить, что при реакции с раствором этой кислоты водород не выделяется.
Основания и их свойства
Данный класс веществ характеризуется наличием функциональной группы, которая отвечает за химические свойства, а именно группы ОН — . По растворимости основания делятся на щёлочи (растворимые) и нерастворимые основания. Соответственно они будут отличаться по химическим свойствам. Щелочная среда образуется, если есть свободные ОН — , которые образуются при диссоциации щелочей.
Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
Кислотные оксиды со щелочами образуют соль и воду.
Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.
Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4 + ). Диссоциация солей всегда идёт в одну стадию.
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так. Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей. Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
Именно наличием ионов Н + в растворе соли ZnCl2, а также группы ОН — в солевом растворе карбоната натрия, объясняется изменение окраски индикатора.
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.
Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.
На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3 − и K + . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H + и OH − в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
2) Для уравнения:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
3) для уравнения:
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
Полное и сокращенное уравнение будут иметь вид:
http://100urokov.ru/predmety/urok-11-protekanie-reakcij-v-rastvore
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/reakcii-ionnogo-obmena