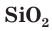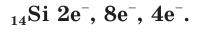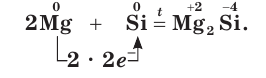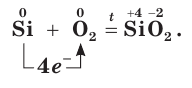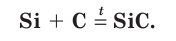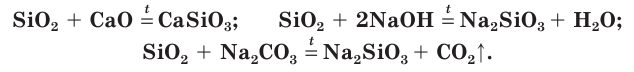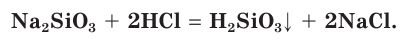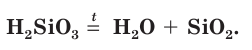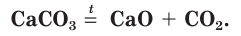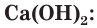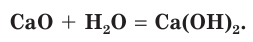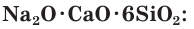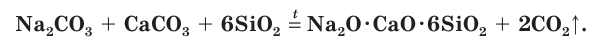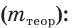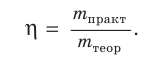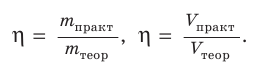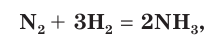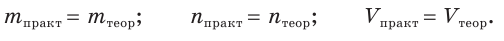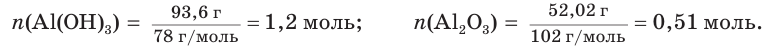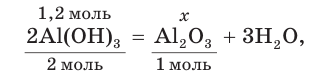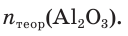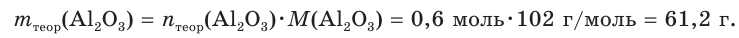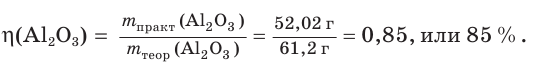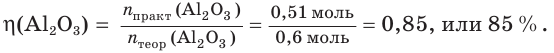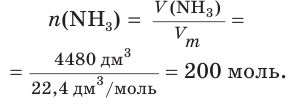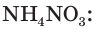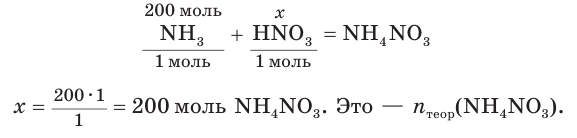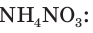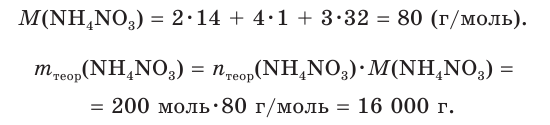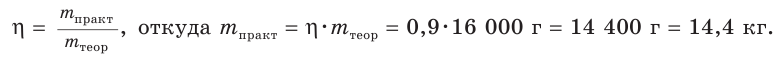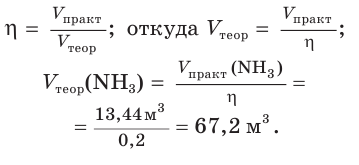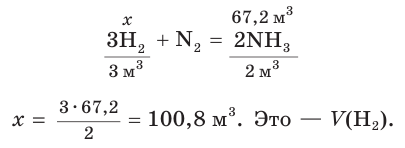Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
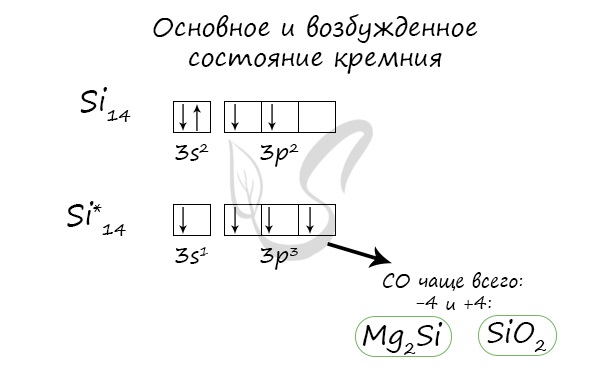
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Кремний в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Кремний — химический элемент и простое вещество
В периодической системе химических элементов кремний Si расположен в третьем периоде в IVА-группе. Чем же он отличается от углерода? Познакомимся со свойствами этого химического элемента и образуемого им простого вещества подробнее.
Кремний в природе
Кремний после кислорода — самый распространенный элемент в земной коре (массовая доля 27,6 %). Земная кора в основном состоит из соединений кремния с кислородом, в состав которых включаются и другие элементы. В природе кремний встречается преимущественно в виде оксида кремния(IV)
Кремний один из самых распространенных элементов во всей Вселенной. Основной компонент марсианской почвы — кремнезем SiO3, а в лунном грунте на долю этого вещества приходится 41 %. Силикаты металлов обнаружены на Венере и других планетах.
Кремний является важным элементом для нормального существования всех живых организмов. Повышенным содержанием кремния характеризуются морские организмы — диатомовые водоросли, радиолярии, губки (рис. 108). Большое количество кремния накапливают хвощи и злаки, в том числе рис.
Строение атома
В атоме кремния 14 электронов, которые располагаются на трех электронных слоях:
Так же как и у атомов углерода, у атомов кремния на внешнем электронном слое находится по 4 электрона и до его завершения не хватает тоже 4 электрона. Поэтому в своих соединениях кремний проявляет отрицательную степень окисления, равную –4, например в силициде магния 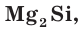
Строение и физические свойства простого вещества
Кристаллическая решетка кремния аналогична кристаллической решетке алмаза (см. рис. 90). В кристалле кремния каждый его атом соединен с другими атомами четырьмя прочными ковалентными связями. В настоящее время получают кремний 99,9999999 %-й чистоты. Это означает, что среди миллиарда атомов кремния может быть лишь один атом другого элемента.
В отличие от алмаза кремний обладает способностью при определенных условиях проводить электрический ток. Электропроводность кремния возрастает при нагревании или освещении. Именно поэтому он используется в полупроводниковой технике, в том числе для преобразования энергии солнечного излучения в электрическую энергию в солнечных батареях.
Химические свойства кремния
Так же как и углерод, кремний реагирует с другими веществами, как правило, при нагревании.
Взаимодействуя с атомами менее электроотрицательных элементов (металлов), атомы кремния принимают электроны (восстанавливаются), приобретая при этом отрицательные степени окисления:
При этом простое вещество кремний проявляет окислительные свойства.
Взаимодействуя с атомами более электроотрицательных элементов, атомы кремния могут отдавать электроны (окисляться), приобретая положительные степени окисления:
При этом простое вещество кремний проявляет восстановительные свойства.
При очень высоких температурах кремний взаимодействует с углеродом, образуя карбид кремния (карборунд):
В этой реакции кремний выступает в качестве восстановителя, а углерод — в качестве окислителя. В качестве восстановителя кремний применяют также при промышленном получении металлов из руд.
Структура простого вещества кремния аналогична структуре алмаза.
При взаимодействии с другими веществами кремний может проявлять как восстановительные, так и окислительные свойства.
Оксид кремния(IV). Кремниевая кислота и ее соли
Среди кислородсодержащих соединений кремния наибольшее значение имеют оксид кремния(IV), кремниевая кислота и ее соли — силикаты.
Оксид кремния(IV)
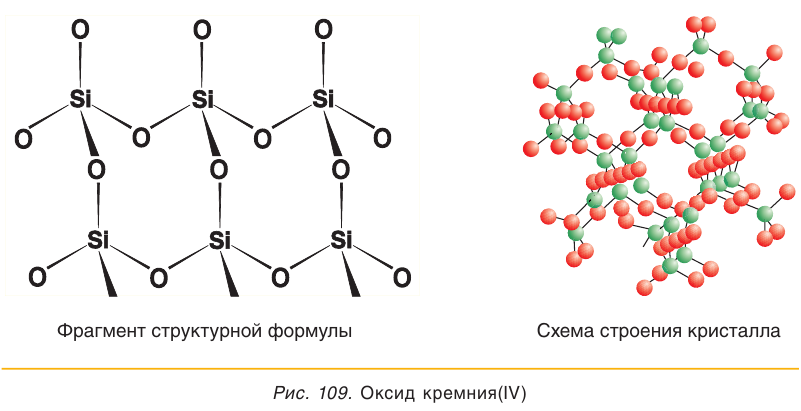
Оксид кремния(IV) представляет собой твердое тугоплавкое вещество (температура плавления 1713 °С), нерастворимое в воде. Высокая температура плавления этого вещества свидетельствует о том, что оно имеет немолекулярное строение.
В кристаллах оксида кремния(IV) атомы кремния и кислорода связаны между собой ковалентными связями (рис. 109). Для описания состава таких веществ, как вы помните, пользуются формульными единицами. Состав формульной единицы 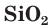
В природе оксид кремния(IV) образует речной песок, горный хрусталь и распространенный на территории Беларуси кремень. Часто в природе минералы на основе SiO3 содержат примеси оксидов железа, алюминия, хрома и других элементов, придающих им определенную окраску. Они используются в качестве поделочных и драгоценных камней (например, цитрин, аметист, яшма, агат и др.).
Оксид кремния(IV) — химически неактивное вещество. Он не растворяется в воде и не взаимодействует с ней. Но как кислотный оксид SiO2 реагирует с основными оксидами, щелочами и некоторыми солями, например карбонатами, при нагревании или сплавлении с образованием солей слабой кремниевой кислоты — силикатов:
Чистый кристаллический оксид кремния(IV) прозрачен, бесцветен, как вода, и в связи с этим применяется для изготовления оптических приборов. Из расплавленного SiO2 получают так называемое кварцевое стекло. Оно выдерживает нагревание до 1000—1200 °С и устойчиво к резкому перепаду температур. У кварцевого стекла есть еще одно важное достоинство: оно пропускает ультрафиолетовые лучи, что позволяет использовать его в производстве медицинской, научно-исследовательской и промышленной аппаратуры.
Кремниевая кислота
Кремниевую кислоту получают, действуя более сильными кислотами на растворы ее солей. Она образует студенистый осадок, содержащий воду (рис. 110). Кремниевая кислота имеет сложный состав, который условно можно выразить простейшей формулой 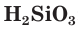
Кремниевая кислота мало растворяется в воде. Она является непрочным соединением — при нагревании или длительном хранении постепенно разлагается на воду и оксид кремния(IV):
Кремниевая кислота очень слабая.
При обезвоживании осадка кремниевой кислоты образуется пористый аморфный оксид кремния(IV) — силикагель. Он имеет развитую поверхность, поэтому отлично поглощает влагу. В химических лабораториях силикагель используют для осушения газов.
Соли кремниевой кислоты
Из солей кремниевой кислоты растворимы только силикаты щелочных металлов. Силикаты калия и натрия называют растворимыми стеклами, а их концентрированные водные растворы — жидким стеклом. Раньше жидкое стекло широко использовалось в качестве силикатного клея. Концентрированный раствор силиката натрия применяется для пропитки деревянных изделий и тканей для придания им огнеупорных свойств. Приготовим две одинаковые полоски бумаги. Одну из них покроем тонким слоем жидкого стекла и высушим на воздухе. Затем одновременно внесем полоски в пламя спиртовки (рис. 111). Что при этом наблюдается?
Если в разбавленный раствор силиката натрия поместить несколько кристаллов окрашенных солей, то через некоторое время в растворе появятся длинные цветные нити в виде веточек. Получается силикатный «сад» (рис. 112). С особенностями протекания этого процесса вы можете познакомиться, если прочитаете дополнительную литературу.
Природные кремнеземы, силикаты и глина являются сырьем для силикатной промышленности.
В составе силикатов часто встречается третий по распространенности в земной коре после кислорода и кремния элемент алюминий. В этом случае они называются алюмосиликатами. Их состав часто записывают в виде соединения оксидов. Например, состав калиевого полевого шпата выражается формулой 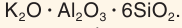

- Оксид кремния(IV) SiO2 является кислотным оксидом. При нагревании или сплавлении SiO2 реагирует с основными оксидами, щелочами и некоторыми солями.
- Кремниевую кислоту H2SiO3 можно получить, действуя более сильными кислотами на растворы ее солей.
- Соли кремниевой кислоты называются силикатами.
- Концентрированные водные растворы силикатов калия и натрия называют жидким стеклом.
Строительные материалы на основе природных оксидов и солей
С древних времен человек старался использовать окружавшие его воду, растительный и животный мир, почву, камни. Именно из камня он сделал первые орудия труда и охоты. На заре возникновения цивилизации появились нехитрые каменные сооружения. Камни надо было скреплять между собой, чтобы сооружение не разваливалось. В связи с этим в обиходе появились вяжущие вещества. Человек научился пользоваться глиной, делать из нее различные изделия. Еще позже возникло производство кирпича и стекла. Так зарождалось строительное ремесло.
Современная строительная индустрия использует неорганические соединения в самом разнообразном виде: материалы из силикатных расплавов (стекло), керамические изделия, вяжущие вещества. Основным источником сырья для производства строительных материалов являются природные соединения: песок, известняк, силикаты, алюмосиликаты, глина.
Керамические материалы
Слово «керамика» происходит от греческого слова керамос — глина, глиняная посуда. Основным сырьем для производства керамики служит глина, которая способна образовывать с водой пластичную массу. Влажной глине можно придать любую форму. При высокой температуре она необратимо твердеет, что и используется в производстве керамических изделий. После обжига керамические изделия получаются пористыми и водопроницаемыми. Поэтому керамику часто покрывают глазурью — легкоплавкими смесями, которые после специальной термической обработки образуют на поверхности изделий стекловидную массу (рис. 113).
Керамика представляет собой один из древнейших искусственных материалов. Керамические изделия были известны человеку с эпохи неолита. Первыми керамическими материалами были кирпич, плитка, посуда и самые разнообразные емкости (см. рис.).
К керамическим изделиям относятся строительный кирпич, черепица, огнеупорные и облицовочные материалы, сантехническое оборудование (ванны, раковины и др.).
Вяжущие строительные материалы
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу, которая постепенно затвердевает.
Одним из древнейших строительных материалов является известь. Различают негашеную известь CaO и гашеную известь 
Оксид кальция CaO (негашеную известь) переводят в гидроксид («гасят» водой) и получают гашеную известь
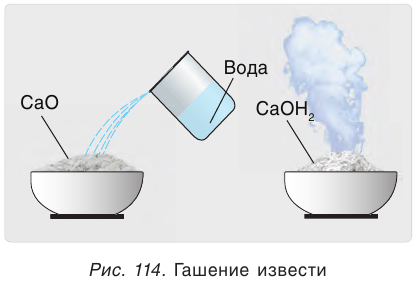
Эта реакция протекает с выделением большого количества теплоты, что приводит к сильному разогреванию смеси (рис. 114). В результате образуется облако водяного пара, как при гашении костра водой. Поэтому данная реакция и называется «гашение извести». Гашеную известь в смеси с песком используют в качестве вяжущего строительного материала.
Другим примером вяжущих строительных материалов является цемент. Если его смешать с водой, то образуется тестообразная масса, которая через некоторое время затвердевает. Это свойство цемента и используется в строительном деле для скрепления, например, кирпичей при сооружении стен. В Беларуси его производят на нескольких предприятиях, крупнейшими из которых являются ОАО «Красносельскстройматериалы» и ОАО «Кричевцементошифер».
Из смеси цемента, песка и воды с добавлением мелкого щебня или гравия получают бетон. Если в бетон ввести каркас из железных стержней, то получается железобетон. Бетон и железобетон широко применяются в строительстве. Введение в бетон химических веществ определенного состава позволяет получать пенобетон, отличающийся легкостью, высокими тепло- и звукоизоляционными свойствами. Важнейшим отличием бетона от известкового раствора является то, что при его затвердевании происходит поглощение воды.
Недавно ученые на основе фосфата магния разработали биобетон. Внешние панели из биобетона после постройки тут же начинают накапливать дождевую воду, становясь идеальной средой для развития лишайников и мхов. Это позволяет создавать вертикальные сады на стенах жилых зданий, реализуя концепцию экогородов (см. рис. вверху). Кроме того, бетон активно используется как дизайнерский материал для изготовления садовой скульптуры (см. рис. внизу), предметов мебели и интерьера.
В качестве вяжущего материала используют также алебастр, который часто называют полуводным гипсом. Его формулу записывают следующим образом 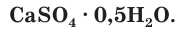
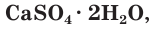
Стекло
Чаще всего мы сталкиваемся со стеклами, полученными на основе различных силикатов, поэтому в быту слово «стекло» употребляется для обозначения именно силикатных стекол.
Кроме красивого внешнего вида, стекло обладает низкой теплопроводностью и высокой прозрачностью, что позволяет использовать его для изготовления оконных стеклопакетов. При нагревании стекло легко вытягивается в тонкие, длинные нити, из которых изготавливают стекловату, стекловолокно и стеклоткани. Стекловата и стекловолокно используются в качестве звуко- и теплоизоляторов. Крупнейшим производителем стеклонитей и стеклотканей различного назначения на территории Беларуси является ОАО «Полоцк-Стекловолокно».
Стекольная промышленность Беларуси имеет давнюю историю. В 1717 г. в деревнях Налибоки и Янковичи (ныне Столбцовский район) по образцу Дрезденской мануфактуры Радзивиллы основали Налибокскую стеклянную мануфактуру, где изготавливались зеркала, подсвечники, художественная и бытовая посуда. В 1737 г. в деревне Уречье (ныне Любанский район) была основана Уречская стеклянная мануфактура, которая выпускала изделия из бесцветного и цветного стекла. Эти мануфактуры существовали до середины XVIII в. В 1883 г. помещик Зенон Ленский построил в поселке Березовка (ныне Лидский район) мануфактуру, которая позже, в 1908 г., стала стеклозаводом «Неман», работающим и по сей день.
Стекло не является индивидуальным соединением, а представляет собой сплав нескольких веществ. Для получения стекла (как говорят на производстве, при «варке» стекла) в качестве исходных материалов используют 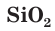
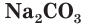
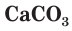
Часто при варке стекла для придания ему специфических свойств и окраски в исходную смесь добавляют разнообразные соли и оксиды.
- Стекло является экологически чистым материалом. Оно может подвергаться вторичной переработке, не загрязняя при этом окружающую среду.
- Основным источником сырья для производства строительных материалов являются природные соединения: песок, глина, известняк, силикаты и алюмосиликаты.
- К строительным материалам относятся стекло, керамика, вяжущие материалы.
Понятие о выходе продукта химической реакции
На практике при проведении химических реакций обычно получается несколько меньшее количество продукта, чем рассчитанное теоретически в соответствии с уравнением реакции. Это может происходить по нескольким причинам.
Многие химические реакции обратимы, т. е. протекают не до конца. Потери веществ могут быть также обусловлены их испарением, частичным растворением (ведь абсолютно нерастворимых веществ нет), потерями при упаривании или фильтровании растворов и т. п. Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность оборудования, в котором проходят химические процессы, всегда приводит к потерям газообразных веществ. И наконец, часть веществ может не вступить в реакцию или образовать при взаимодействии побочные продукты.
Для оценки полноты протекания процесса пользуются понятием выход продукта химической реакции. Оно подобно понятию «коэффициент полезного действия», которое применяется в физике для характеристики процессов преобразования и использования энергии, работы различных двигателей и механизмов.
Выход продукта химической реакции обозначается буквой греческого алфавита η (эта). Он представляет собой величину, равную отношению реально полученной, т. е. практической массы вещества 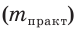
Выход продукта химической реакции — безразмерная величина, например: η(СаО) = 0,75, или 75 %.
Поскольку масса вещества пропорциональна его химическому количеству, то выход продукта реакции можно определять и как отношение соответствующих химических количеств вещества или объемов (для газов):
Например, если известно, что в реакции синтеза аммиака
выход продукта составляет 0,75 (η = 0,75, или 75 %), то это означает, что из азота массой 28 г (объемом 22,4 дм 3 , химическим количеством 1 моль) мы получим аммиак массой не 34 г (объемом 44,8 дм 3 , химическим количеством 2 моль), а массой 34 г
Таким образом, выход продукта реакции — это величина, равная отношению реально полученной массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции.
Величина выхода продукта реакции не может превышать 100 %. Если выход равен 100 %, то говорят, что реакция протекает количественно. В этом случае
Кроме выражения «выход продукта химической реакции», часто используют и более краткие формы этого понятия: «выход продукта», «выход реакции», «реакция протекает с 90 %-м выходом».
На практике часто приходится рассчитывать химическое количество, массу или объем продукта реакции, если его выход отличается от 100 %, или, наоборот, определять выход продукта реакции. Рассмотрим типы расчетов с использованием этого понятия.
Тип 1. Даны массы (объемы, химические количества) исходного вещества и продукта реакции. Требуется определить выход продукта реакции.
Пример:
При прокаливании гидроксида алюминия 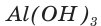
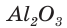
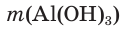
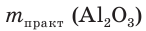
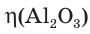
1. Определяем молярные массы гидроксида и оксида алюминия:
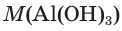
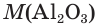
2. Находим химические количества гидроксида и оксида алюминия:
3. Записываем уравнение реакции разложения гидроксида алюминия и производим расчет теоретического химического количества (х) и теоретической массы полученного оксида алюминия:
откуда получим: х = 0,6 моль. Это —
Тогда теоретическая масса оксида алюминия составит:
4. Определяем выход продукта реакции (двумя способами):
а)
б)
Ответ: выход продукта реакции равен 85 %.
Тип 2. Даны масса (объем, химическое количество) исходного вещества и выход продукта реакции. Требуется определить массу (объем, химическое количество) продукта реакции.
Пример:
Рассчитайте массу нитрата аммония 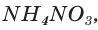
V(NH3) = 4,48 м3 = 4480 дм3

Найдем химическое количество аммиака:
2. Составим уравнение реакции и рассчитаем теоретическое химическое количество
3. Находим теоретическую массу
4. Из формулы для определения выхода продукта реакции выражаем 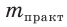
Ответ: практическая масса нитрата аммония равна 14,4 кг.
Тип 3. Даны масса (объем, химическое количество) продукта и выход продукта. Требуется определить массу (объем, химическое количество) исходного вещества.
Пример:
Определите объем (н. у.) водорода, который понадобится для получения аммиака объемом 13,44 м 3 (н. у.), если его практический выход равен 20 %.
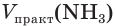

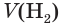
1. Рассчитаем теоретический объем аммиака:
2. Составим уравнение реакции синтеза аммиака и рассчитаем объем (х) водорода:
Ответ: для синтеза аммиака потребуется водород объемом 100,8 м3
Выход продукта реакции — это величина, равная отношению реально полученной в результате реакции массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Классы неорганических соединений
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Углерод в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://chemege.ru/silicium/
http://www.evkova.org/kremnij-v-himii