Лекция 12. 1. Виды (приемы) комплексонометрического титрования (прямое, обратное, заместительное). Применение комплексонометрического титрования
1. Виды (приемы) комплексонометрического титрования
(прямое, обратное, заместительное).
Применение комплексонометрического титрования.
Как и в других титриметрических методах, в комплексонометрии применяют прямое, обратное и заместительное (косвенное) титрование. Наиболее точные результаты получают при прямом титровании.
Прямое титрование. При прямом титровании анализируемого раствора, содержащего определяемый катион металла, стандартным раствором комплексона в типичном эксперименте к аликвотной части раствора, взятой для титрования, прибавляют буферную смесь (часто ‒ аммиачный буфер) для достижения требуемого значения pH раствора, индикатор и титруют стандартным раствором комплексона до изменения окраски титруемого раствора.
Проиллюстрируем сказанное некоторыми примерами.
1)Стандартизация раствора сульфата магния MgSO4 раствором ЭДТА. Титрование проводят в щелочной среде аммиачного буфера при pH = 9,5‒10.
Таблица 1. Изменение окраски некоторых металлохромных индикаторов в ТЭ при прямом титровании катионов металлов раствором
Изменение окраски в ТЭ
Эриохром черный Т
РЗЭ-катионы редкоземельных элементов
К анализируемому раствору сульфата магния прибавляют аммиачный буфер для поддержания pH = 9,5‒10, индикатор эриохром черный Т (индикаторную смесь) и медленно титруют стандартным раствором ЭДТА до изменения окраски титруемого раствора от красно-фиолетовой на синюю.
При этом в системе осуществляются следующие процессы.
Введение индикатора H3Ind в исходный анализируемый раствор приводит к образованию растворимого красно-фиолетового комплекса магния Mglnd — с индикатором по схеме:
H3Ind = HInd2-+ 2Н+
Mg2+ + HInd2- = MgInd- + H+
Исходный анализируемый раствор окрашивается в красно-фиолето — вый цвет.
При добавлении титранта образуется растворимый, устойчивый, бесцветный комплекс магния с ЭДТА состава MgY2+:
Mg2+ + HY3- = MgY2- + H+
Вблизи ТЭ менее устойчивый комплекс Mglnd — разрушается с образованием более стабильного комплексоната MgY2- :
MgInd — + HY3- = MgY2- + HInd2-
Окраска раствора в ТЭ изменяется из красно-фиолетовой на синеголубую.
Расчеты концентрации и титра исходного раствора сульфата магния проводят обычным способом на основе закона эквивалентов, учитывая, что при образовании комплексоната магния состава 1:1 фактор эквивалентности как катиона магния, так и ЭДТА равен единице:
c(MgSO4)V(MgSO4) = с(ЭДТА) V(ЭДТА),
c(MgSO4) = с(ЭДТА) V(ЭДТА)/V(MgSO4),
где все обозначения ‒ традиционные.
1)Определение катионов свинца Рb2+. Титрование проводят в слабокислой среде при pH ≈ 5.
К аликвоте анализируемого раствора, содержащего свинец(II), прибавляют небольшое количество уротропина до достижения значения pH = 5 (по универсальной индикаторной бумаге) и несколько капель раствора индикатора ксиленолового оранжевого до получения отчетливой краснофиолетовой окраски раствора. Затем раствор титруют стандартным раствором ЭДТА до изменения цвета титруемого раствора из фиолетового на лимонно-желтый.
В системе происходят следующие превращения.
При введении индикатора H6Ind в исходный анализируемый раствор (pH ≈ 5) образуется растворимый красно-фиолетовый комплекс свинца(II) с индикатором состава PbH4Ind:
Pb2+ + H6Ind = PbH4Ind + 2Н+
Исходный анализируемый раствор принимает красно-фиолетовую окраску.
При титровании образуется устойчивый, растворимый, бесцветный комплекс свинца с ЭДТА состава PbY2- (при pH ≈ 5 ЭДТА присутствует в форме H2Y2-):
Pb2+ + H2Y2- = PbY2- + 2Н+
Вблизи ТЭ комплекс свинца с индикатором разрушается с образованием более прочного комплексоната свинца:
PbH4Ind + H2Y2- = PbY2- + H6Ind
Окраска титруемого раствора изменяется из красно-фиолетовой в желтую. Расчет концентрации и титра свинца(II) в анализируемом растворе проводят аналогично предыдущему:
с(Рb2+) = с(ЭДТА) V(ЭДТА)/V(Рb2+),
2) Определение катионов кальция Ca2+ . Катионы кальция определяются комплексонометрически титрованием анализируемого раствора содержащего Са2+, стандартным раствором ЭДТА в присутствии различных индикаторов: кальконкарбоновой кислоты (в щелочной среде NaOH) ‒ в ТЭ розовая окраска раствора переходит в синюю; хромового темно-синего (в аммиачном буфере) ‒ в ТЭ вишнево-красная окраска раствора переходит в сине-фиолетовую.
Са2+ + H2Ind3- = CaH2Ind —
При титровании образуется бесцветный, растворимый эдетеат кальция CaY2- (в рассматриваемых условиях ЭДТА присутствует в растворе в форме Y4-):
Вблизи ТЭ разрушается красный комплекс CaH2Ind — с образованием сине-фиолетовых анионов H2Ind3-:
CaH2Ind — + Y4- = CaY2- + H2Ind3-
Вследствие этого окраска раствора из красной переходит в синефиолетовую.
Расчет концентрации и титра Са2+ проводят аналогично расчетам, описанным выше.
3)Определение катионов магния и кальция при их совместном присутствии. Вначале в отдельной пробе анализируемого раствора определяют сумму катионов Mg2+ и Са2+ титрованием анализируемого раствора в аммиачном буфере (pH ≈ 10) стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т до перехода красной окраски титруемого раствора в фиолетово-синюю вследствие разрушения комплекса магния с индикатором:
MgInd — + HY3- = MgY2- + HInd2-
Затем в другой пробе анализируемого раствора определяют кальций. К раствору прибавляют щелочь для осаждения магния в виде гидроксида Mg(OH)2. Катионы кальция остаются в растворе. Их определяют титрованием стандартным раствором ЭДТА в присутствии индикатора мурексида до перехода красной окраски титруемого раствора в синефиолетовую вследствие разрушения комплекса кальция с индикатором:
CaH2Ind — + HY3- + ОН — = CaY2- + H2Ind3- + Н2O
Обратное титрование. Этот способ применяют тогда, когда проведение прямого титрования затруднено из-за медленного протекания реакции образования комплексоната или невозможности подбора соответствующего индикатора.
Для проведения обратного титрования в типичном эксперименте к анализируемому раствору, содержащему определяемый катион, прибавляют избыточное, по сравнению со стехиометрическим, количество стандартного раствора ЭДТА. После окончания реакции образования комплексоната определяемого катиона избыток не вступившего в реакцию ЭДТА оттитровывают стандартным раствором соли магния, цинка, свинца или других катионов в присутствии индикатора.
Так, при определении свинца методом обратного комплексономет — рического титрования к анализируемому раствору, содержащему катионы Рb2+, прибавляют избыток стандартного раствора ЭДТА, аммиачный буфер и небольшое количество индикаторной смеси эриохрома черного Т до приобретения раствором отчетливой синей окраски. Затем титруют стандартным раствором сульфата магния до изменения окраски титруемого раствора от синей до красно-фиолетовой.
В системе осуществляются следующие процессы.
Прибавление ЭДТА в анализируемый раствор приводит к образованию комплексоната свинца PbY2-
Pb2+ + H2Y2- = PbY2- + 2Н+
При добавлении аммиачного буфера (pH = 9,5—10) избыточные анионы H2Y2- переходят в HY3-:
H2Y2- + ОН — = HY3- + Н2O
Индикатор в этих условиях присутствует в форме HInd2-, придающей раствору синюю окраску.
При последующем титровании избыточных анионов HY3- раствором сульфата магния образуется комплексонат магния MgY2-:
HY3- + Mg2+ = MgY2- + H+
В ТЭ все анионы HY3- оказываются оттитрованными, поэтому прибавление первой же избыточной капли титранта ‒ раствора MgSO4 ‒ приводит к образованию красно-фиолетового комплекса MgInd-:
HInd2- + Mg2+ = MgInd — + H+
Окраска титруемого раствора из синей переходит в красно-фиолетовую.
Расчет концентрации и титра свинца(II) проводят, как обычно при обратном титровании:
n(ЭДТА) = n(РЬ2+) + n(MgSO4),
с(ЭДТА)V(ЭДТА) = c(Pb2+)V(Pb2+) + c(MgSO4)K(MgSO4),
c(Pb2+) = [с(ЭДТА) V(ЭДТ А) — c(MgSO4) V(MgSO4)]/V(Pb2+),
T(Рb2+) = с(Рb2+)M/(Рb2+)/ 1000,
где все обозначения ‒ традиционные.
Комбинируя осаждение с обратным титрованием, можно комплексонометрически определять не только катионы металлов, но и анионы, например, сульфид-, сульфат-, ортофосфат-, оксалат-ионы.
Принцип определения состоит в следующем. К анализируемому раствору, содержащему определяемый анион, прибавляют в избытке рас-
твор, содержащий точно известное количест твор, содержащий точно известное количество катиона металла, переводящего определяемый анион в осадок. Этот осадок отфильтровывают, а в фильтрате определяют содержание избыточных (не вступивших в реакцию с анионом) прибавленных катионов титрованием стандартным раствором ЭДТА.
Так, при определении сульфат-ионов их вначале осаждают в виде сульфата бария, прибавляя избыток растворимой соли бария (например, ВаС12) к анализируемому раствору.
Ва2+ + SO42- = BaSO4↓
Осадок BaSO4 отфильтровывают, а в растворе определяют остаточное содержание катионов Ва2+ титрованием стандартным раствором ЭДТА:
Ва2+ + H2Y2- = BaY2 + 2Н+
Аналогично определяют ортофосфат-ионы по схеме:
РО43- + Mg2+ + NH4+ = NH4MgPО4↓ (осаждение)
Mg2+ + H2Y2- = MgY2- + 2Н+ (титрование)
Оксалат-ионы можно определять по схеме:
С2O42- + Са2+ = СаС2O4↓ (осаждение)
Са2+ + H2Y2- = CaY2- + 2Н+ (титрование)
Заместительное титрование. В случае определения катионов металлов этот способ иногда называют вытеснительным титрованием.
К раствору, содержащему определяемые катионы металла, способные образовывать прочные комплексонаты, прибавляют избыток раствора, содержащего менее прочный комплексонат другого металла, например, магния или цинка. Менее прочный комплексонат разрушается с выделением катионов (магния или цинка), которые затем оттитровывают стандартным раствором ЭДТА.
Рассмотрим, например, определение катионов кальция Са2+ в растворе.
К анализируемому раствору, содержащему определяемые катионы кальция, прибавляют в избытке (по сравнению со стехиометрическим количеством) раствор, содержащий комплекс магния с ЭДТА. При этом протекает реакция:
Са2+ + MgY2- = CaY2- + Mg2+
Выделившиеся катионы магния в количестве, эквивалентном количеству катионов кальция, находившихся в анализируемом растворе, оттитровывают стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т до перехода окраски титруемого раствора из крас — но-фиолетовой в синюю
Mg2+ + HY3- = MgY2- + Н+
MgInd — + HY3- = MgY2- + HInd2-
Расчет концентрации Са2+ в исходном анализируемом растворе проводят по обычному способу для заместительного титрования, как и для прямого титрования:
n(Са2+) = n(Mg2+) = n(ЭДТА),
с(Са2+) V(Са2+) = с(ЭДТА)V(ЭДТА),
где все обозначения ‒ традиционные.
Аналогично можно определять катионы бария Ва2+ при прибавлении избытка раствора комплексоната цинка ZnY2- с последующим титрованием выделившихся катионов цинка стандартным раствором ЭДТА в аммиачном буфере.
Комбинированными способами заместительного и обратного титрования можно определять также анионы, например, сульфат-, фосфат-, хромат-ионы.
При определении сульфат-ионов их вначале осаждают хлоридом бария из анализируемого раствора в виде сульфата бария BaSO4. Осадок сульфата бария количественно отделяют от маточника и растворяют в избытке стандартного раствора ЭДТА в аммиачном буфере. Остаточное количество непрореагировавшего ЭДТА оттитровывают стандартным раствором сульфата магния или сульфата цинка в присутствии индикатора кислотного хромового темно-синего.
Для определения хромат-ионов СrO42- их вначале осаждают в виде хромата свинца РЬСrO4, прибавляя к горячему анализируемому раствору, содержащему хромат-ионы, горячий раствор нитрата свинца. Осадок количественно отделяют от маточника и растворяют в стандартном растворе ЭДТА в аммиачном буфере. Прибавляют индикатор кислотный хромовый темно-синий и медленно оттитровывают остаток непрореагировавшего ЭДТА стандартным раствором сульфата цинка до изменения окраски титруемого раствора из изумрудно-зеленой в коричнево-красную.
Аналогично можно определять ортофосфат-ионы, осаждая их в форме магнийаммонийфосфата NH4MgPO4·6Н2O с последующим растворением осадка и комплексонометрическим определением катионов магния.
Алкалиметрическое титрование в комплексонометрии. Способ основан на титровании стандартным раствором щелочи ионов водорода, выделяющихся при реакции катионов определяемого металла с ЭДТА, например, по схеме:
М2+ + H2Y2- = MY2- + 2Н+
Поскольку ионы водорода выделяются в количестве, эквивалентном количеству прореагировавших катионов металла, то, определив алкали — метрически количество выделившихся ионов водорода, можно найти содержание катионов металла в анализируемом растворе.
Способ не получил широкого распространения в аналитической практике.
2. Кривые титрования, их расчет и построение, анализ. Влияние различных факторов на скачок на кривой титрования (устойчивость комплексонатов, концентрация ионов металла и комплексона, рН раствора).
Кривая комплексонометрического титрования ‒ это графическое представление зависимости концентрации определяемых катионов металла в растворе от количества (обычно ‒ от объема) прибавляемого титранта. Часто кривые комплексонометрического титрования строятся в координатах рМ ‒ V(Т), где рМ = — lg[Mn+] ‒ показатель равновесной концентрации катионов Мn+ в растворе, V (Т) ‒ объем прибавленного титранта.
Кривые титрования можно также строить в координатах рМ ‒ f, где f ‒ степень оттитрованности раствора.
Рассмотрим построение кривой титрования на примере комплексонометрического титрования катионов металлов (титруемое вещество X) стандартным раствором ЭДТА (титрант Т) в сильно щелочной среде, когда мольная доля ионов Y4- равна ɑ=1, т. е. весь незакомплексованный ЭДТА находится в форме анионов Y4-.
Пусть требуется рассчитать и построить кривые комплексонометрического титрования V(Х) = 100 мл = 0,1 л с концентрацией с (Х) = 0,1 моль/л водных щелочных растворов СаCl2 и ZnCl2 раствором ЭДТА с молярной концентрацией с (Т) = 0,1 моль/л при pH = 12.
При титровании протекает реакция образования комплексонатов MY2-:
где М2+ = Са2+ или Zn2+.
Концентрационная константа устойчивости комплексов β равна:
Расчет рМ = -lg[M2+] до точки эквивалентности. В исходном анализируемом растворе до начала титрования
В процессе титрования катионы М2+ связываются в прочный комплекс, их концентрация в растворе уменьшается:
Расчет рМ в точке эквивалентности. В ТЭ все катионы М2+ оттитрованы с образованием комплекса MY2-. Небольшая часть комплекса диссоциирует по схеме:
поэтому равновесные концентрации [М2+] и [Y4-] одинаковы: [М2+] = [Y4-]. Из выражения для концентрационной константы устойчивости
находим квадрат равновесной концентрации катионов металла:
Концентрация [М2+] в ТЭ пренебрежимо мала (практически все катионы М2+ связаны в комплекс), поэтому:
[MY2- ] = с(М2+) ‒ [М2+] = с(М2+) = с(Х),
где с(М2+) = 0,1 моль/л ‒ концентрация определяемых катионов металла в исходном анализируемом растворе. Тогда:
Зная значение константы устойчивости комплексоната, можно рассчитать величину рМ в ТЭ.
Расчет рМ после точки эквивалентности. Равновесную концентрацию катионов М2+ в растворе после ТЭ можно рассчитать из выражения для константы устойчивости комплексоната:
-lg[M2+] = — lgc(X) + lgβ + lg[Y4-],
pM = pc(X) + lgβ + lg[Y4-].
Рассчитаем равновесную концентрацию [Y4-]:
Вычислив величину [Y4-], можно найти значение рМ после ТЭ.
Таблица конечных данных. По полученным выше формулам рассчитаем значения рМ в различные моменты титрования, учитывая, что с(Х) = с(Т) = 0,1 моль/л; V(Х) = 100 мл = 0,1 л; lgβ (CaY2-) = 10,6; lgβ (ZnY2-) = 16,3.
Рассчитанные значения рМ представлены в табл. 1.2.
Таблица 2. Рассчитанные значения рСа и pZn в различные моменты
титрования 100 мл растворов солей кальция и цинка (с(Са2+) = с(Zn2+) = 0,1 моль/л ) стандартным 0,1 моль/л раствором ЭДТА
Комплексонометрическое титрование
Титратор для комплексонометрического титрования. GT-200
Чтобы унифицировать получаемые результаты анализа и избежать индикаторной ошибки рекомендуется применять автоматизированные установки. Они позволят выполнять анализ в строго контролируемых одинаковых условиях, фотометрически детектируя смену окраса раствора.
Комплектация автоматического лабораторного титратора для комплексонометрического титрования на примере модели GT-200 от японской компании «Mitsubishi Chemical Analytech Co., Ltd.» (с 2020 года перешла в собственность «Nittoseiko Analytech»):
Основной блок – потенциометрический титратор GT-200 – управляется либо встроенным программным обеспечением, либо с помощью WINDOWS-совместимого ПО. Он производит все расчетные операции и сохраняет необходимые данные (концентрации, объемы, статистику и пр.) в памяти.
Бюретка для титрования GT-200BRT – предназначена для дозирования и титрования растворов. Можно задавать шаг, скорость, последовательность дозирования.
Фотометрический датчик GT-LDII – имеет встроенный детектор, вырабатывающий фототок при определенной длине волны. При смене окраса раствора длина волны меняется, изменяя фототок. В процессе подачи титранта объем поданного раствора можно зафиксировать до смены окраса индикатора и после.
Мешалка GT-200STR – позволяет производить контролируемое и повторяемое перемешивание пробы.
Это основные элементы автоматической системы для фотометрического титрования на базе потенциометрического титратора GT-200. Дополнительно к ним можно добавить устройства для автоматической подачи образцов, принтер для распечатки результатов, весы с возможностью передачи веса образца сразу в прибор и другие полезные модули.
Сущность комплексонометрического титрования
Комплексонометрическое титрование – это титриметрический метод анализа, основанный на взаимодействии определяемых ионов металла с комплексонами. Чаще всего в роли комплексообразователя выступает динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: Трилон Б, ЭДТА), которая в большинстве случаев образует комплексы с катионами металлов в молярном соотношении 1:1, что упрощает расчет концентраций определяемых элементов.
Устойчивые комплексы с ЭДТА большинство металлов образуют в щелочной среде, для этого к раствору с анализируемым образцом добавляют аммиачный буфер, но некоторые элементы, например, железо (Fe III), можно титровать и в кислой среде.
Основные требования к комплексообразующему реагенту:
Образования устойчивых комплексов с катионами металлов в известном молярном соотношении.
Хорошая растворимость образуемых комплексов в воде.
Образующиеся комплексы не должны быть окрашены.
Взаимодействие комплексона с противоионом должно происходить быстро и количественно
Всем этим требованиям, в большинстве случаев, удовлетворяет Трилон Б.
Индикатор подбирают в зависимости от титруемого элемента и исходя из типа титрования.
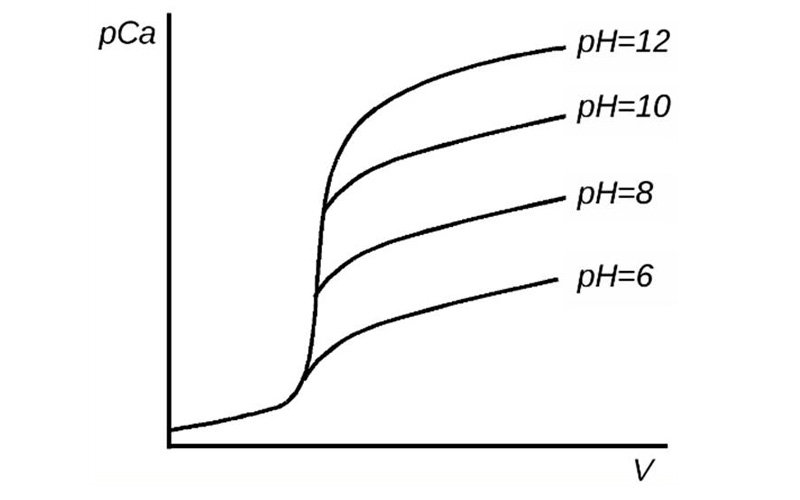
Как уже упоминалось ранее, pH среды существенно влияет на устойчивость образующихся комплексов, что видно при построении кривой комплексонометрического титрования ионов кальция, представленной ниже:
Рис.1 Кривая титрования [Ca 2+ ] трилоном Б при различных значениях pH.
Из кривых титрования видно, что при более высоком pH величина ΔpCa больше (высокий скачок), что позволяет точней идентифицировать точку эквивалентности.
Классификация методов комплексонометрического титрования
Как и большинство титриметрических методов, комплексонометрию можно проводить прямым, обратным или заместительным титрованием.
В случае прямого титрования первоначальное окрашивание раствора вызвано взаимодействием индикатора с металлом. В дальнейшем сильный комплексообразователь трилон Б вытесняет индикатор, образуя с металлом более устойчивый комплекс. В ходе этого взаимодействия наблюдается смена цветности раствора. Титрант добавляется до получения устойчивого окраса, что говорит о присутствии в растворе свободного Трилона Б.
Обратный метод титрования подразумевает добавление избытка комплексона к раствору. Непрореагировавшую часть ЭДТА оттитровывают солью цинка или магния. Зная первоначально добавленный объем ЭДТА и вычтя из него количество оттитрованного избытка, можно вычислить содержание металла, вступившего во взаимодействие с комплексоном. Этот способ предпочтителен для элементов, которые медленно взаимодействуют с Трилоном Б, для которых сложно подобрать индикатор. Металлы в нерастворимых в воде солях тоже определяют обратным титрованием. Кроме того, если индикатор образует более прочный комплекс с металлом, чем титрант, то обратное комплексонометрическое титрование поможет определить его содержание.
При заместительном титровании к образцу добавляют комплексы металлов, которые легко вытесняются определяемыми металлами в образце. Избыток добавленного раствора оттитровывается стандартным раствором ЭДТА.
Комбинированные методы комплексонометрического титрования
Комбинацией упомянутых методов можно определять не только катионы, но и анионы, такие как SO4 2- ; PO4 3- ; CrO4 2- . Для этого их сначала осаждают, фильтруют, растворяют в известном количестве ЭДТА. Избыток ЭДТА оттитровывают сульфатом цинка.
Виды комплексонометрического титрования
Различают комплексонометрические методы в зависимости от используемого хелата:
Трилон Б – трилонометрия. Обычно применяется для определения катионов металлов.
Соединения ртути – меркуриметрия. Применяется для анализа анионов (галогенов, цианидов и пр.).
Фосфорорганические комплексоны. Применяются относительно недавно и позволяют специфично определять катионы металлов даже в смесях.
Можно классифицировать методы комплексонометрического титрования в зависимости от используемого индикатора.
Индикаторы для комплексонометрического титрования
Выбор индикатора в первую очередь зависит от условий титрования. Для анализа катионов металлов наиболее универсален индикатор Эриохром черный Т, который применяется для определения Mg + ; Са 2+ ; Zn 2+ ; Cd 2+ ; Pb 2+ ; Мn 2+ .
Широкий спектр элементов можно определять с помощью Ксиленолового оранжевого, в том числе редкоземельные элементы, висмут и Fe 3+ .
Также в комплексонометрическом титровании используют такие индикаторы, как: Пирокатехиновый фиолетовый, Мурексид, кальцес, Хромовый темно¬синий, Бериллон II, Кальцион, Кальцеин и пр.
При индикаторном титровании необходимо четко фиксировать смену окраса индикатора для определения конечной точки титрования. Учитывая особенности индивидуального цветовосприятия, момент перехода окраса у разных лаборантов может отличаться, что влияет на точность получаемых результатов, повторяемость.
Применение комплексонометрического титрования
Методы комплексонометрического титрования особенно важны при определении Ca и Mg при анализе воды на жесткость (ГОСТ 52407-2005, ГОСТ 4151-72, ПНД Ф 14.1:2.98-97 и др. методики). Эти показатели определяют ее целевое назначение и пригодность для бытового и технологического использования. Кроме этого существуют внутренние нормативные документы на предприятиях, которые регулируют качество используемой воды и методы ее анализа.
Методики определения других элементов востребованы в различных отраслях химической промышленности. Эти задачи решаются титрованием. В ГОСТ 10398-2016 представлены методы анализа для широкого перечня элементов в составе реактивов и особо чистых веществ.
Комплексонометрическое титрование (ОФС.1.2.3.0015.15)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Комплексонометрическое титрование (ОФС.1.2.3.0015.15)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.3.0015.15 Комплексонометрическое титрование
Взамен ст. ГФ XI, вып.1
Комплексонометрическое титрование – метод титриметрического анализа, основанный на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями.
В настоящее время среди известных комплексонов наибольшее применение для комплексонометрического титрования получила динатриевая соль этилендиаминтетрауксусной кислоты, известная под названиями: натрия эдетат, трилон Б, комплексон III, хелатон III и др.
Натрия эдетат образует с катионами различных металлов в стехиометрическом отношении (1:1) устойчивые и хорошо растворимые в воде комплексонаты, что позволяет использовать его для количественного определения алюминия, висмута, кальция, магния, свинца, цинка и других ионов металлов в лекарственных препаратах.
Индикаторы, применяемые для визуального определения конечной точки титрования, называются металлоиндикаторами. В химическом отношении они, как правило, являются органическими кислотами и обладают способностью изменять окраску при образовании комплексных соединений с катионами металлов. Взаимодействие металлоиндикаторов с катионами определяемых металлов должно быть обратимым и константа устойчивости металлоиндикаторного комплекса должна быть на 10 4 меньше константы устойчивости комплекса катиона металла с титрантом.
Прямое титрование раствором натрия эдетата проводят следующим образом: к раствору анализируемого катиона прибавляют буферный раствор, имеющий необходимое значение рН, и указанное количество металлоиндикатора. В точке эквивалентности окраска раствора изменяется от окраски комплекса катиона с металлоиндикатором до окраски свободного металлоиндикатора.
При обратном титровании избыток натрия эдетата оттитровывают при определенном значении рН в присутствии соответствующего металлоиндикатора растворами солей магния, свинца, цинка и др. до перехода окраски свободного индикатора до окраски комплекса металлоиндикатора с катионом титранта.
Методики определения катионов
Алюминий
Определение проводят одним из приведенных ниже способов.
- Точную навеску препарата (соответствующую 0,02 – 0,03 г алюминия) растворяют в смеси 2 мл хлористоводородной кислоты раствора 1 М и 50 мл воды. Прибавляют 50,0 мл натрия эдетата раствора 0,05 М и нейтрализуют натрия гидроксида раствором 1 М по метиловому красному. Нагревают раствор до кипения и выдерживают на кипящей водяной бане в течение 10 мин, охлаждают, прибавляют 0,05 г индикаторной смеси ксиленолового оранжевого, 5 г гексаметилентетрамина и титруют избыток натрия эдетата цинка сульфата раствором 0,1 М до красно-фиолетового окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 1,349 мг алюминия.
- К 20,0 мл раствора препарата, приготовленного, как описано в фармакопейной статье, прибавляют 25,0 мл натрия эдетата раствора 0,1 М и 10 мл смеси равных объемов аммония ацетата раствора 15,5 % и уксусной кислоты разведенной 12 %. Кипятят в течение 2 мин, охлаждают до комнатной температуры, прибавляют 50 мл этанола и 3 мл свежеприготовленного дитизона раствора 0,025 % в этаноле. Избыток натрия эдетата оттитровывают цинка сульфата раствором 0,1 М до перехода окраски от зеленовато-голубой до красно-фиолетовой.
1 мл натрия эдетата раствора 0,1 М соответствует 2,698 мг алюминия.
Висмут
Точную навеску препарата (соответствующую 0,1 – 0,2 г висмута) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды и доводят рН до 1,0 – 2,0, добавляя по каплям азотную кислоту разведенную 16 % или 10 % раствор аммиака. Прибавляют 0,05 г индикаторной смеси ксиленолового оранжевого и медленно титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 10,45 мг висмута.
Кальций
Точную навеску препарата (соответствующую 0,04 – 0,05 г кальция) растворяют, как указано в фармакопейной статье, в воде или хлористоводородной кислоте разведенной 8,3 % и далее проводят определение по одному из приведенных способов:
- Доводят объем раствора водой до 100 мл и титруют натрия эдетата раствором 0,05 М. В конце титрования прибавляют 4 мл натрия гидроксида раствора 30 % и 3 мл раствора хальконкарбоновой кислоты – появляется розовое окрашивание. Продолжают титрование до перехода окраски в интенсивно синий цвет.
- Доводят объем раствора водой до 50 мл, прибавляют 10 мл буферного раствора аммония хлорида рН 10,0; 0,1 г индикаторной смеси или 7 капель раствора индикатора хромового темно-синего и титруют натрия эдетата раствором 0,05 М до сине-фиолетового окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 2,004 мг кальция.
Магний
Точную навеску препарата (соответствующую 0,02 – 0,03 г магния) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 10 мл буферного раствора аммония хлорида рН 10,0; 0,1 г индикаторной смеси или 7 капель раствора индикатора кислотного хром черного специального и титруют натрия эдетата 0,05 М раствором до синего окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 1,215 мг магния.
Свинец
Точную навеску препарата (соответствующую 0,1 – 0,2 г свинца) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 0,05 г индикаторной смеси ксиленолового оранжевого, 5,0 г гексаметилентетрамина и титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
1 мл натрия эдетата 0,05 М раствора соответствует 10,36 мг свинца.
Точную навеску препарата (соответствующую 0,06 – 0,08 г цинка) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 0,05 г индикаторной смеси ксиленолового оранжевого, 5,0 г гексаметилентетрамина и титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 3,269 мг цинка.
http://electrochemistry.ru/methods/titrimetricheskiy-analiz/kompleksonometricheskoe-titrovanie/
http://farmf.ru/prochee/kompleksonometricheskoe-titrovanie-ofs-1-2-3-0015-15/