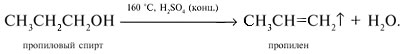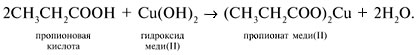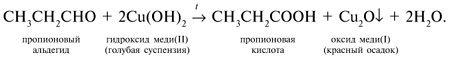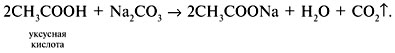Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df4c548fdcd7a69 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
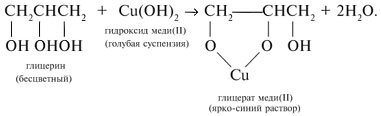
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Уравнения реакции с пропионовой кислотойCH3-CH(OH)-CH3 + CH3-CH2-COOH = CH3-CH2-COOCH(CH3)2 (над = H+) изопропиловый эфир пропионовой кислоты Реакция этерификации-образование сложных эфиров путём слияния кислот и спиртов.например CH3COOH(уксусная кислота)+C2H5OH(этиловый спирт)=CH3COOC2H5+H2O -этиловый эфир уксусной кислоты. изопропиловый+пропионовый кислото→ реакция как?? Ответы:Реакция этерификации-образование сложных эфиров путём слияния кислот и спиртов.например CH3COOH(уксусная кислота)+C2H5OH(этиловый спирт)=CH3COOC2H5+H2O -этиловый эфир уксусной кислоты. CH3-CH(OH)-CH3 + CH3-CH2-COOH = CH3-CH2-COOCH(CH3)2 (над = H+) изопропиловый эфир пропионовой кислоты Рассмотрим логические задачи, в которых с использованием физических и химических свойств веществ требуется: а) угадать вещество; б) различить предложенные вещества; в) приписать соединению химическую формулу; г) найти способ разделения смеси заданных веществ; Решение Представим физические свойства заданных веществ в виде таблицы (табл. 14). Физические свойства гидроксилсодержащих соединений
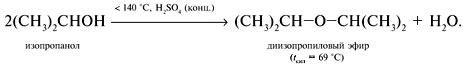
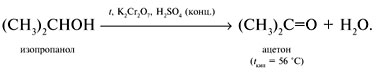
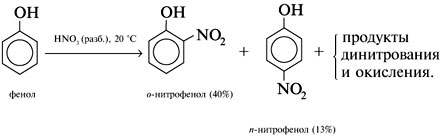
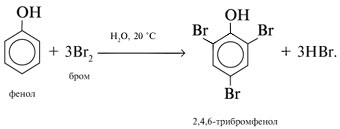
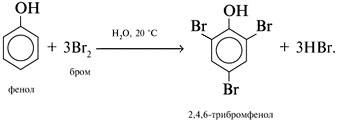
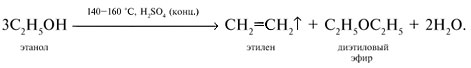
Реакции спирта изопропанола (СН3)2СНОН 1. Реакция с соляной кислотой: 2. Внутримолекулярная дегидратация с образованием алкена: 3. Межмолекулярная дегидратация с образованием простого эфира: 4. Окисление до кетона: Реакции фенола С6Н5ОН 1. Образование соли фенолята натрия в реакции со щелочью: 2. Нитрование в ароматическое бензольное кольцо: 3. Галогенирование (бромирование) в бензольное кольцо: 4. Цветная реакция фенола с хлоридом железа(III) – фиолетовое окрашивание. Действия при распознавании веществ (на примере уксусной кислоты)Задача 2. Как различить водные растворы фенола, этанола и уксусной кислоты? Решение Водные растворы каждого из предложенных веществ имеют свой специфический запах – фенольный, спиртовой и запах уксуса. Универсальный бумажный индикатор в водной уксусной кислоте показывает рН раствора 4–6. Достаточно концентрированные растворы ( При добавлении бромной воды к раствору фенола образуется белый осадок нерастворимого в воде 2,4,6-трибромфенола: Кипячение водного этанола (> 50%) с концентрированной серной кислотой сопровождается внутри- и межмолекулярной дегидратацией с образованием газа этилена и легкокипящего диэтилового эфира: Задача 3. 1 моль некоторого органического вещества присоединяет лишь Решение Из условия можно предположить, что искомое вещество содержит две функциональные группы – непредельную связь и альдегидную группу. Общая формула кислородсодержащего соединения – СхНyОz. Соотношение индексов: x:y:z = [m(C)/M(C)]:[m(H)/M(H)]:[m(O)/M(O)] = Рассчитаем количества веществ продуктов горения по формуле
Количества веществ элементов С и Н в исходном соединении такие:
что соответствует массам: m(С) = 0,06•12 = 0,72 г, m(Н) = 0,08•1 = 0,08 г. Содержание кислорода по массе в определяемом веществе: 1,12 – 0,72 – 0,08 = 0,32, г,
Найдем соотношение чисел атомов С, Н и О в молекуле СхНyОz, т.е. индексы в химической формуле: Простейшей молекулярной формуле С3Н4О1 отвечает структурная формула СН2=СНСНО, это – акролеин. Задача 4. Органическое вещество А массой 7,2 г присоединяет бромоводород. Продукт реакции под действием оксида серебра переходит в соединение, которое при осторожном окислении образует 10,4 г твердого вещества Б. Вещество Б при нагревании выше температуры плавления разлагается, образуя летучую кислоту массой 6,0 г (в составе которой 40% углерода, 6,7% водорода, 53,3% кислорода) и 4,4 г газа с содержанием кислорода 72,72% по массе. Определите вещество А и напишите уравнения указанных реакций. Решение Составим план решения задачи. Оксид серебра обычно упоминается в задачах как слабый окислитель, используемый для превращения альдегидной группы СНО в карбоксильную группу СООН, т.е. в реакции (2′) R’ = СНО: Непонятной остается фраза, относящаяся к третьей реакции: «При осторожном окислении… образует твердое вещество Б». Во-первых, какой атом окисляется? Во-вторых, что представляет собой твердое вещество Б? Поэтому реакцию (3′) мы пока пропускаем. Газ с x:y:z = [ Простейшая формула вещества – СН2О. Это альдегид, а не кислота. Удвоенная простейшая формула С2Н4О2 соответствует уксусной кислоте СН3СООН, М = 60 г/моль. Количества веществ продуктов реакции и исходного вещества в реакции (4′):
Молярная масса вещества Б: М = m/ Еще раз проанализировав условие задачи, можно догадаться, что исходное вещество А – акриловая кислота, и реакция (1) имеет вид: Реакция (2) состоит в замещении атома брома в 3-бромпропионовой кислоте на гидроксильную группу воды с осаждением бромида серебра: Окисление спиртового углерода 3-гидроксипропионовой кислоты дает малоновую кислоту (реакция 3): Ответ. Вещество А – акриловая кислота СН2=СНСООН.
|

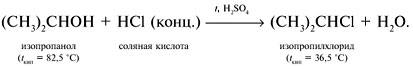

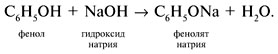
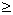 50%) этанола и пары уксусной кислоты при поджигании горят на воздухе. При упаривании растворы этанола и кислоты не дают остатка. После упаривания водного раствора фенола и охлаждения выделяются розовые кристаллы фенола (tпл(С6Н5ОН) = 41 °С).
50%) этанола и пары уксусной кислоты при поджигании горят на воздухе. При упаривании растворы этанола и кислоты не дают остатка. После упаривания водного раствора фенола и охлаждения выделяются розовые кристаллы фенола (tпл(С6Н5ОН) = 41 °С). 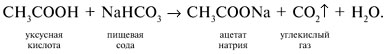
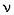 (C):
(C):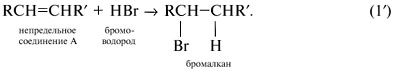
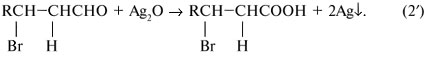
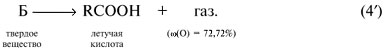
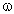 (О) = 72,72% – это СО2, М(СО2) = 44 г/моль. Летучая кислота общей формулы СхНyОz имеет следующее соотношение индексов:
(О) = 72,72% – это СО2, М(СО2) = 44 г/моль. Летучая кислота общей формулы СхНyОz имеет следующее соотношение индексов: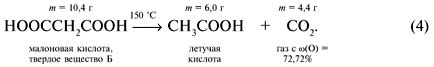


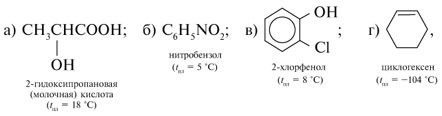
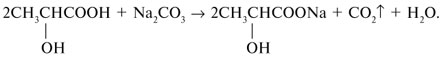
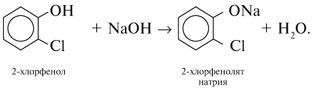
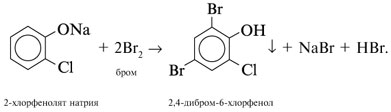
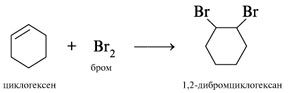
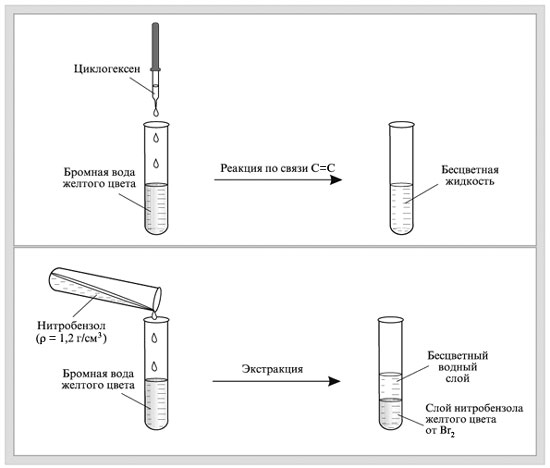
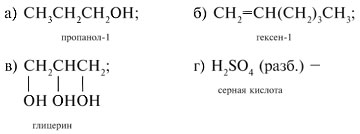
 .
.