Урок химии по теме «Реакции замещения». 8-й класс
Разделы: Химия
Класс: 8
Тип урока: изучение нового материала.
Цели и задачи урока: Дать понятие о сущности реакции замещения. Продолжить формирование умения записывать уравнения химических реакций, начать формировать умение предсказывать продукты реакций замещения. Дать первоначальное понятие об электрохимическом ряде напряжений.
Оборудование: прибор для получения газов, Zn, Мg, А1, Сu, Са — металлы, растворы НС1, СиSО4, АgNO3, медная монета.
План урока.
- Химические реакции
- Признаки химической реакции
- Уравнение реакции.
- Типы химических реакций
- Понятие о реакциях замещения на примере взаимодействия кислот с металлами. Демонстрация взаимодействия металлов с кислотами и выделение водорода.
- Электрохимический ряд напряжений металлов и два его правила. Эксперимент (взаимодействие металлов с кислотами).
- Схема эксперимента и выводы из опыта.
- Доказательство через уравнения реакций.
- Выполнение упражнений для закрепления полученных знаний.
- Домашнее задание.
Ход урока
1 этап урока – подготовка к изучению нового материала, актуализация знаний и опыта.
Ставятся вопросы для уточнения содержания основных понятий.
- Дайте определение химическим реакциям
- По каким признакам мы определяем, что процесс относится к химическим?
- что называют уравнением химической реакции?
- Какие типы реакций вам известны?
2 этап урока – проблемно-поисковый.
Сегодня мы познакомимся еще с одним типом реакций. Попробуем научиться предсказывать продукты химических реакций. Для этого повторим опыт лорда Генри Кавендиша (получение водорода Zn + 2HCl = ZnCl2 + H2).
В результате данной реакции выделяется водород.
Вопрос. Почему я собираю этот газ в перевернутую вверх дном пробирку? (если у ребят возникают затруднения поясняем способ собирания газа)
Подносим пробирку к пламени спиртовки. Раздается “лающий” звук. Закрываем газоотводную трубку и через 5 -10 с подносим к пламени раздается легкий хлопок. Почему мы наблюдаем разные результаты? (версии учащихся).
Объяснение проверки водорода на чистому. Правила техники безопасности выполнения эксперимента.
Запишем уравнение реакции:
Кроме водорода будут ли другие продукты реакции?
Проведем следующий опыт: На предметное стекло поместим каплю раствора из пробирки-реактора, выпариваем, на стекле белое пятно – это соль ZnCl2.Учащему, предлагается дописать уравнение реакции и расставить коэффициенты. Следовательно, из исходных простого и сложного вещества образовались новое простое и новое сложное. Определение реакции замещения (записываем в тетрадь). Предлагается записать уравнение реакции магния с соляной кислотой, и более сложный вариант: алюминия с серной кислотой.
Вопрос. А любой ли металл способен вступать в реакцию замещения с кислотой?
Демонстрация: в четырех пробирках находится соляная кислота. В первую опускаем Ca, вторую – Mg, третью – Zn, четвертую – Cu. Почему выделение водорода происходит с разной скоростью, а в четвертой пробирке не выделяется вообще? Для ответа можно воспользоваться еще одной узаконенной “шпаргалкой” – электрохимическим рядом напряжения металлов ( его можно также назвать рядом активности металлов).
Если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет (записываем в тетрадь).
Это и есть 1-е правило ряда напряжений. Ca, Мg, А1 давали реакцию замещения с кислотами (они находятся в ряду напряжений до Н), а Сu нет (она после Н). Этот ряд имеет и еще одно правило, оно тоже относится к реакциям замещения металлов, но только с растворами солей:
если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли (2-е правило ряда напряжений) (записываем в тетрадь).
Проводится лабораторный опыт “Замещение меди в растворе сульфата меди (II) железом”, и учащиеся записывают соответствующее уравнение:
По аналогии составляется уравнение реакции между алюминием и раствором хлорида меди (II):
Необходимо показать, что здесь положение металла до или после Н уже не имеет значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Серебро на медной монетке получается неэффектное — темный налет, но если его натереть мягкой тряпочкой — монета заблестит, она стала посеребренной.
Учащиеся формулируют выводы:
1) более активный металл вытесняет менее активный из раствора его соли с образованием другого металла и другой соли;
2) металлы расположенные в ряду напряжения до водорода вытесняют водород из растворов кислот;
3) все рассмотренные реакции относятся к реакциям замещения.
3 этап урока – закрепления изученного материала.
Учащиеся попарно выполняют задания по карточке.
- Напишите уравнения возможных реакций между серной кислотой и металлами: а) Zn, б) Сu, в) Fе, г) Ва.
- Напишите уравнения возможных реакций между сульфатом меди (II) и металлами: а) Аg, б) Zn, в) Mg.
Учащимся выдаются правильные ответы, заранее подготовленные учителем.
Дети проверяют и ставят себе оценку.
Объективно выставленные оценки заносятся в журнал.
4 этап – подведение итогов.
Делается вывод о достижении поставленных целей в результате проведенных исследований учащимися совместно с учителем. Результат – наличие положительного мотива к исследовательской деятельности.
Домашнее задание:§31, упр.2 стр.164.
Литература:
- Сгибнеа Е.П., Скачков А.В. Современные открытые уроки химии 8 – 9 классы. [Текст] / Е.П. Сгибнеа, А.В. Скачков – Ростов, 2002 г.
- Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. [Текст] / – О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова . – М., 2003 г.
- Андрейченко Е.И. Проблемно-поисковая (исследовательская) технология в обучении химии.[Текст] / Е.И. Андрейченко // Химия. Приложения 1 сентября.– 2008 – №16.
- Павлова Н.С. Дидактические карточки-задания по химии: 8 класс: .к учебнику О.С.Габриеляна “Химия.8 класс” .[Текст] / Н.С. Павлова. – М., 2004 г.
- Габриелян О.С. Химия 8 класс .[Текст] / О.С. Габриелян. – М.,2006 г.
§ 32. Реакции замещения
Познакомимся с третьим типом реакций — реакциями замещения.
Повторим опыт замечательного английского химика — лорда Г. Кавендиша.
Нальём в пробирку 2—3 мл соляной кислоты, а затем поместим в неё 2—3 гранулы (от греч. гранула — зёрнышко) цинка. Заметим выделение газа. Накроем на 3—4 с пробирку-реактор, в которой протекает реакция, другой пробиркой большего диаметра и соберём в неё выделяющийся газ (методом вытеснения воздуха).
Это возможно потому, что выделяющийся в результате этой реакции газ — водород — гораздо легче воздуха. Приподняв пробирку с водородом над пробиркой-реактором, быстро поднесём её отверстие к пламени горелки. Раздастся взрыв, сопровождающийся характерным «лающим» звуком. Это взрывается смесь водорода с воздухом, которую образно называют «гремучим газом». Точнее, так называют смесь 2 объёмов водорода и 1 объёма кислорода.
Если же закрыть отверстие пробирки-реактора пальцем и через 5—10 с после того, как почувствуется давление собранного в верхней части пробирки газа на палец, убрать его с одновременным поднесением к отверстию горящей спички, то раздастся лёгкий хлопок — результат сгорания чистого водорода. Если несколько капель жидкости, полученной в результате реакции между цинком и соляной кислотой, поместить на часовое стекло и выпарить, то можно заметить образование кристалликов соли — хлорида цинка.
Составим уравнение реакции цинка с соляной кислотой:
Аналогичную реакцию можно провести и с другим металлом — алюминием:
С раствором серной кислоты цинк и алюминий образуют уже другие соли — сульфаты, например:
Все ли металлы взаимодействуют с кислотами с образованием соли и водорода?
Обратимся к эксперименту. Нальём в четыре одинаковые пробирки равные объёмы соляной кислоты и поместим в них разные металлы: в 1-ю — кусочек кальция, во 2-ю — магния, в 3-ю — цинка, а в 4-ю — меди (рис. 104). Нетрудно заметить, что интенсивность выделения водорода будет уменьшаться от кальция к цинку, а в пробирке с медью газ вообще не выделяется — там не происходит реакция.
Рис. 104.
Взаимодействие различных металлов с соляной кислотой
Для прогнозирования возможности протекания реакций между металлами и кислотами обратимся к так называемому ряду активпости (напряжений) металлов’.
Li, К, Ва, Са, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H2, Cu, Hg, Ag, Au.
Почему же в ряд металлов попал неметалл — водород? Оказывается, каждый из металлов, расположенных в ряду активности металлов до водорода, способен вытеснять его из растворов кислот. А вот медь с соляной кислотой не взаимодействует и поэтому находится в ряду активности металлов после водорода. В пробирке с этим металлом и соляной кислотой реакции не наблюдалось. Аналогично не будут вытеснять водород из растворов кислот ртуть, серебро и золото.
Ряд активности металлов можно также использовать для прогнозирования возможности протекания реакций вытеснения одних металлов из растворов их солей другими.
Рис. 105.
Реакция замещения меди железом в растворе сульфата меди (II)
Обратимся к эксперименту: поместим в химический стакан с раствором сульфата меди (II) большой железный гвоздь. Уже через 2—3 мин можно заметить, что та часть гвоздя, которая находится в растворе, покрылась красным налётом выделившейся меди (рис. 105). Произошла реакция, уравнение которой:
Цинк взаимодействует с растворами солей меди и серебра, но не магния или цинка (рис. 106).
Рис. 106.
Взаимодействие цинка с растворами различных солей
Для того чтобы реакция между металлом и раствором соли была практически осуществима, необходимо выполнение следующего условия: металл должен располагаться в ряду активности металлов левее металла, входящего в соль, т. е. быть активнее металла соли. Поэтому медь не вступает в реакцию с раствором соли свинца или железа, но зато вытесняет серебро из раствора нитрата серебра (рис. 107):
Рис. 107.
Кристаллы серебра, выделившиеся на медной проволоке в результате реакции замещения меди в растворе нитрата серебра
Все рассмотренные выше реакции относят к реакциям замещения. Нетрудно заметить, что эти реакции протекают между двумя исходными веществами, одно из которых простое, а другое — сложное, а в результате получаются два новых вещества — новое простое и новое сложное.
| Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе. |
Лабораторный опыт № 16
Замещение меди в растворе сульфата меди (II) железом
- Налейте в две пробирки по 2 мл раствора сульфата меди (II). Опишите цвет раствора. Осторожно погрузите в одну из пробирок железный гвоздь (скрепку), привязанный на нитке. Опишите условие проведения реакции.
Через 5 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения. Образованием какого вещества они вызваны? Опишите цвет образовавшегося раствора и сравните его с цветом исходного раствора. Напишите уравнение реакции сульфата меди (II) с железом, учитывая, что в продукте реакции степень окисления железа равна +2.
Ключевые слова и словосочетания
- Реакции замещения.
- Ряд активности металлов.
- Условия взаимодействия металлов с растворами кислот и солей.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Какие реакции называют реакциями замещения? Сравните их с реакциями соединения и разложения.
- Запишите уравнения следующих реакций замещения:
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
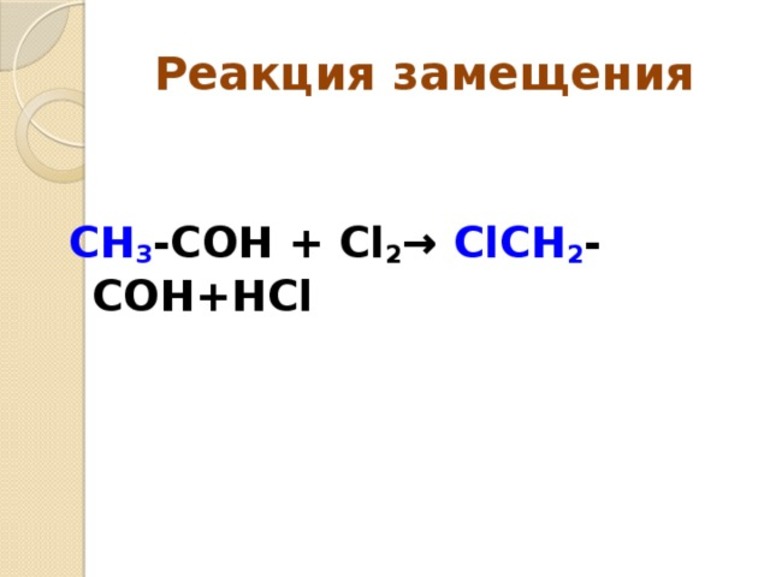
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
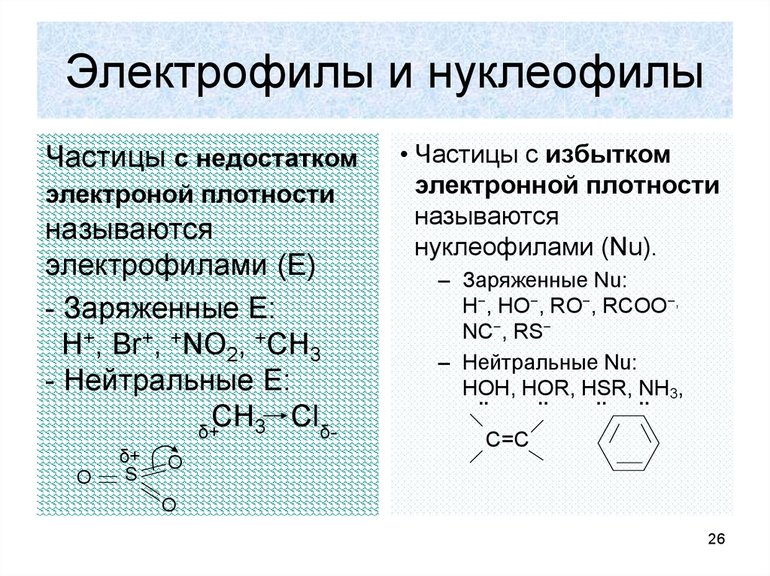
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
http://tepka.ru/himiya_8/32.html
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html