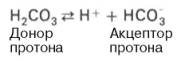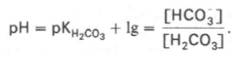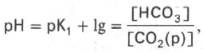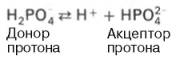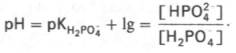Быстрая компенсация сдвигов рН
Буферные системы
Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н + . Любая буферная система — это кислотно-основная пара: слабое основание (анион, А – ) и слабая кислота (Н-Анион, H-А). Они минимизируют сдвиги количества ионов Н + в растворе за счет их связывания с анионом и включения в плохо диссоциирующее соединение – в слабую кислоту. Поэтому общее количество ионов Н + изменяется не так заметно, как это могло бы быть.
Существует три буферные системы жидкостей организма – бикарбонатная, фосфатная, белковая (включая гемоглобиновую).Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Фосфатная буферная система
Фосфатная буферная система составляет около 2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована гидрофосфатом (HPO4 2– ) и дигидрофосфатом (H2PO4 – ). Дигидрофосфат слабо диссоциирует и ведет себя как слабая кислота, гидрофосфат обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 – равно 4 : 1.
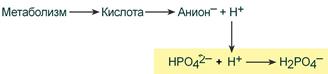
При взаимодействии кислот (ионов Н + ) с двузамещенным фосфатом (HPO4 2‑ ) образуется дигидрофосфат (H2PO4 – ):
Удаление ионов H + фосфатным буфером
В результате концентрация ионов Н + понижается.
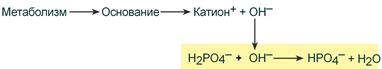
При поступлении в кровь оснований (избыток ОН – ‑групп) они нейтрализуются поступающими в плазму от H2PO4 – ионами Н + :
Удаление щелочных эквивалентов фосфатным буфером
Роль фосфатного буфера особенно высока во внутриклеточном пространстве и в просвете почечных канальцев. Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата (H 2 PO 4 – ), т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Бикарбонатная буферная система
Эта система самая мощная, на ее долю приходится 65% всей буферной мощности крови. Она состоит из бикарбонат-иона (НСО3 – ) и угольной кислоты (Н2СО3). В норме отношение HCO3 – к H2CO3 равно 20 : 1.
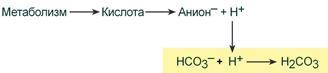
При поступлении в кровь ионов H + (т.е. кислоты) ионы бикарбоната натрия взаимодействуют с ней и образуется угольная кислота:
При работе бикарбонатной системы концентрация водородных ионов понижается, т.к. угольная кислота является очень слабой кислотой и плохо диссоциирует. При этом в крови не происходит параллельного значимого увеличения концентрации НСО3 – .
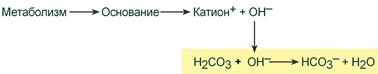
Если в кровь поступают вещества с щелочными свойствами, то они реагируют с угольной кислотой и образуют ионы бикарбоната:
Работа бикарбонатного буфера неразрывно связана с дыхательной системой (с вентиляцией легких). В легочных артериолах при снижении плазменной концентрации СО2 и благодаря присутствию в эритроцитах фермента карбоангидразы угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Белковая буферная система
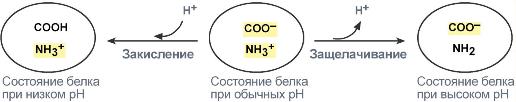
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
В кислой среде подавляется диссоциация СООН‑групп аминокислотных радикалов (в аспарагиновой и глутаминовой кислотах), а группы NH2 (в аргинине и лизине) связывают избыток Н + . При этом белок заряжается положительно.
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н + связывают избыток ОН – ‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
Изменение заряда буферных групп белка при различных рН
Гемоглобиновая буферная система
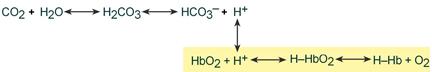
Высокой мощностью в крови обладает гемоглобиновый буфер, на него приходится до 28% всей буферной емкости крови. В качестве кислой части буфера выступает оксигенированный гемоглобин H‑HbO2 . Он имеет выраженные кислотные свойства и в 80 раз легче отдает ионы водорода, чем восстановленный Н‑Нb , выступающий как основание. Гемоглобиновый буфер можно рассматривать как часть белкового, но его особенностью является работа в теснейшем контакте с бикарбонатной системой.
Изменение кислотности гемоглобина происходит в тканях и в легких, и вызывается связыванием соответственно H + или О2. Непосредственный механизм действия буфера заключается в присоединении или отдаче иона H + остатком гистидина в глобиновой части молекулы (эффект Бора).
В тканях более кислый pH в норме является результатом накопления минеральных (угольной, серной, соляной) и органических кислот (молочной). При компенсации pH данным буфером ионы H + присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора) и он превращается в восстановленный H‑Hb.
В результате снижается количество кислот, в первую очередь Н2СО3, продуцируются ионы НСО3 ‑ и тканевое пространство подщелачивается.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н + в среду, предотвращая повышение рН:
Работу гемоглобинового буфера рассматривают неотрывно от бикарбонатного буфера:
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газообмен в легких и тканях).
Уравнения реакций бикарбонатной буферной системы
Бикарбонатная буферная система является наиболее важным внеклеточным буфером. Недооценка реальной силы этой буферной системы, кривая титрования которого изображена на рисунке ниже, возможна по двум причинам.
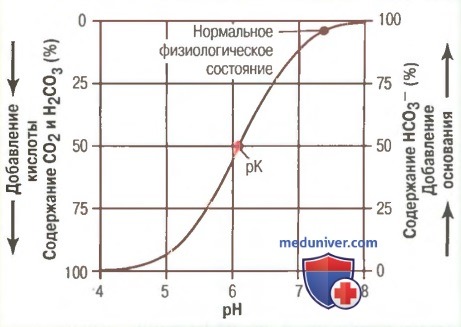
Во-первых, рН внеклеточной жидкости составляет около 7,4, тогда как рК бикарбонатной буферной системы — 6,1. Это означает, что содержание бикарбонатов в буферной системе примерно в 20 раз превышает содержание растворенного CO2, поэтому система действует в более пологой части кривой, где буферная емкость незначительна.
Во-вторых, содержание двух компонентов бикарбонатной буферной системы (CO2 и HCO3 — ) невелико.
Несмотря на эти отрицательные характеристики, бикарбонатная буферная система во внеклеточной жидкости является наиболее мощной системой. Этот явный парадокс основан на том, что содержание двух ее компонентов (CO2 и HCO3 — ) точно регулируется почками, выводящими или увеличивающими содержание бикарбонатов, а также дыхательной системой, регулирующей выделение CO2 легкими.
Относительная ёмкость буферов крови
Фосфатная буферная система
Значение фосфатной буферной системы для внеклеточной жидкости невелико, но эта система играет основную роль в поддержании кислотно-щелочного равновесия в просвете канальцев почки, а также внутриклеточной жидкости. Основными компонентами фосфатной буферной системы являются H2PO4 и HPO4 2- . При добавлении к смеси указанных веществ сильной кислоты, например HCl, протоны связываются основанием HPO4 2- , преобразуясь в Н2РО4:
В результате этой реакции сильная кислота НСl замещается слабой NaH2PO4, поэтому рН снижается незначительно.
Добавление к буферной системе сильного основания, например NaOH, связывает ионы ОН- с помощью H2PO4 — , дополнительно образуя HPO4 2- и H2O: NaOH + NaH2PО4 -> Na2HPО4 + H2O.
В этом случае сильное основание NaOH обменивается на более слабое NaH2PO4, увеличение рН при этом незначительно.
рК фосфатного буфера составляет 6,8, что близко к нормальному значению рН в жидких средах (7,4). Это позволяет системе действовать в пределах почти максимальной буферной емкости. Однако поскольку концентрация компонентов этой системы составляет лишь 8% по сравнению с бикарбонатами, ее буферная емкость во внеклеточной жидкости невелика и значительно уступает бикарбонатной буферной системе.
В отличие от внеклеточной жидкости фосфатная буферная система играет особую роль в просвете почечных канальцев по двум причинам:
(1) содержание фосфатов в канальцах существенно возрастает, благодаря чему возрастает буферная емкость мочи;
(2) рН мочи в канальцах обычно ниже, чем во внеклеточной жидкости, таким образом рабочий диапазон фосфатной системы приближен к значению рК (6,8).
Фосфатная буферная система также имеет большое значение для поддержания кислотно-щелочного равновесия внутри клетки, поскольку концентрация фосфатов во внутриклеточной жидкости во много раз больше, чем вне клетки. рН внутри клетки ниже, чем во внеклеточной жидкости, и близка по значению к рК для фосфатной буферной системы.
Буферные системы крови
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемогло-биновая.
Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3 – , выполняющего роль акцептора протона:
Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н + взаимодействуют с ионами бикарбоната НСО3 – , что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4 – (донор протонов) и иона НРО4 2– (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО4 2– ]: [Н2РО4 – ] составляет 4:1. Величина рКН2РО4– равна 6,86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – (Н + + + НРО4 2– —> Н2РО4 – ), а также ионов ОН – с ионами Н2РО4 – (ОН – + + Н2 Р О4 – —> HPO4 2– + H2O). Буферная пара (Н2РО4 – –НРО4 2– ) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н + (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови . Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
http://meduniver.com/Medical/Physiology/765.html
http://xumuk.ru/biologhim/255.html