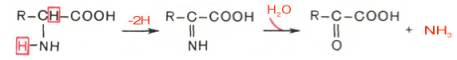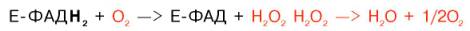Катаболизм аминокислот начинается с дезаминирования
У человека основным способом дезаминирования является окислительное дезаминирование . Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода ( аэробное ) и не нуждаться в кислороде ( анаэробное ).
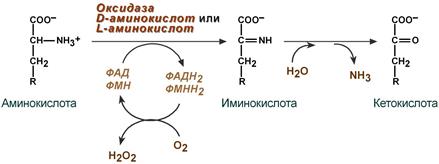
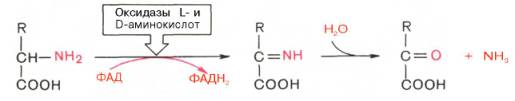
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Реакция, катализируемая оксидазами D- и L-аминокислот
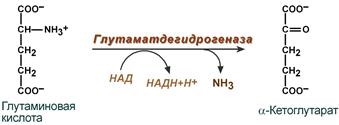
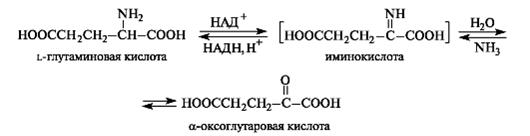
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой , превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
Реакция прямого окислительного дезаминирования
глутаминовой кислоты
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
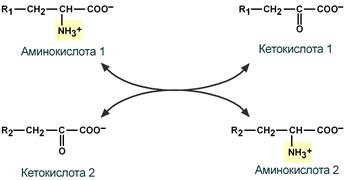
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
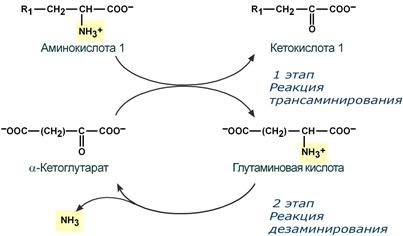
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование .
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота , то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование .
Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
- является одной из транспортных форм аминного азота в гепатоциты,
- способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина).
Процесс трансдезаминирования идет в организме непрерывно, потому что:
- сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты
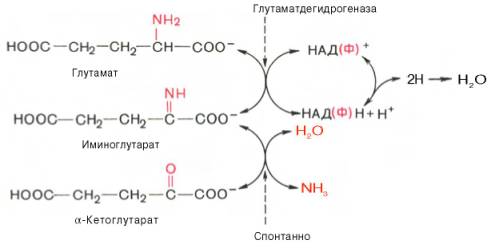
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа[1], коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат.
Окислительное дезаминирование глутамата — обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата.
Дата добавления: 2015-05-26 ; просмотров: 1505 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Дезаминирование аминокислот
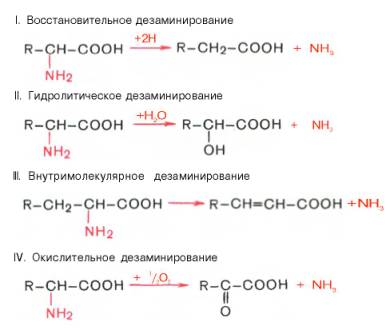
Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.
Рассмотрим более подробно механизм окислительного дезаминирования аминокислот, протекающего в две стадии.
Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается на аммиак и α-кетокислоту.
Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы. Схематически реакции окислительного дезаминирования аминокислот с участием коферментов могут быть представлены в следующем виде:
Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая дезаминирование 12 природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН 10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят исключительно из природных (L-изомеров) аминокислот.
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент (глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутаматдегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и α-кетоглутаровую кислоту в соответствии со следующей схемой:
Первая стадия окисления глутаминовой кислоты аналогична реакции окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы (см. главу 9) с образованием конечного продукта воды. Образовавшийся аммиак благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного НАДФН может участвовать в синтезе глу-тамата из α-кетоглутаровой кислоты. Различают три разных типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ (клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциации этой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе глутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.
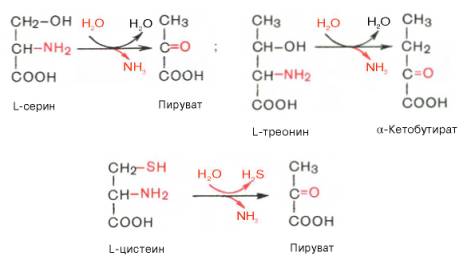
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. Поскольку указанные ферменты требуют присутствия пиридоксальфосфата в качестве кофермента, реакция неокислительного дезаминирования, вероятнее всего, протекает с образованием шиффовых оснований как промежуточных метаболитов.
Наиболее изучен фермент треониндегидратаза, которая оказалась не только аллостерическим ферментом, но наряду с триптофан-2,3-диокси-геназой и тирозинаминотрансферазой индуцибельным ферментом в животных тканях (индукция синтеза ферментов de novo является общим свойством микроорганизмов). Так, при скармливании крысам гидролизата казеина активность треониндегидратазы печени повышается почти в 300 раз. Этот синтез тормозится ингибитором белкового синтеза пуромицином. Поскольку индукция почти полностью тормозится также глюкозой пищи, треонингидратаза, по-видимому, является ответственной за глюконеогенез, так как α-кетобутират легко превращается в пируват и соответственно в глюкозу.
http://helpiks.org/3-60937.html
http://xumuk.ru/biologhim/190.html