Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
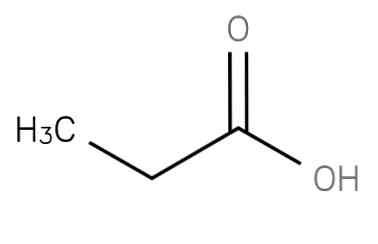
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Формула пропановой кислоты, свойства, риски и использованиепропановая кислота представляет собой насыщенную жирную кислоту с короткой цепью, содержащую этан, связанный с атомом углерода карбоксигруппы. Его формула CH3-СН2-COOH. Анион CH3CH2COO-, а также соли и эфиры пропановой кислоты известны как пропионаты (или пропаноаты).. Он может быть получен из отходов древесной массы в процессе ферментации с использованием бактерий рода Propionibacterium. Его также получают из этанола и оксида углерода с использованием катализатора на основе трифторида бора (O’Neil, 2001).. Другим способом получения пропановой кислоты является окисление пропиональдегида в присутствии ионов кобальта или марганца. Эта реакция быстро развивается при температурах до 40-50 ° C: Это соединение естественно присутствует в молочных продуктах на низких уровнях и производится в общем виде вместе с другими короткоцепочечными жирными кислотами в желудочно-кишечном тракте человека и других млекопитающих как конечный продукт микробного переваривания углеводов.. Обладает значительной физиологической активностью у животных (База данных метаболома человека, 2017).
Физико-химические свойстваПропановая кислота представляет собой бесцветную и маслянистую жидкость с резким, неприятным и прогорклым запахом. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017). Пропановая кислота имеет молекулярную массу 74,08 г / моль и плотность 0,992 г / мл. Температура замерзания и кипения составляет -20,5 ° C и 141,1 ° C соответственно. Пропановая кислота представляет собой слабую кислоту, чья рКа составляет 4,88. Соединение очень хорошо растворяется в воде, способно растворять 34,97 грамма соединения на 100 мл растворителя. Он также растворим в этаноле, эфире и хлороформе (Royal Society of Chemistry, 2015). Пропановая кислота имеет промежуточные физические свойства между свойствами более мелких карбоновых кислот, муравьиной и уксусной кислот и более крупных жирных кислот.. Он показывает общие свойства карбоновых кислот и может образовывать производные амидов, сложных эфиров, ангидридов и хлоридов. Он может подвергаться альфа-галогенированию с бромом в присутствии PBr3 в качестве катализатора (реакция HVZ) с образованием CH3CHBrCOOH. Реактивность и опасностиПропановая кислота является легковоспламеняющимся и горючим материалом. Он может воспламениться от жары, искр или пламени. Пары могут образовывать взрывоопасные смеси с воздухом, способные перемещаться к источнику воспламенения и взрываться. Большинство паров тяжелее воздуха. Они будут распространяться по земле и будут собираться в низких или ограниченных областях (канализация, подвалы, резервуары). Опасность взрыва пара в помещении, на улице или в канализации. Вещества, обозначенные (P), могут полимеризоваться взрывоопасно при нагревании или в огне. Контейнеры могут взорваться при нагревании (PROPIONIC ACID, 2016). Смесь следует хранить вдали от источников тепла и источников возгорания. При нагревании до разложения выделяет едкий дым и раздражающие пары. Пропановая кислота раздражает кожу, глаза, нос и горло, но не оказывает острого системного действия и не обладает явным генотоксическим потенциалом. При попадании на кожу следует промыть их большим количеством воды (паспорт безопасности материала Пропионовая кислота, 2013). биохимияОснование конъюгата пропановой кислоты, пропионат, образуется в качестве концевого фрагмента из трех атомов углерода (активированного коэнзимом А в виде пропионил-КоА) при окислении нечетных углеродных жирных кислот и окислении боковой цепи холестерин. Эксперименты с радиоактивными изотопами пропионата, введенными крысам натощак, показывают, что он может появляться в гликогене, глюкозе, промежуточных продуктах цикла лимонной кислоты, аминокислотах и белках.. Путь метаболизма пропановой кислоты включает взаимодействие с коферментом А, карбоксилирование с образованием метилмалонил-кофермента А и превращение в янтарную кислоту, которая входит в цикл лимонной кислоты. Пропановая кислота может окисляться без образования кетоновых тел и, в отличие от уксусной кислоты, входит в состав углеводов, а также липидов (Bingham, Cohrssen, & Powell, 2001). Пропионовая ацидурия является одной из наиболее частых органических ацидозов, заболеванием, которое включает в себя множество различных. Результаты пациентов, родившихся с пропионовой ацидурией, имеют слабые паттерны интеллектуального развития: 60% имеют IQ менее 75 и требуют специального образования. Успешные пересадки печени и / или почек у нескольких пациентов привели к улучшению качества жизни, но не обязательно предотвратили неврологические и висцеральные осложнения. Эти результаты подчеркивают необходимость постоянного метаболического мониторинга, независимо от терапевтической стратегии.. приложенийПропановая кислота подавляет рост бактерий и плесени на уровне от 0,1 до 1% по весу. В результате большая часть производимой пропановой кислоты потребляется в качестве консерванта для кормов и пищевых продуктов для потребления человеком, таких как зерновые и злаки.. Консервация кормов, зерновых и продуктов питания, а также производство пропионата кальция и натрия, который составляет почти 80% мирового потребления пропановой кислоты в 2016 году, по сравнению с 78,5% в 2012 году.. Приблизительно 51% мирового потребления пропановой кислоты используется для кормления животных и сохранения зерна, в то время как почти 29% используется для производства пропионатов кальция и натрия, которые также используются в пищевой и кормовой промышленности.. Другими важными рынками сбыта пропановой кислоты являются производство гербицидов и диэтилкетона. Области применения с меньшим объемом включают ацетон пропионат целлюлозы, фармацевтические препараты, сложные эфиры растворителей, ароматизаторы и ароматизаторы, пластификаторы, красители и вспомогательные вещества для текстиля, кожу и резину.. Потребность в пропановой кислоте в значительной степени зависит от производства кормов и круп, за которыми следуют фасованные продукты и хлебобулочные изделия.. Перспективы глобального роста пропановой кислоты и ее солей в кормах для животных / зерновых и консервирования продуктов питания являются значительными (IHS Markit, 2016). Другие быстрорастущие рынки включают сложные эфиры пропионата для растворителей, такие как н-бутилпропионат и пентил; Эти сложные эфиры все чаще используются в качестве заменителей растворителей, включенных в список опасных загрязнителей воздуха.. Карбоновые кислотыКарбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH. Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 . Классификация карбоновых кислотПо количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят. Номенклатура и изомерия карбоновых кислотНазвания карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д. Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами. Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты. При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот. При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала. Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли. Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I. Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты). При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота. Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется. Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II. Химические свойства карбоновых кислотДля карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты. Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты. Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода. Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная. Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность. Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала. В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду. При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ. Сложные эфирыПолучение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта. Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота. Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров. АнгидридыАнгидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации. Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V. Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена. Непредельные карбоновые кислотыРаспределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. источники: http://ru.thpanorama.com/articles/qumica/cido-propanico-frmula-propiedades-riesgos-y-usos.html http://studarium.ru/article/190 |