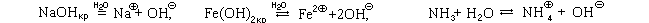Запишите уравнения химических реакций, характеризующие свойства: a) MgO и SO3; б) Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Уравнения реакций характеризующие химические свойства
К основаниям относятся:
а) ионные гидроксиды, соответствующие основным оксидам (см. § 13.4);
б) некоторые не содержащие гидроксидных ионов вещества, молекулы которых способны принимать протон (аммиак NH3, гидразин N2H4 и некоторые другие соединения).
Частицами-основаниями в этих веществах являются или гидроксид-ионы (а), или сами молекулы оснований (б).
Все основания удобно разделить на три группы: I — растворимые ионные основания (щелочи), II — нерастворимые (то есть очень мало растворимые) основания и III — молекулярные основания.
Все растворимые ионные основания (щелочи) являются сильными основаниями. Из нерастворимых гидроксидов слабыми являются только те, которые в той или иной степени проявляют амфотерные свойства. Все молекулярные основания — слабые.
Основания I группы в воде химически растворяются, основания II группы также химически растворяются в воде, но крайне незначительно, а растворение оснований III группы — отчасти физическое, а отчасти химическое (часть растворившихся молекул обратимо реагирует с водой):
.
По той или иной причине в растворах оснований присутствуют гидроксид-ионы, поэтому растворы оснований I и III группы изменяют окраску кислотно-основных индикаторов.
Реакции, характеризующие химические свойства оснований, распадаются на две группы. К первой относятся КОР, связанные с наличием в составе оснований частиц, способных принимать протон (частиц-оснований). Это реакции с веществами, содержащими частицы-кислоты или амфолиты (см. рис. 12.1): с сильными кислотами, со слабыми кислотами (в том числе с катионными) и с кислыми солями.
1) Все основания реагируют с растворами сильных кислот, то есть с растворами, содержащими ионы оксония.
OH + H3O
= 2H2O, Fe(OH)2 + 2H3O
= Fe 2
+ 4H2O, NH3 + H3O
= NH4
+ H2O,
NaOHр + HNO3р = NaNO3р + H2O, Fe(OH)2 + 2HClр = FeCl2р + 2H2O, NH3 + HClO4р = NH4ClO4р.
1а) Сильные основания реагируют и со слабыми кислотами:
OH + HNO2 = H2O + NO2
, 2OH
+ H2SiO3 = 2H2O + SiO3 2
,
KOHp + HNO2p = H2O + KNO2p, 2KOHp + H2SiO3 = 2H2O + K2SiO3p.
Возможность реакции слабого основания со слабой кислотой определяется общим правилом, определяющим направление протекания КОР.
Кислотно-основные реакции между веществами-основаниями и веществами-кислотами могут протекать и в отсутствие воды:
KOHкр + H3PO4ж = KH2PO4кр + H2O; Mg(OH)2кр + 2HClг = MgCl2кр + 2H2O; NH3г + HClг = NH4Clкр.
Правда, практическое значение эти реакции имеют только для оснований III группы, так как в остальных случаях вода образуется сразу после начала реакции.
2) Растворимые основания реагируют с растворами кислых солей, содержащими как анионы-амфолиты, так и гидросульфат-ион и подобные ему частицы-кислоты:
OH + HCO3
= H2O + CO3 2
, NH3 + HSO4
= NH4
+ SO4 2
,
NaOHр + NaHCO3р = H2O + Na2CO3р; 2NH3 + 2NaHSO4р = Na2SO4p + (NH4)2SO4p.
Гидросульфаты, кроме того, реагируют и с нерастворимыми основаниями.
3) Растворимые основания реагируют с растворами солей, в состав которых входят катионные кислоты:
| 2OH |
| 2OH |
| 2NaOHp + FeSO4p = Fe(OH)2 |
| 2NH3 + [Mg(H2O)4] 2 |
| 2NH3 + 2H2O + Mg 2 |
| 2NH3 + 2H2O + MgSO4aq = Mg(OH)2 |
Упрощенно эти реакции можно рассматривать как реакции осаждения из растворов нерастворимых гидроксидов.
Растворы щелочей реагируют с растворами солей, в состав которых входят катионные кислоты и другого типа, иными словами, в том случае, когда при реакции образуется растворимое слабое основание:
OH + NH4
= H2O + NH3, 2KOH + (NH4)2SO4 = K2SO4 + 2NH3 + 2H2O.
В приведенной реакции из концентрированных растворов или при нагревании аммиак может выделяться в виде газа. Выделение аммиака происходит полнее, если концентрированным раствором щелочи обработать твердый сульфат аммония.
Ко второй группе реакций относятся реакции, не являющиеся кислотно-основными и вызванные стремлением к делокализации заряда. Это реакции с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами.
4) Щелочи (и малорастворимые основания) реагируют с кислотными и амфотерными оксидами, при этом в реакции могут вступать, как твердые щелочи (или расплавы)
2KOH + SO3 = K2SO4 + H2O, 2NaOH + Cr2O3 = 2NaCrO2 + H2O (при нагревании),
так и их растворы
2OH + CO2 = CO3 2
+ H2O, 2OH
+ ZnO + H2O = [Zn(OH)4] 2
,
2NaOH + CO2 = Na2CO3 + H2O, 2KOH + ZnO + H2O = K2[Zn(OH)4].
Диоксид кремния с заметной скоростью реагирует только с расплавами щелочей:
SiO2кр + 2NaOHж = Na2SiO3 + H2O (при нагревании).
5) Щелочи реагируют с амфотерными гидроксидами:
2OH + Zn(OH)2 = [Zn(OH)4] 2
, 3OH
+ Cr(OH)3 = [Cr(OH)6] 3
,
2NaOHр + Zn(OH)2 = Na2[Zn(OH)4]р, 3KOHр + Cr(OH)3 = K3[Cr(OH)6]р.
В случае, когда гидроксид гидратирован (свежеосажденный и не высушенный), эти реакции относятся к кислотно-основным.
6) Особняком от первых двух групп реакций стоят реакции, в которых с концентрированными растворами щелочей реагируют амфотерные металлы и некоторые неметаллы:
2OH + Be + 2H2O = [Be(OH)4] 2
+H2
, 2OH
+ Cl2 = Cl
+ ClO
+ H2O,
2NaOHк + Be +2H2O = Na2[Be(OH)4]р +H2 , 2KOHк + Cl2 = KClр + KClOр + H2O.
7) Все нерастворимые гидроксиды (в том числе и основания) легко разлагаются при нагревании (примеры см. в § 2.5).
Растворимые и малорастворимые основания можно получить при взаимодействии с водой соответствующих металлов или оксидов, а нерастворимые — осаждением щелочью из растворов солей.

2.Составьте схему механизма реакции хлора с раствором щелочи (см. гл. 11.4)
3.Получите двумя способами а) гидроксид натрия, б) гидроксид кальция, в) гидроксид лития. 4.Получите из двух различных веществ а) гидроксид магния, б) гидроксид марганца(II), в) гидроксид меди(II).
5.Осуществите превращения: NiO NiSO4
Ni(OH)2
Ni(NO3)2.
6.Определите концентрацию гидроксида лития в растворе, 200 мл которого потребовалось для осаждения из раствора соли 1, 427 г гидроксида железа(III).

К кислотам относятся:
а) ковалентные гидроксиды, соответствующие кислотным оксидам (см. § 13.5) — кислородсодержащие кислоты;
б) ковалентные гидриды — бескислородные кислоты.(По традиции «кислотами» называют водные растворы ковалентных гидридов, например, раствор хлороводорода называют соляной (хлороводородной) кислотой, раствор сероводорода — сероводородной кислотой и т.п. Соответствующие безводные газообразные соединения «кислотами» не называют)
Кроме того, кислотами также являются некоторые ионные вещества, содержащие ионы оксония. Это устойчивые только при низких температурах » соли оксония» : (H3O)Cl, (H3O)Br, (H3O)2SO4 и некоторые другие. По химическим свойствам растворы этих » солей оксония» ничем не отличаются от растворов соответствующих молекулярных кислот — соляной, бромоводородной, серной и т. д.
Большинство кислотных гидроксидов (оксокислот) — молекулярные вещества. Исключение составляет нерастворимая в воде кремниевая кислота (ее состав только упрощенно отражается формулой H2SiO3) и некоторые другие кислоты.
Растворение кислот в воде — химическое растворение. При растворении кислоты в воде протекает КОР, необратимая в случае сильной кислоты и обратимая в случае слабой:
HNO3 + H2O = H3O + NO3
CH3COOH + H2O 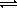
+ CH3COO
Способность кислот отдавать протоны определяет наиболее характерные химические свойства этих веществ:
1) Все кислоты реагируют с веществами, содержащими очень сильные частицы-основания: O 2 , N 3
и т. п. (см. рис. 12.2), то есть прежде всего с основными и амфотерными оксидами (примеры в § 13.4).
2) Все кислоты реагируют с растворами щелочей (примеры в § 13.7).
3) Растворы сильных кислот реагируют с солями и их растворами (содержат анионные основания)
H3O + NO2
= HNO2 + H2O,
H3O + CH3COONa = CH3COOH + Na
+ H2O,
HClр + KNO2р = HNO2р + KClр;
HClp + CH3COONaкр = CH3COOHp + NaClp.
Образующаяся слабая кислота может быть еще и нерастворимой или летучей:
2H3O + SiO3 2
= H2SiO3
+ 2H2O,
2H3O + FeS = Fe 2
+ H2O + H2S
,
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4,
2HBr + FeS = FeBr2 + H2S , что еще более способствует смещению равновесия вправо.
Летучие кислоты выделяются из реакционной смеси и в том случае, когда с безводной солью этой кислоты реагирует нелетучая (точнее, значительно менее летучая) кислота:
H2SO4конц + NaClкр = NaHSO4кр + HCl ,
H3PO4ж + CH3COONaкр = NaH2PO4кр + CH3COOH .
Если образующаяся слабая кислота неустойчива, при реакции выделяется газообразный кислотный оксид. В этом случае растворы сильных кислот реагируют и с нерастворимыми солями:
2H3O + CaCO3 = Ca 2
+ CO2
+ 3H2O,
2HNO3р + CaCO3кр = Ca(NO3)2р + CO2 + H2O.
Реакции между растворами солей и сильных кислот протекают и в тех случаях, когда образуется нерастворимая соль (§ 12.1):
Cl + Ag
= AgCl
,
HCl + AgNO3 = AgCl + HNO3.
4) Растворы сильных кислот реагируют с металлами, стоящими в ряду напряжений левее водорода (примеры в § 13.2).
5) Многие кислоты при нагревании разлагаются (примеры см. в § 2.5). Некоторые кислоты легко разлагаются даже в водных растворах:
H2CO3 = CO2 + H2O (при образовании практически полностью разлагается),
H2SO3 = SO2 + H2O (неустойчива в концентрированных растворах и при нагревании).
Растворимые оксокислоты можно получить при взаимодействии соответствующего кислотного оксида с водой. Слабые кислоты получаются из солей под действием сильных кислот.
Бескислородные кислоты получают, растворяя соответствующие гидриды в воде.

2.Приведите уравнения реакций, характеризующие химические свойства а) серной кислоты, б) кремниевой кислоты, в) соляной кислоты.
3.Осуществите превращения: Cl2 HCl
CaCl2
AgCl.
4.Сколько тонн 96 %-ной серной кислоты можно получить из 3 тонн серы при общем выходе продукта, равном 80 %?

Как амфотерные оксиды по свойствам близки к основным оксидам, так и амфотерные гидроксиды близки по свойствам к основным гидроксидам (основаниям). Отличие амфотерных гидроксидов — только в том, что они способны реагировать со щелочами.
Непосредственно эти реакции протекают только в растворах:
Zn(OH)2 + 2OH = [Zn(OH)4] 2
, Cr(OH)3 + 3OH
= [Cr(OH)6]3
,
Zn(OH)2 + 2NaOHр = Na2[Zn(OH)4]р, Cr(OH)3 + 3KOHр = K3[Cr(OH)6]р.
Конечно, амфотерные гидроксиды реагируют и с расплавами щелочей, но при этих температурах они разлагаются, и со щелочью реагируют уже соответствующие амфотерные оксиды (см. § 13.6).
Так как все амфотерные гидроксиды — нерастворимые вещества, получить их можно осаждением из растворов солей:
Zn 2 + 2OH
= Zn(OH)2
[Zn(OH)4] 2 + 2H3O
= Zn(OH)2
+ 4H2O.

а) Be BeO
Na2BeO2
BeCl2
Be(OH)2
Na2[Be(OH)4]
BeSO4;
б) Al Na[Al(H2O)2(OH)4]
Al(OH)3
Na3[Al(OH)6]
AlCl3
Al(OH)3
Al2O3 .

Как трудно провести границу между веществами с ионными и ковалентными связями, так не менее трудно выделить среди множества соединений те, которые мы называем солями. Тем не менее, все соединения, которые заведомо относятся к солям, представляют собой твердые (обычно кристаллические) вещества. По определению, связь в этих соединениях ионная. При этом не следует забывать, что в сложных катионах и анионах связь между атомами ковалентная.
Химические свойства солей определяются только свойствами ионов, входящих в их состав.
Важнейшие химические свойства средних солей:
1) растворимые соли могут реагировать с металлами (см § 13.2);
2) некоторые соли могут окисляться активными неметаллами:
2KI + Cl2 = 2KCl + I2,
2K2SO3 + O2 = 2K2SO4 (в растворе, медленно);
3) растворимые соли могут реагировать с растворами щелочей (см. § 13.7);
4) соли слабых кислот реагируют с сильными кислотами (см § 13.8);
5) в растворе соли могут реагировать между собой:
Ba 2 + SO4 2
= BaSO4
, Ag
+ Cl
= AgCl
,
BaCl2 + Na2SO4 = BaSO4 + 2NaCl,
AgNO3 + NaCl = AgCl + NaNO3;
6) некоторые соли при нагревании легко разлагаются
2KNO3 = 2KNO2 + O2 , MgCO3 = MgO + CO2
, NH4Cl = NH3
+ HCl
,
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
, NH4NO2 = N2
+ 2H2O
.
Как видно из приведенных примеров, реакции термического разложения разных солей очень сильно отличаются друг от друга, поэтому подробно с некоторыми типами этих реакций вы познакомитесь при изучении химии отдельных элементов.
Особенности химических свойств кислых и основных солей связаны с наличием в их составе ионов-амфолитов и заключаются в возможности реакций с растворами кислот и оснований:
NaHSO4р + NaOHр = Na2SO4р + H2O,
NaHCO3р + HClр = NaClр + CO2 + H2O,
Mg(OH)Cl + NaOHр = Mg(OH)2 + NaClр,
Mg(OH)Cl + HClр = MgCl2р + H2O.
Все кислые и основные соли разлагаются при нагревании. Здесь также много различных типов реакций:
2NaHCO3 = Na2CO3 + H2O + CO2
,
NH4HCO3 = NH3 + H2O
+ CO2
,
2Na2HPO4 = Na4P2O7 + H2O ,
(CuOH)2CO3 = 2CuO + CO2 + H2O
.
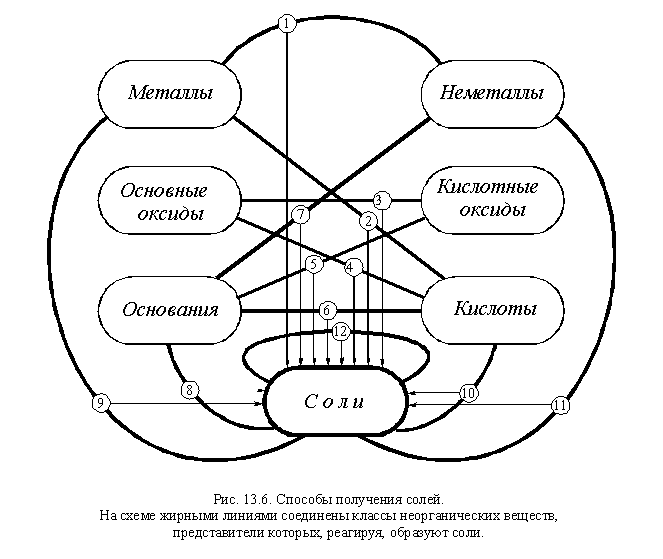
Изучая предыдущие параграфы этой главы, вы убедились в том, что соли образуются при самых разнообразных реакциях. Важнейшие способы получения средних солей в виде схемы представлены на рис. 13.6.
Таким образом, соли можно получить 12 важнейшими способами:
1) при взаимодействии металлов с неметаллами,
2) при взаимодействии металлов с кислотами,
3) при взаимодействии основных оксидов с кислотными оксидами,
4) при взаимодействии основных оксидов с кислотами,
5) при взаимодействии кислотных оксидов с основаниями,
6) при взаимодействии оснований с кислотами,
7) при взаимодействии неметаллов с основаниями,
8) при взаимодействии оснований с солями,
9) при взаимодействии металлов с солями,
10) при взаимодействии кислот с солями,
11) при взаимодействии неметаллов с солями,
12) при взаимодействии солей друг с другом.
Не все эти способы применимы к каждой соли, например: соли бескислородных кислот нельзя получить, используя способы 3 и 5, а соли металлов, стоящих в ряду напряжений правее водорода нельзя получить, используя способ 2. И наоборот, существует множество способов получения отдельных солей, не включенных в этот перечень.

2.Какими из 12 приведенных в тексте параграфа способами нельзя получить хлорид натрия? 
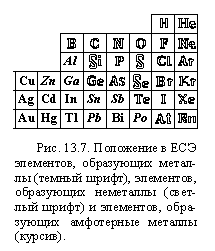
Вы изучили характерные свойства веществ, относящихся к важнейшим классам простых веществ и соединений. Но как определить, к какому классу относится данное конкретное вещество? Очень часто в этом может помочь естественная система элементов. Кроме того, ЕСЭ может помочь проследить усиление или ослабление тех или иных свойств аналогичных соединений разных элементов.
а) Простые вещества
Где в таблице элементов проходит граница между простыми веществами-металлами и неметаллами, вы знаете (§ 2.5, § 7.14). Основываясь на типе химической связи, уточним эту границу. На рисунке 13.7 светлыми символами показаны элементы, в обычных условиях образующие простые вещества с ковалентными связями между атомами — неметаллы. Такими же символами обозначены элементы благородных газов, связи между атомами в которых — межмолекулярные. В простых веществах остальных элементов — связь металлическая.
По способности реагировать со щелочами среди металлов выделяют амфотерные металлы (символы их элементов набраны курсивом)(Кроме отмеченных в таблице слабо выраженные амфотерные свойства проявляют железо, титан и ниобий.Эти вещества могут реагировать со щелочью, но в очень жестких условиях. Некоторые металлы (например, кобальт) реагируют с расплавами щелочей в присутствии кислорода , то есть окисляются кислородом в шелочной среде, но это свойство уже не имеет отношение к амфотерности). Как видно из рисунка, они находятся на границе между металлами и неметаллами.
Важнейшие свойства металлов — восстановительные. При всей неравномерности изменения этих свойств в системе элементов самые сильные металлы-восстановители образованы элементами, расположенными в левом нижнем углу таблицы (их атомы наиболее склонны отдавать электроны).
Важнейшие свойства неметаллов — окислительные. Исключая VIIIА группу, окислительные свойства неметаллов возрастают снизу вверх и слева направо (в соответствии с возрастанием склонности к присоединению электронов их атомами).
Определение характера оксида по положению элемента в ЕСЭ осложнено тем, что элементы, как правило, образуют несколько оксидов (в разных степенях окисления). Например, хром образует следующие устойчивые оксиды:
CrO, оксид хрома(II) — основный оксид;
Cr2O3, оксид хрома(III) — амфотерный оксид;
CrO3, оксид хрома(VI) — кислотный оксид.
Как видите, с увеличением степени окисления характер оксида меняется, переходя от основного к кислотному. Эта закономерность наблюдается и у других элементов.
Состав высших оксидов (за исключением элементов VIIIВ и IB группы) зависит от номера группы:
Химические реакции: типы, свойства, уравнения
Содержание:
Характеристика реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Видео
И в завершение интересно видео про самые удивительные химические реакции.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Похожие посты:
4 комментария
Спасибо за статью, хотелось бы также больше узнать про химические реакции ферментов и необратимые химические реакции.
Пожалуй эти темы заслуживают отдельной статьи.
1. Вы пишете: “Зная константу равновесия можно определить направление протекания химической реакции.” Одного знания константы равновесия бывает недостаточно. В общем случае, необходимо знать еще концентрации веществ.
2. Про тепловой эффект реакции сразу видно, что переписан без пояснений соответствующий абзац из учебника. Может даже не школьного. Но народу будет не до конца понятно.
3. В начале статьи вы заикаетесь о биохимических реациях и далее даже говорите о том, что есть сложные реакции. И далее не слова про них. Интуитивно понятно, что сложные реакции это совокупность нескольких. Но по хорошему надо бы хотя бы обозначить определение. И пару предложений сказать про биохимические реакции
4. Вы пишете: “К факторам скорости химической реакции можно отнести:
природу реагирующих веществ,
наличие катализатора,
температуру,
давление,
площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.” Перфекционисту, такое утверждение будет резать слух. Например, вы ничего не говорите о концентрациях, а также не разделяете гомогенные и гетерогенные реакции-для них немного разный набор влияющих факторов. Некоторые из указанных вами факторов не так сильно влияют на скорость (если влияют вообще).
4. Указывая признаки протекания химической реакции вы выделяете яркие, заметные но не всегда проявляемые факторы, а также не эти признаки являются фундаментальным признаком протекания химической реакции. Таковым является изменение количества(концентрации) реагирующих веществ. И именно эти изменения фиксируют, т.н. кинетические кривые, снимаемые по ходу реакции графики зависимости какого-либо параметра от количества вещества.
5. Если уж вас спросили в комментариях, и вы сами вкратце касаетесь понятия химического равновесия и т.н. константы равновесия можете в дальнейшем указать, что необратимые это те реакции, у которых очень большое значение константы равновесия.
И еще предложение “При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.” Перечитайте! Кто отличает ядерные реакции от химических (условно говоря, 90% школьников) им это предложение ни к чему. А кто захочет разобраться (те самые 10% кто не различает ядерные и химические реакции) они ничего не поймут!
http://www.chem.msu.su/rus/school/zhukov1/13a.html
http://www.poznavayka.org/himiya/himicheskie-reaktsii-tipyi-svoystva-uravneniya/