Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой . Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Оксид натрия
| Оксид натрия | |
|---|---|
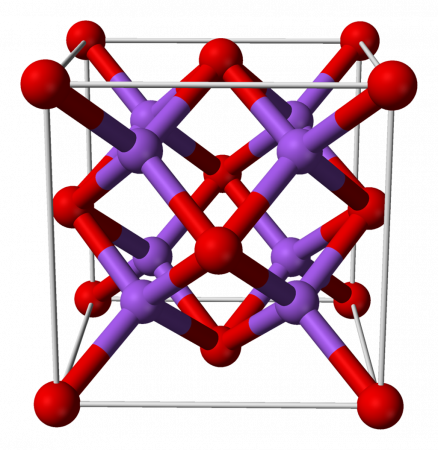 | |
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES | |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
3. Охарактеризуйте важнейшие химические свойства основных оксидов. Составьте уравнения реакций: а) оксида натрия с водой; б) оксида железа(II) с соляной кислотой; в) оксида лития с оксидом фосфора(V). Назовите образующиеся вещества.
Основные оксиды реагируют с водой, в результате чего образуются щелочи; с кислотными оксидами до образования солей; с кислотами до образования воды и соли; с амфотерными оксидами до образования двухосновных солей.
а) Na2O + H2O → 2NaOH (гидроксид натрия)
б) FeO + 2HCl → FeCl2 + H2O (хлорид железа(II) и вода)
в) 3Li2O + P2O5 → 2Li3PO4 (фосфат лития)
http://chem.ru/oksid-natrija.html
http://superresheba.by/unit/63166
