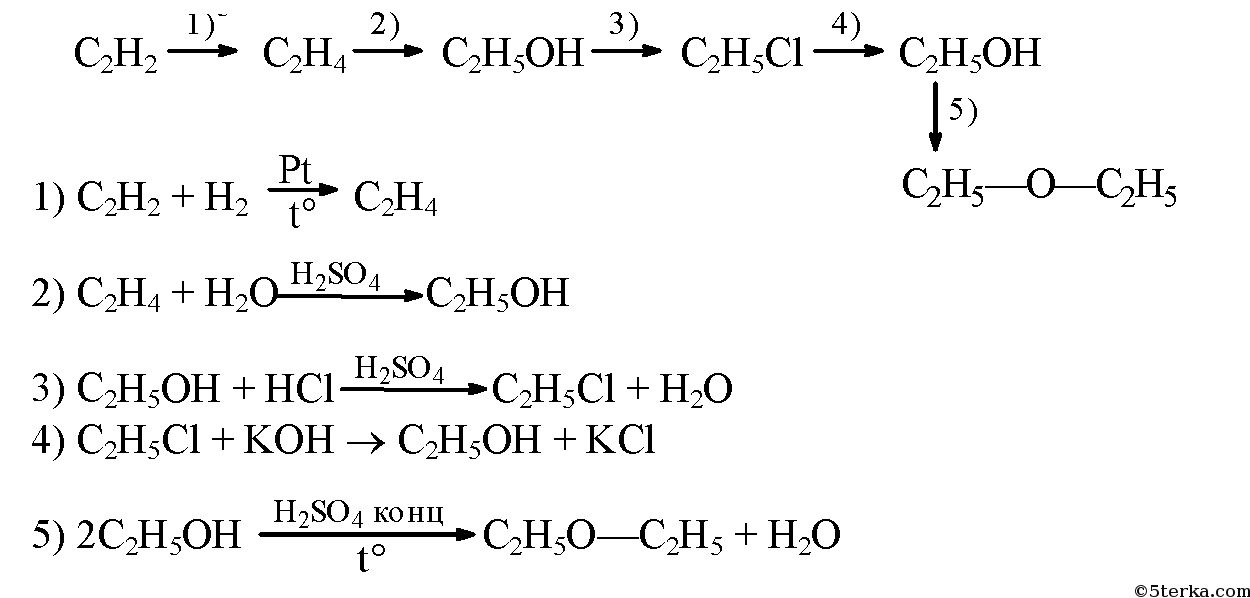
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.

задача №3
к главе «Тема VI. Спирты и фенолы. Работа 1 Предельные одноатомные спирты. Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
«Спирты, альдегиды, кетоны»(10-11 классы)
материал для подготовки к егэ (гиа) по химии (10 класс) на тему
Материал содержит краткое теоретическое введение, примеры решения заданий и задания для самостоятельной работы, которые можно использовать и для контроля знаний в 10 классе, но и для подготовки к ЕГЭ в 11 классе. К задачам приведены ответы.
Скачать:
| Вложение | Размер |
|---|---|
| Краткая теория, примеры решения заданий, задания для самостоятельного решения. | 24.83 КБ |
Предварительный просмотр:
Спирты, альдегиды, кетоны
Спирты – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН.
Химические свойства спиртов определяются гидроксильной группой −ОН. Химические реакции спиртов могут протекать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации.
Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца . Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце (С 6 Н 5 −ОН).
Фенол – твердое кристаллическое вещество с характерным запахом, плохо растворяющееся в воде. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом.
Кислотные свойства. Фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами:
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2 ;
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
Реакции замещения в бензольном кольце . Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о — и п -положения). Например, он легко бромируется бромной водой с образованием 2,4,6- трибромфенола.
Качественная реакция на фенол . Фенол образует с FeCl 3 комплексную соль, окрашенную в фиолетовый цвет.
Под действием окислителей (K 2 Cr 2 O 7 , KMnO 4 ) в присутствии H 2 SO 4 спирты окисляются с образованием альдегидов и кетонов, например:
3С 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → Cr 2 (SO) 3 + K 2 SO 4 + 3СН 3 – СОН + 7Н 2 О
Альдегиды и кетоны содержат в молекуле карбонильную группу С = О
В молекулах альдегидов карбонильная группа соединена с углеводородным радикалом и атомом водорода. Первым членом гомологического ряда аль- дегидов является метаналь НСОН (формальдегид), 40 %-ный водный раствор формальдегида называется формалином.
В молекулах кетонов карбонильная группа соединена с двумя разными R−CO−R ′ или одинаковыми радикалами. Например, Н 3 С-С-СН 3
По своим химическим свойствам альдегиды являются восстановителями , которые легко окисляются в кислоты . Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра («реакция серебряного зеркала») и является качественной на альдегиды:
СН 3 -СН 2 -СОН + 2[Ag(NH 3 ) 2 ]OH → СН 3 -СН 2 -СООН + 2Ag↓ + 4NH 3 + H 2 O.
пропаналь пропановая кислота
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При этом происходит разрыв углеродной цепи и образование смеси продуктов. Кетоны не вступают в реакцию серебряного зеркала.
Примеры решения задач
Пример 1. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С 2 Н 4 → Х → Y → С 2 Н 5 −О−С 2 Н 5 .
Указать условия протекания реакций. Назвать вещества Х и Y.
Решение . Конечный продукт – диэтиловый эфир – получается из этилового спирта, следовательно, вещество Y – этанол. Перейти от этилена к этанолу можно через промежуточное соединение – галогенопроизводное этана (вещество Х).
При взаимодействии этилена с бромоводородом образуется бромэтан:
C 2 H 4 + HBr → C 2 H 5 Br.
Бромэтан гидролизуется до спирта действием водного раствора NaOH:
C 2 H 5 Br + NaOH → C 2 H 5 OH + NaBr.
При нагревании этанола до 140 °С в присутствии серной кислоты в качестве катализатора образуется диэтиловый эфир:
C 2 H 5 OH → С 2 Н 5 −О−С 2 Н 5 + H 2 O. (t ,Н + )
Пример 2. Какая масса пропилата натрия может быть получена при взаимодействии 15 г пропанола-1 с 9,2 г натрия?
Решение . Записываем уравнение реакции между пропанолом-1 и металлическим натрием:
2CH 3 −СH 2 −СН 2 −OH + 2Na → 2CH 3 −СH 2 −СН 2 −ONa + H 2 .
Определяем количества вещества пропанола-1 и натрия:
υ (С 3 Н 7 ОН) = m/ M = 15/60 = 0,25моль;
υ (Na) =m/M=9,2/23 = 0,4 моль (Na)
Из уравнения реакции следует, что число моль спирта и натрия должны быть равны, следовательно, натрий взят в избытке.
На основании уравнения реакции записываем:
υ (C 3 H 7 ONa) = υ(C 3 H 7 OH); υ (C 3 H 7 ONa) = 0,25 моль.
Определяем массу пропилата натрия, которую можно получить:
m (C 3 H 7 ONa) = υ(C 3 H 7 ONa) ∙ M (C 3 H 7 ONa);
m (C 3 H 7 ONa) = 0,25 ∙ 82 = 20,5 г.
Пример 3. Формалин представляет собой 40 %-ный водный раствор формальдегида. Рассчитать массу метанола, которую необходимо окислить для получения 600 г формалина.
Решение . Вычисляем массу формальдегида, который потребуется для приготовления формалина:
m (CH 2 O) = 40*600/100 = 240 г.
Количество вещества требуемого формальдегида равно
υ (CH2O) = 240/30 = 8 моль.
Составляем уравнение реакции окисления метанола:
CH 3 OH + [O] → CH 2 O + H 2 O.
Из уравнения реакции следует, что υ (CH 3 OH) = υ(CH 2 O); υ(CH 2 O) = 8 моль.
Масса требуемого метанола равна
m (CH 3 OH) = υ(CH 3 OH) ∙ M (CH 3 OH);
m (CH 3 OH) = 8 ∙ 32 = 256 г.
Задачи и упражнения для самостоятельного решения
1 . При взаимодействии бутанола-1 с избытком металлического натрия выделился водород, занимающий при нормальных условиях объем2,8 л. Определить количество вещества бутанола-1, которое вступило в реакцию.
( Ответ : 0,25 моль).
2. Назвать вещества Х и Y и написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) пропанол-1 → Х → пропанол-2;
б) этанол → Y → 1,2-дихлорэтан.
Указать условия протекания реакций.
3 . Для получения метанола использовали 2 м3 оксида углерода (II) и 5 м3 водорода при нормальных условиях. Получено 2,04 кг спирта. Определить выход спирта. ( Ответ : 71,4 %).
4 . Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
С → СН 4 → С 2 Н 6 → С 2 Н 4 → С 2 Н 5 ОН → С 2 Н 5 ОNa.
5. Определить массу фенолята натрия, который может быть получен при взаимодействии 4,7 г фенола с 4,97 мл 35 %-го раствора NaОН (ρ = 1,38 г/мл). ( Ответ : 5,8 г).
6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорэтан → этанол → этилен → пропаналь.
7. При окислении 13,8 г этанола избытком оксида меди (II) получен альдегид, масса которого составила 9,24 г. Определить выход продукта реакции. ( Ответ : 70 %).
8. Определить массу серебра, которая будет получена, если к избытку аммиачного раствора оксида серебра прибавить 50 г 11,6 %-го водного раствора пропаналя. ( Ответ : 21,6 г).
9. Какое количество вещества НСНО содержится в его 30 %-м водном растворе объемом 3 л и плотностью 1,06 г/мл? ( Ответ : 31,8 моль).
10. 280 мл ацетилена было использовано для получения ацетальдегида, выход которого составил 80 %. Какая масса серебра может образоваться при добавлении всего полученного альдегида к избытку аммиачного раствора оксида серебра? ( Ответ : 1,08 г).
11. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С → СаС 2 → С 2 Н 2 → С 2 Н 4 → С 2 Н 6 → С 2 Н 5 Cl → С 2 Н 5 ОН.
12. При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра образовалось 20 г металла. Определить массовую долю (%) этаналя в техническом препарате. ( Ответ : 67,9 %). С О OН C O
13. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → ацетилен → уксусный альдегид → этиловый спирт → уксусный альдегид.
14. Составить уравнения реакций, при помощи каких реакций можно осуществить следующие превращения:
С → СН 4 → С 2 Н 2 → С 6 Н 6 → С 6 Н 5 Cl → С 6 Н 5 ОН.
15. Рассчитать массу фенолята калия, которая может быть получена из 3,29 г фенола. ( Ответ : 4,62 г).
16. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
уксусный альдегид → этанол → этилен → ацетилен → уксусный альдегид.
17. Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
а) СН4 → Х → СН3ОН → СН3−О−СН3;
б) этанол → этилен → Y → этанол.
Назвать вещества Х и Y.
18. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2 %. Определить массу пропанола-2, взятого для реакции. ( Ответ : 2,4 г).
19. Рассчитать массу фенола, который можно получить гидролизом бромбензола массой 47,1 г, если массовая доля выхода продукта равна 40 %.
20. Составить уравнения реакций, которые необходимо провести для осуществления следующих превращений: пропин → Х → ацетон.
Назвать вещество Х, указать условия протекания реакций.
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) этилен → этанол → этаналь б) этанол → этилен → этиленгликоль
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,292
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,160
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://nsportal.ru/shkola/khimiya/library/2015/01/23/spirty-aldegidy-ketony10-11-klassy
http://www.soloby.ru/472245/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BE%D1%81%D1%83%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B8%D1%82%D1%8C-%D1%81%D0%BB%D0%B5%D0%B4%D1%83%D1%8E%D1%89%D0%B8%D0%B5-%D0%BF%D1%80%D0%B5%D0%B2%D1%80%D0%B0%D1%89%D0%B5%D0%BD%D0%B8%D1%8F-%D1%8D%D1%82%D0%B8%D0%BB%D0%B5%D0%BD%D0%B3%D0%BB%D0%B8%D0%BA%D0%BE%D0%BB%D1%8C