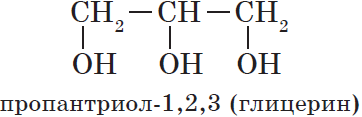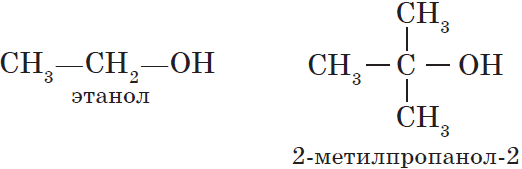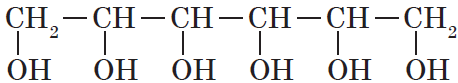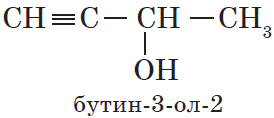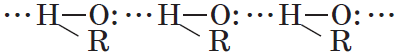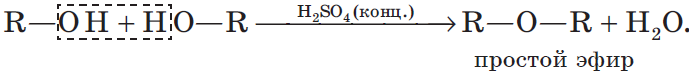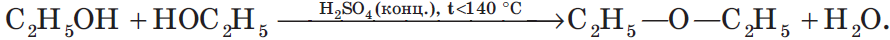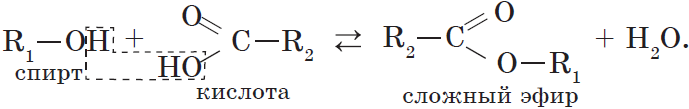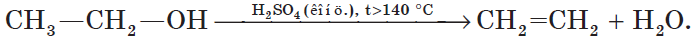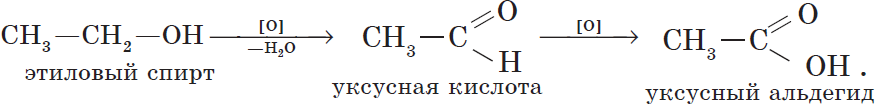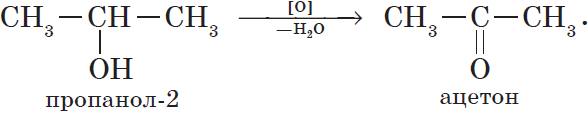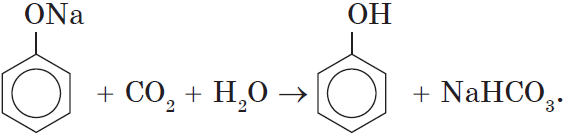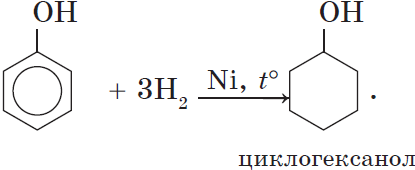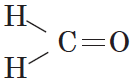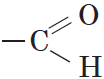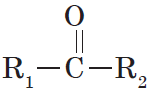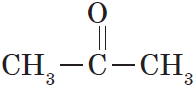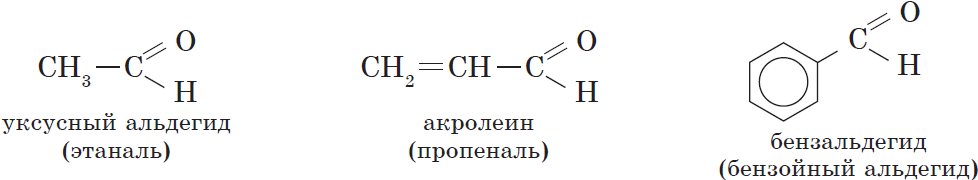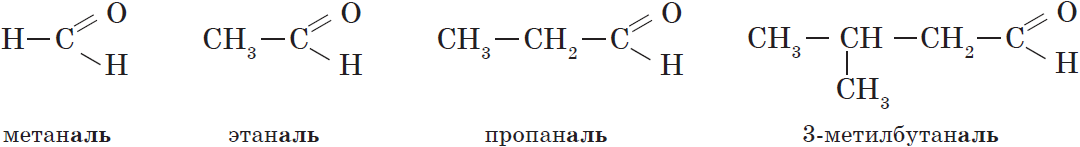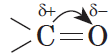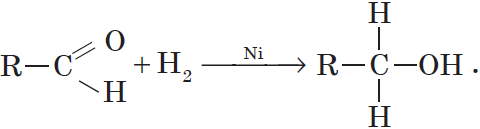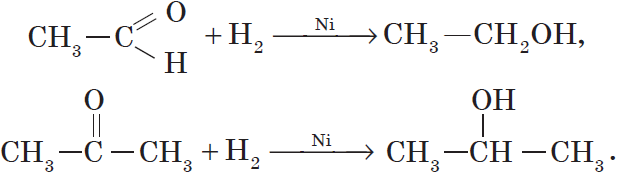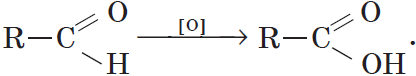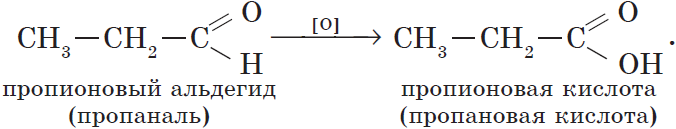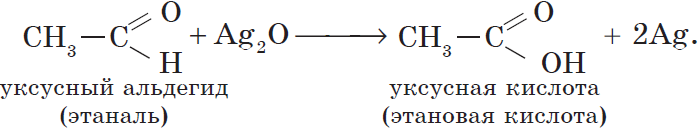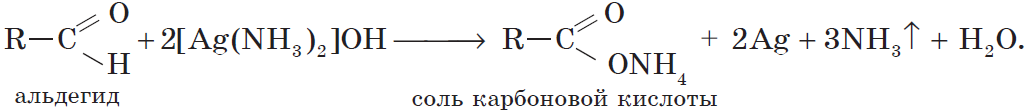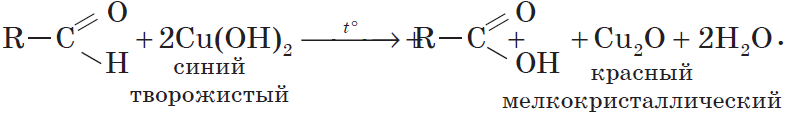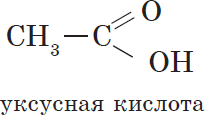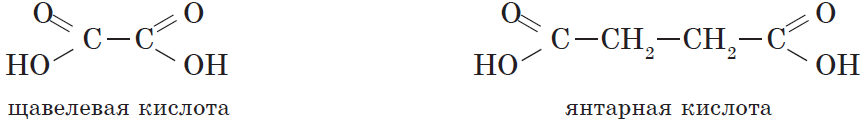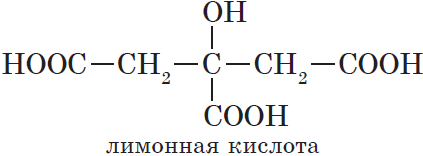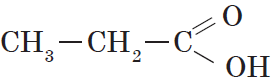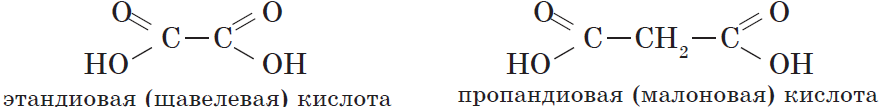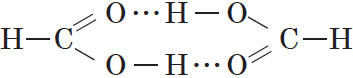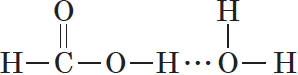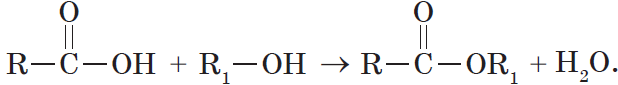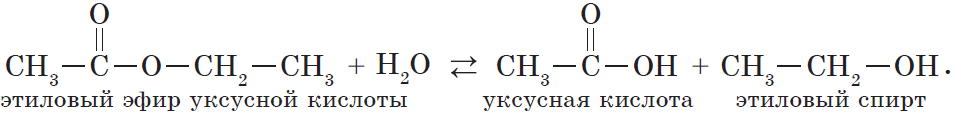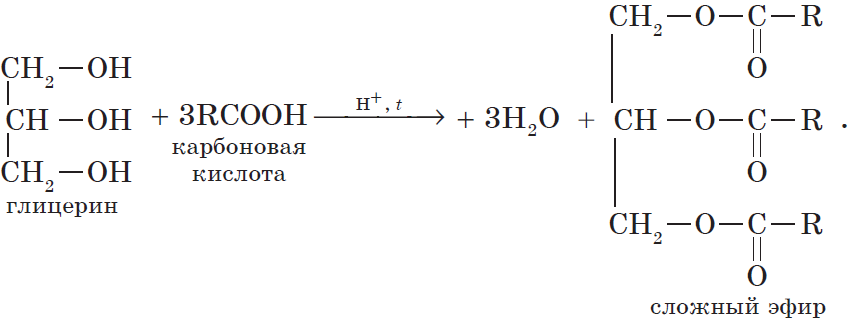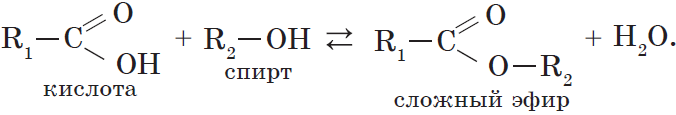Свойства кислородосодержащих соединений. Получение кислородосодержащих соединений
Теория к заданию 14 из ЕГЭ по химии
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
— двухатомные (гликоли), например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
— непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
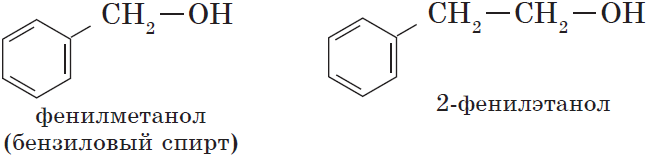
— ароматические, т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
Физические и химические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_<12>Н_<25>ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
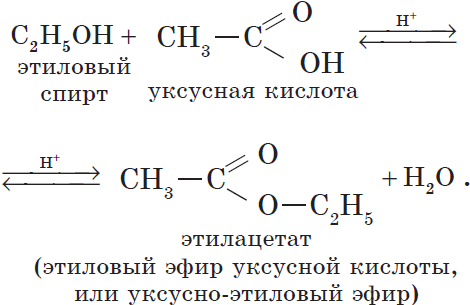
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
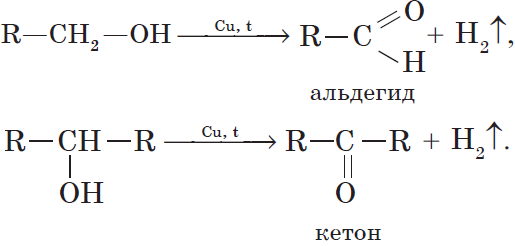
7. Дегидрирование спиртов. При пропускании паров спирта при $200–300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
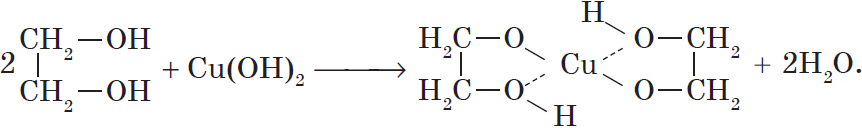
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Фенол
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
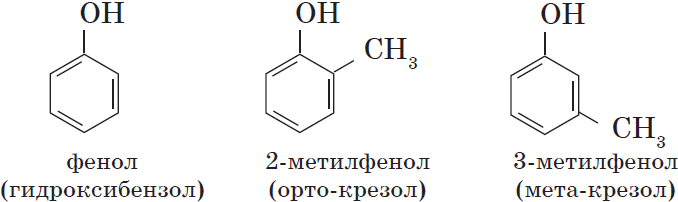
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
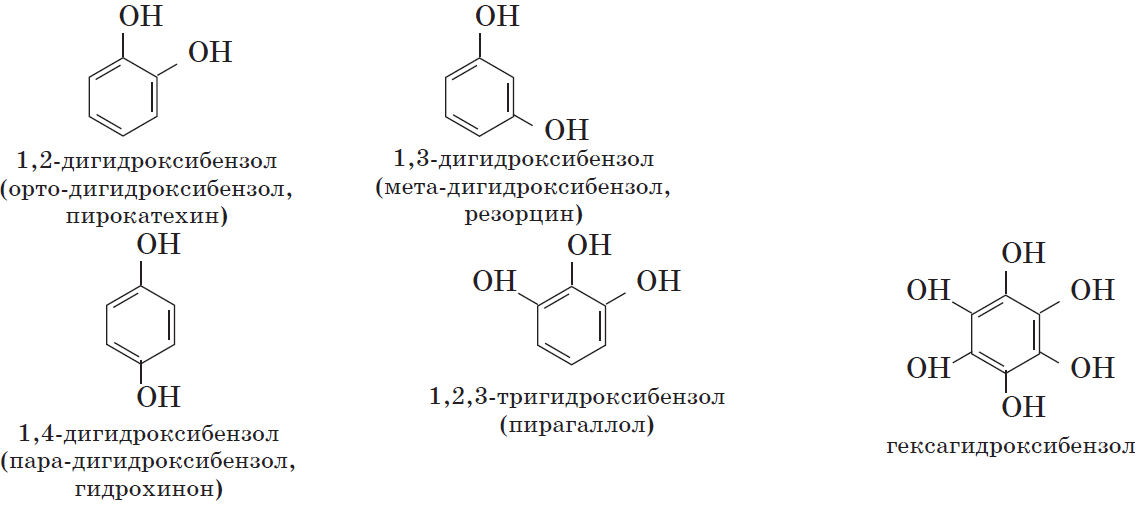
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
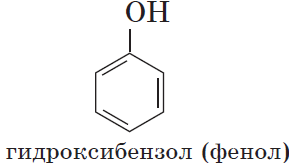
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства
Фенол — твердое, бесцветное, кристаллическое вещество, $t°_<пл.>=43°С, t°_<кип.>=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
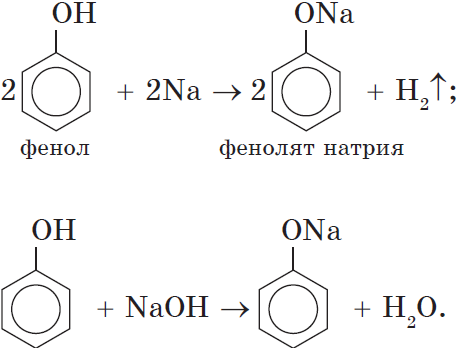
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
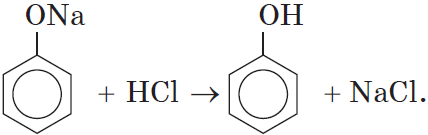
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
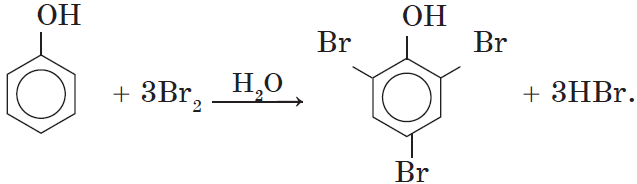
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
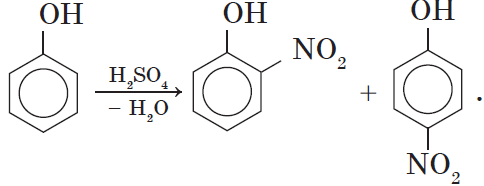
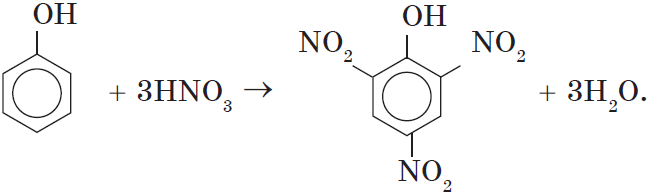
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
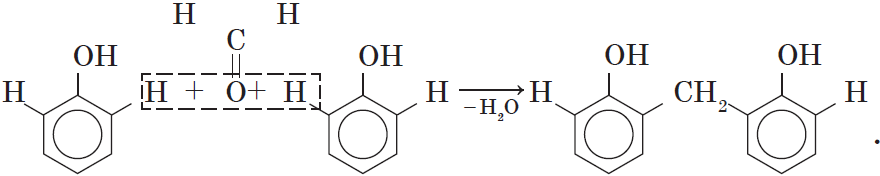
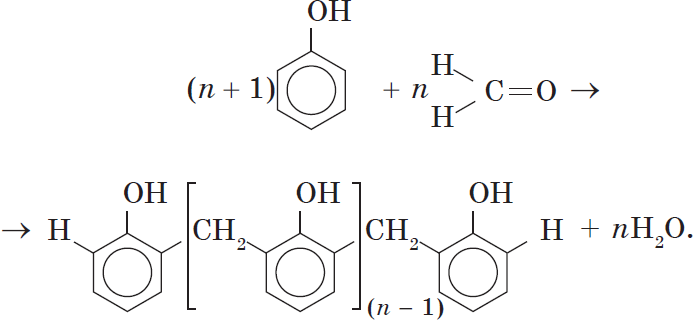
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
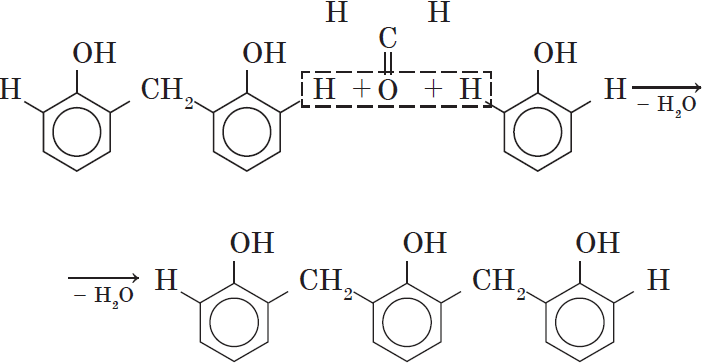
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны
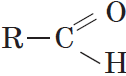
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 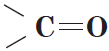
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_<кип.>, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
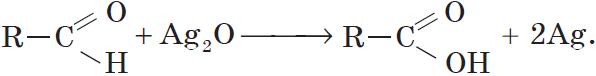
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^<2+>$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Карбоновые кислоты
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 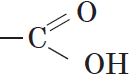
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)_7—СН=СН—(СН_2)_7—СООН$ и других кислот.
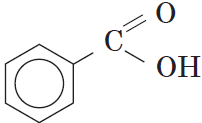
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
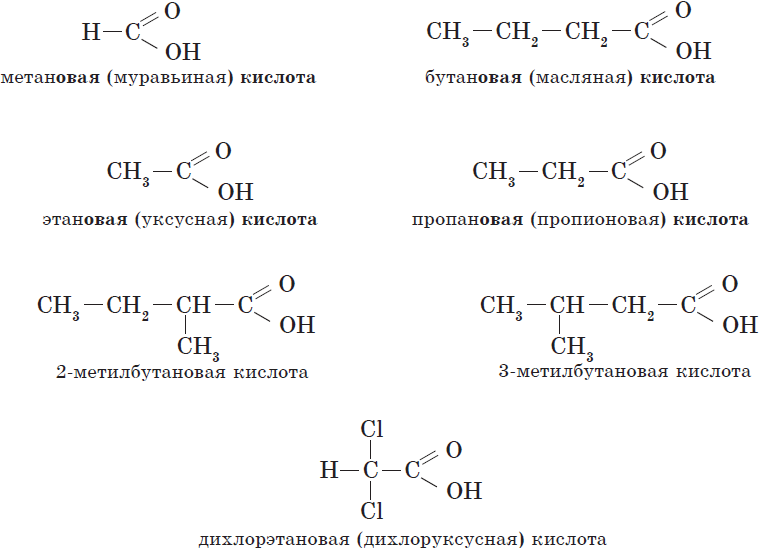
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)_4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)_5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН_<2n>О_2$, или $С_nН_<2n+1>СООН$, или $RCOOH$.
Физические и химические свойства
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H_<10>)=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 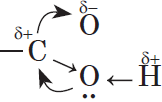
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO)_
Так, железо восстанавливает водород из уксусной кислоты:
3. Взаимодействие с основными оксидами с образованием соли и воды:
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_<15>H_<31>COOH$ и стеариновая $C_<17>H_<35>COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_<17>H_<33>COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
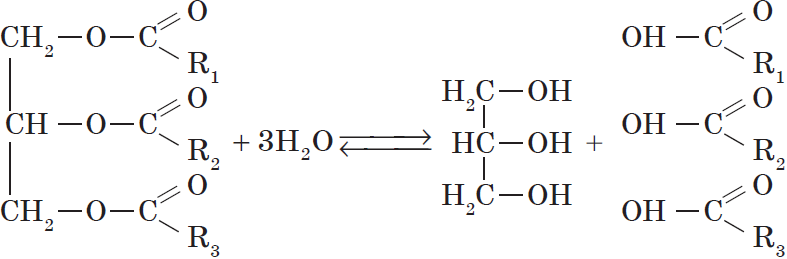
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
Кислородсодержащие органические соединения
Содержание:
Кислородсодержащие органические соединения – соединения, в состав которых входят атомы углерода, водорода и кислорода. Свойства кислородсодержащих органических веществ очень разнообразны, и они определяются тем, в состав какой группы атомов входит атом кислорода.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислородсодержащие органические соединения
Органические вещества, молекулы которых включают, помимо углерода и водорода другие элементы периодической системы называют производными углеводородов. Производные углеводородов, содержащие в своих молекулах кислород, называют кислородсодержащими органическими соединениями.
Предельные спирты
К числу кислородсодержащих органических соединений, состоящих из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, углеводы и др. Их химические свойства определяются наличием в молекулах различных функциональных групп.
Спирты — это органические соединения, в молекулах которых содержится одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
Их можно рассматривать как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы.
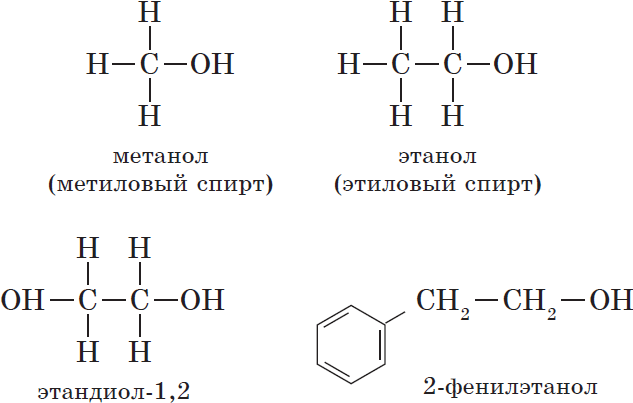
Номенклатура и изомерия спиртов. Названия спиртов производятся от названий радикалов, а также из названий углеводородов прибавлением окончания —ол (международные названия): СН3ОН — метиловый спирт, или метанол, С2Н5ОН — этиловый спирт, или этанол, С3Н7ОН — пропиловый спирт, или пропанол, и т. д. Эти спирты образуют гомологический ряд, так как они по составу молекул отличаются друг от друга на гомологическую разность. Общая формула гомологического ряда СnН2n+1ОН, или R—ОН, где R — углеводородный радикал.
Начиная с третьего представителя гомологического ряда — пропанола, у спиртов появляются изомеры:
В соответствии с международной номенклатурой цифрой после названия спирта обозначают, с каким по счету углеродным атомом связана гидроксильная группа, например:
У спиртов всегда больше изомеров, чем у соответствующих предельных углеводородов. Например, бутан имеет два изомера (нормальный бутан и изобутан, § 15.3), бутиловый спирт— четыре:
Здссь словами «первичный», «вторичный» и «третичный» определяется место гидроксильной группы. Как видим, число изомеров у спиртов зависит от строения радикалов и от положения гидроксильной группы.
Если в молекуле спирта содержится одна гидроксильная группа, то он называется одноатомным, две — двухатомным, три — трехатомным и т. д. Простейшими представителями одноатомных, двухатомных и трехатомных спиртов соответственно являются метанол, этиленгликоль и глицерин:
Свойства спиртов. Низшие спирты — жидкости, высшие с числом углеродных атомов больше 12 — твердые вещества. Все спирты легче воды. Растворимость их в воде уменьшается с ростом молекулярной массы. Метиловый и этиловый спирты смешиваются с водой в любых отношениях.
Молекулы спиртов ассоциированы вследствие возникновения между ними водородных связей (§ 3.6):
Этим объясняется то, что уже первые члены гомологического ряда спиртов — жидкости, которые имеют сравнительно высокие температуры кипения. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде. Уменьшение же растворимости у последующих членов гомологического ряда вызывается увеличением числа атомов углерода в углеводородном радикале. Водородные связи — непрочные (17—22 кДж/моль) и при испарении спиртов легко разрываются.
Химические свойства спиртов обусловлены наличием в их молекулах полярных ковалентных связей С—О и О—Н. Спирты вступают в химические реакции с разрывом одной из этих связей. Так как обе. связи полярны, то их разрыв происходит по ионному (гетеролитическому) механизму с образованием органических анионов или катионов:
Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию — в их присутствия не изменяется окраска лакмуса или фенолфталеина.
Как можно заключить из электронной формулы, например, этилового спирта
электронная пара, связывающая атом кислорода с атомом водорода, смещена к атому кислорода как к более электроотрицательному атому. Этот атом водорода отличается от остальных атомов водорода в молекуле спирта, у него связь с атомом кислорода менее прочная по сравнению со связью между углеродными и водородными атомами. Поэтому водород гидроксильной группы может легко замещаться металлом.
Действительно, спирты энергично взаимодействуют с металлическим натрием или калием с выделением водорода и образованием так называемых алкоголятов:
Алкоголяты — вещества непрочные и водой разлагаются на спирт и щелочь:
Со щелочами одноатомные спирты обратимо взаимодействуют:
При этом равновесие сильно смещено в сторону спирта и щелочи. Однако при определенных условиях (например, при удалении воды) его можно сместить в сторону алкоголята. На этом основано промышленное получение этилата натрия.
Спирты сравнительно легко окисляются такими окислителями, как КМnO4, К2Сr2О7, кислородом воздуха в присутствии катализаторов (платины, меди). При этом сказывается влияние гидроксильной группы, а именно: кислород присоединяется к атому углерода, связанному с группой ОН:
Промежуточным продуктом является спирт с двумя гидроксильными группами при одном атоме углерода. Такие спирты неустойчивы и распадаются на альдегид и воду.
Спирты, как и большинство других органических соединений, горят. Например:
Горение можно представить как предельное окисление. Тогда окисление метилового спирта можно выразить схемой
Спирты взаимодействуют с галогеноводородами:
В этой реакции функциональная группа замещается на бром. Реакция обратима: в присутствии щелочи равновесие смещается в сторону исходных веществ, в избытке кислоты — в сторону конечных веществ.
Важное свойство спиртов — их способность к дегидратации (потере воды). Дегидратация происходит при нагревании спирта (>140°С) с водоотнимающими веществами, например с концентрированной серной кислотой:
В этом случае молекула воды отщепилась от одной молекулы спирта. В других условиях (при избытке спирта и при более низкой температуре) молекула воды отщепляется от двух молекул спирта, в результате чего образуется простой эфир:
Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R’— О—R», где R’ и R» — радикалы, которые могут быть различными или одинаковыми.
Диэтиловый, или серный, эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием.
Из отдельных представителей одноатомных спиртов рассмотрим метанол и этанол, двухатомных—этиленгликоль, трехатомных — глицерин.
Метанол и этанол
Метиловый спирт. Метиловый спирт (другие названия: метанол, карбинол, древесный спирт) — простейший одноатомный спирт, бесцветная жидкость. Сильный яд (прием внутрь вызывает слепоту, при больших дозах — смерть). Современный метод получения — каталитический синтез из оксида углерода (II) и водорода [температура 250°С, давление 7 МПа, катализатор — смесь оксидов цинка и меди (II)]:
Ранее метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). Он применяется как растворитель и для различных органических синтезов — получение формальдегида, некоторых красителей, фотореактивов, фармацевтических препаратов.
Этиловый спирт. Этиловый спирт, или этанол, — бесцветная жидкость. Кипит при 78,3°С, замерзает при 
Этиловый спирт получают брожением сахаристых веществ в присутствии дрожжей. Сущность брожения заключается в том, что получаемая из крахмала глюкоза, или виноградный сахар С6Н12О6, под действием ферментов распадается на спирт и оксид углерода (IV). Суммарный результат этого сложного многостадийного процесса выражается уравнением
Исходным материалом в производстве спирта служат природные продукты, богатые крахмалом: картофель, хлебные злаки и др. В настоящее время этиловый спирт получают не только из пищевых продуктов. Широко развито получение его из отходов древесины: она превращается в глюкозу (см. § 17.18), а последняя — в спирт.
Наиболее современный способ получения этилового спирта основан на реакции гидратации этилена, получаемого в больших количествах при крекинге нефти:
Реакция протекает при температуре 260—300°С, давлении 7,5—10 МПа и в присутствии кислотных катализаторов (фосфорная кислота на алюмосиликате с добавками солей кадмия, меди, кобальта). Заводы по прямой гидратации этилена в спирт имеются как в СССР, так и за рубежом. В будущем будет осуществлен полный переход на производство спирта из непищевого сырья —древесины и газов нефтепереработки.
Этиловый спирт — очень важный для нужд народного хозяйства продукт. В больших количествах он расходуется для получения синтетического каучука и в производстве пластмасс. Этанол используется как растворитель при изготовлении одеколонов, духов, лекарств, лаков, а также для консервирования анатомических препаратов. Он применяется для получения многих органических веществ: диэтилового эфира, красителей, уксусной кислоты, бездымного пороха и др. Этиловый спирт в смеси с бензином может использоваться в качестве горючего для двигателей внутреннего сгорания. Очень часто его денатурируют, т. е. к спирту прибавляют другие вещества и красители, чтобы сделать его непригодным для употребления внутрь.
Этиленгликоль и глицерин
Этиленгликоль. Этиленгликоль— представитель предельных двухатомных спиртов — гликолей. Общая формула ряда гликоле» CnH2n(OH)2. Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» —сладкий).
Этиленгликоль (но заместительной номенклатуре — этандиол-1,2) — сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен. Его структурная формула
Химические свойства этиленгликоля в основном соответствуют свойствам одноатомных спиртов. Только реакции протекают как по одной, так и по двум гидроксильным группам. Так, в реакции со щелочными металлами этиленгликоль образует неполный и полный гликоляты:
В отличие от одноатомных спиртов этиленгликоль легко взаимодействует с гидроксидом меди (II), образуя ярко-синий гликолят меди:
Гликолят меди — сложное (комплексное) соединение (стрелкой показано возникновение химических связей по донорно-акцепторному механизму).
Этиленгликоль реагирует также с едкими щелочами:
Этиленгликоль получают при окислении этилена раствором пер-манганата калия:
Его можно получить также при обработке дигалогенопроизводных углеводородов водным раствором щелочи:
Водные и спиртовые растворы этиленгликоля применяются как не замерзающие при низких температурах растворы, заменяющие воду в радиаторах автомобильных и авиационных моторов в зимних условиях, — антифризы. Во многих случаях он может служить заменителем глицерина. В последнее время применяется также для получения лавсана — ценного синтетического волокна.
Глицерин. Глицерин — простейший представитель трехатомных предельных спиртов —глицеринов. Это бесцветная, вязкая, гигроскопичная жидкость, сладкая на вкус. Смешивается с водой в любых отношениях. Хорошо растворяет многие вещества.
По химическим свойствам глицерин (по заместительной номенклатуре пропантриол-1,2,3) очень близок к этилен гликолю. Так, с гидроксидом меди (II) глицерин образует ярко-синий глицерат меди:
Это качественная реакция на многоатомные спирты — этиленгликоль, глицерин и их гомологи.
Большое значение имеет реакция взаимодействия глицерина с азотной кислотой с образованием нитроглицерина:
Нитроглицерин — тяжелая маслянистая жидкость, взрывчатое вещество (взрывается от легкого сотрясения и нагревания). Однако спиртовые растворы его не взрываются.
С карбоновыми кислотами глицерин образует сложные эфиры — жиры и масла (§ 17.14).
Получают глицерин из жиров, а также синтетическим путем — из газов крекинга нефти (пропилена), т. е. из непищевого сырья. В последнем случае его промышленное производство можно представить схемой
Глицерин применяется для производства нитроглицерина (взрывчатое вещество), приготовления антифризов, в косметике (смягчает кожу), в кожевенной промышленности. Однопроцентный спиртовой раствор нитроглицерина используется как лекарство при сердечных заболеваниях (расширяет кровеносные сосуды).
Фенолы
Фенолы — это органические соединения, в молекулах которых гидроксильные группы связаны с бензольным ядром.
Они являются производными ароматических углеводородов, например:
Фенолы с одной гидроксильной группой называются одноатомными, с двумя —двухатомными, с тремя —трехатомными. При построении номенклатуры фенолов принято обозначать атомы углерода в бензольном кольце цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой, например:
Простейший фенол С6Н5ОН называется фенолом или карболовой кислотой. Фенол—бесцветное кристаллическое вещество с резким характерным запахом. При хранении он постепенно окисляется кислородом воздуха, приобретая розовую окраску. Фенол плавится при 42,3°С, кипит при 182°С; частично растворим в воде (6 г в 100 г воды); обладает сильными антисептическими свойствами, т. е. способностью убивать многие микроорганизмы, весьма ядовит. При действии на кожу обжигает ее, образуя волдыри и язвы.
По химическим свойствам фенолы отличаются от спиртов. Это отличие вызвано взаимным влиянием в молекуле фенола гидроксильной группы и бензольного ядра, называемого фенилом (C8Н5—). Сущность этого влияния сводится к тому, что 
Таким образом, под действием фенила связь атома водорода с кислородом в гидроксильной группе ослабевает, что приводит к частичному отщеплению ионов водорода. Фенол проявляет свойства слабой кислоты (слабее угольной). Поэтому он легко взаимодействует не только с металлическими натрием и калием, но и с едкими щелочами, образуя феноляты, устойчивые в водных растворах:
Поскольку кислотные свойства фенола выражены очень слабо, то феноляты (соли фенола) легко разлагаются минеральными кислотами, в том числе и угольной:
Влияние атомов в молекуле взаимно. Гидроксильная группа в свою очередь оказывает влияние на бензольное кольцо, в результате чего водородные атомы бензола становятся более подвижными и легко замещаются на другие атомы или радикалы. Так, например, фенол без нагревания и без катализаторов энергично взаимодействует с бромом и азотной кислотой, образуя трехзамещенные производные (в положениях 2, 4 и 6):
Бензол же с бромом и азотной кислотой взаимодействует лишь при нагревании и в присутствии катализаторов.
Под влиянием гидроксильной группы облегчается взаимодействие фенола с формальдегидом (см. § 17.8).
В больших количествах фенол получается двумя способами: из каменноугольной смолы, образующейся при сухой перегонке угля, и — основная масса — синтетическим путем из бензола и пропилена («кумольный способ»).
Сначала из бензола и пропилена получают изопропилбензол (кумол):
Кумол — бесцветная жидкость, легче воды, т. кип. 152°С. Затем кумол подвергается жидкофазному каталитическому окислению кислородом воздуха:
Образующееся соединение (гидропероксид кумола) под действием серной кислоты расщепляется на фенол и ацетон:
Таким образом, из бензола и пропилена получают два ценных продукта — фенол и ацетон. Этот метод разработай советским химиком П. Г. Сергеевым. Кумол служит также исходным веществом для получения 
Фенол как сильный антисептик применяется в качестве дезинфицирующего вещества. Особенно много его расходуется для производства пластических масс — фенопластов. Фенол применяется для производства лекарственных веществ, фотографических проявителей и красителей.
Альдегиды
Альдегидами называются органические соединения, в молекулах которых содержится функциональная группа
Их можно рассматривать как продукты окисления спиртов. Так, например, простейший альдегид получается окислением метилового спирта оксидом меди (II):
В этой реакции молекула оксида меди (II) отнимает два атома водорода от молекулы спирта.
Названия альдегидов производятся от названий тех кислот, в которые они превращаются при окислении. Их также можно давать и в зависимости от числа атомов в углеродной цепи (по названию углеводорода) с добавлением суффикса —аль. Например:
Общая формула гомологического ряда предельных альдегидов 
Изомерия альдегидов зависит только от изомерии радикалов, соединенных с альдегидной группой. Например, формулу C4H8O могут иметь два альдегида:
Группа атомов 
Химические свойства альдегидов объясняются их электронным строением, которое можно выразить формулами:
В молекуле альдегида связь между атомами углерода и кислорода осуществляется двумя парами электронов. Электронное облако связи смещено к кислороду как более электроотрицательному атому, в результате чего он приобретает частичный отрицательный заряд 

Таким образом, группа 

Свойства альдегидов рассматриваются на примере их первых двух гомологов: формальдегида и ацетальдегида.
Формальдегид
Строение молекулы и свойства. Формальдегид — бесцветный газ с резким удушливым запахом, ядовит. Он хорошо растворим в воде. Водный 40%-ный раствор формальдегида называется формалином.
По химическим свойствам формальдегид — весьма реакционно-способное вещество. Для него характерны реакции окисления и присоединения (в том числе и поликонденсации).
Реакции окисления протекают очень легко — альдегиды способны отнимать кислород от многих соединений. Так, при нагревании формальдегида с аммиачным раствором оксида серебра Ag2O (в воде оксид серебра нерастворим) происходит окисление формальдегида в муравьиную кислоту НСООН и восстановление серебра:
Серебро выделяется в виде тонкого налета на стенках сосуда, образуя зеркальный налет, — так называемая реакция серебряного зеркала. Образование «серебряного зеркала» служит качественной реакцией на альдегидную группу.
Альдегиды восстанавливают гидроксид меди (II) до гидроксида меди (I), который затем превращается в оранжевый оксид меди (I). Реакция протекает при нагревании:
Эта реакция также может быть использована для обнаружения альдегидов.
Реакции присоединения протекают за счет разрыва двойной связи карбонильной группы альдегида. Присоединение водорода, которое происходит при пропускании смеси формальдегида и водорода над нагретым катализатором — порошком никеля, приводит к восстановлению альдегида в спирт:
Формальдегид присоединяет также аммиак, гидросульфит натрия и другие соединения. При этом к кислороду карбонильной группы всегда присоединяется атом водорода, а остальная часть молекулы присоединяется к атому углерода.
Присоединение гидросульфитов можно выразить уравнением
Эта реакция служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде.
Присоединение синильной кислоты к альдегидам можно изобразить уравнением
Полимеризация формальдегида протекает с образованием макромолекул линейной структуры:
Изделия из полиформальдегида служат заменителями металлических деталей.
О реакции поликонденсации см. § 17.8.
Получение. В промышленности формальдегид получают из метанола, пропуская пары спирта вместе с воздухом над нагретым до 300°С медным катализатором:
Важным промышленным способом является также окисление метана воздухом при 400—600°С в присутствии небольшого количества оксидов азота в качестве катализатора:
Применение. Формальдегид в больших количествах применяется для производства фенолоформальдегидных смол (см. § 17.8). Он служит исходным веществом для производства красителей, синтетического каучука, лекарственных веществ, взрывчатых веществ и др.
Действуя на белок, формалин делает его плотным, нерастворимым в воде и, главное, предохраняет от гниения. Поэтому его применяют для выделки кож, а также для консервирования анатомических препаратов. Формалин употребляется в сельском хозяйстве для протравливания семян с целью уничтожения личинок вредителей. Он применяется также для дезинфекции помещений, хирургических инструментов.
Ацетальдегид
Ацетальдегид, или уксусный альдегид, или этаналь, — бесцветная жидкость с резким запахом, хорошо растворим в воде. Т. кип. 21°С.
По химическим свойствам ацетальдегид аналогичен формальдегиду: для него также характерны реакции окисления и присоединения. Реакции образования «серебряного зеркала» и оксида меди (I) можно выразить уравнениями:
Присоединение водорода к ацетальдегиду протекает в тех же условиях, что и к формальдегиду:
При действии кислот или при длительном стоянии ацетальдегид легко полимеризуется, переходя в тример — паральдегид:
Паральдегид — жидкость, застывает в кристаллическую массу при 12°С, а при нагревании в присутствии разбавленных минеральных кислот переходит в ацетальдегид. Паральдегид обладает сильным снотворным действием.
В промышленности ацетальдегид получают из ацетилена по реакции Кучерова (§ 16.8). Освоен также метод прямого окисления этилена в уксусный альдегид: реакция протекает в присутствии катализатора — смеси PdCl2 и Cu2Cl2, при давлении 1 МПа и температуре 100 С:
Уксусный альдегид применяется главным образом для получения уксусной кислоты, а также при некоторых органических синтезах.
Высшие альдегиды, содержащие в молекуле от 7 до 16 атомов углерода, широко применяются в парфюмерии, так как обладают приятным запахом.
Реакции поликонденсации
Поликонденсация — это процесс образования высокомолекулярных соединений и) низкомолекулярных, сопровождающийся выделением побочного вещества (воды, аммиака, хлороводорода и др.).
Как известно, при полимеризации в отличие от поликонденсации выделения побочных веществ не происходит. Продукты поликонденсации (исключая побочные вещества) так же, как и продукты полимеризации, называются полимерами.
При реакциях поликонденсации цепь растет постепенно: сначала взаимодействуют между собой исходные мономеры, затем образовавшееся соединение поочередно реагирует с молекулами тех же мономеров, образуя в итоге полимерное соединение. Примером реакции поликонденсации может служить образование фенолоформальдегидных смол, употребляемых для изготовления пластических масс. Реакция протекает при нагревании в присутствии катализатора (кислоты или щелочи).
Поскольку в молекуле фенола атомы водорода подвижны (особенно в положениях 2, 4 и 6), а карбонильная группа альдегида 
Образовавшееся соединение взаимодействует далее с фенолом с выделением молекулы воды:
Новое соединение взаимодействует с формальдегидом:
Это соединение конденсируется с фенолом, затем снова с формальдегидом и т. д.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготовляются большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
Кетоны
Кетонами называются органические соединения, молекулы которых содержат карбонильную группу 
Их можно рассматривать как производные углеводородов, в которых два атома водорода у вторичного атома углерода замещены на атом кислорода. Например:
Общая формула кетонов: 
Названия кетонов производятся от названий радикалов, входящих в их молекулу, с прибавлением слова кетон или от названий соответствующих углеводородов с’прибавлением суффикса —он. Например:


Свойства кетонов рассматриваются на примере их первого гомолога — ацетона.
Ацетон. Ацетон (диметилкетон, пропанон) — бесцветная горючая жидкость с характерным запахом. Т. кип. 56,2°С. Хорошо растворим в воде, спирте и эфире. Наиболее широко используемый органический растворитель, хорошо растворяет жиры, смолы и многие другие органические вещества.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
При тех же условиях, что и формальдегид, ацетон присоединяет водород:
И в этом случае водород присоединяется вследствие разрыва двойной связи карбонильной группы. Ацетон присоединяет также гидросульфит натрия и синильную кислоту.
Как растворитель ацетон применяется во многих отраслях промышленности (производство искусственного шелка, бездымного пороха, кинопленки, лаков, лекарств и др.). Он служит исходным веществом для синтеза многих органических соединении.
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, «кумольным» способом (§ 17.4), окислением изопропилового спирта, гидратацией ацетилена водяным паром. В последнем способе реакция протекает при 400—460°С над катализатором, содержащим оксиды железа и марганца:
Из перечисленных последние два способа наиболее экономически выгодны.
Карбоновые кислоты
Карбоновыми кислотами называются органические соединения, в молекулах которых содержится функциональная карбоксильная группа (карбоксил)
Название карбоксил произошло от слов карбонил и гидроксил.
Если в молекуле содержится одна карбоксильная группа, то кислота называется одноосновной, две — двухосновной и т. д.
Приведем примеры представителей гомологического ряда предельных одноосновных карбоновых кислот и их тривиальные названия:
Как видно из примеров, карбоновые кислоты можно рассматривать как производные углеводородов, в которых атомы водорода замещены на карбоксильные группы. Общая формула гомологического ряда СnН2n+1СООН или R—СООН (у первого гомолога вместо R — атом водорода).
По заместительной номенклатуре названия кислот производят от названий соответствующих углеводородов с прибавлением окончания —овая и слова кислота. Например:
Изомерия кислот зависит от строения радикала. Изомеры появляются, начиная с масляной кислоты С3Н7СООН:
Свойства карбоновых кислот. Многие свойства карбоновых кислот обусловлены наличием в их молекулах карбоксильных групп. Электронное строение карбоновых кислот можно представить схемой
Атом кислорода, связанный с углеродом двойной связью, оттягивает электроны в свою сторону. Углерод приобретает некоторый положительный заряд и притягивает электроны второго атома кислорода из группы —ОН, что приводит к сдвигу электронного облака связи О—Н в направлении кислорода. Взаимное влияние атомов в карбоксильной группе можно изобразить схемой
В результате взаимного влияния атомов в карбоксильной группе связь С=O более прочная, чем в карбонильной группе, а связь О—Н менее прочная, чем в спиртах.
Карбоновые кислоты обладают высокими температурами кипения, что связано с образованием водородных связей между молекулами, например:
В водных растворах карбоновые кислоты диссоциируют на ионы подобно минеральным кислотам с образованием ионов гидроксония:
Все карбоновые кислоты — слабые электролиты (НСООН — средней силы). Карбоновые кислоты проявляют все свойства минеральных кислот (см. § 6.2).
У карбоновых кислот под влиянием карбоксильной группы увеличивается подвижность атомов водорода, стоящих при атоме углерода, соседнем с карбоксильной группой. Поэтому они могут быть легко замещены на атомы хлора или брома:
Очевидно, радикалы, содержащие хлор или бром, должны влиять на кислотность карбоксильной группы. И действительно, степень диссоциации хлоруксусной кислоты примерно в 10 раз больше, чем уксусной, а трихлоруксусная кислота по силе близка к соляной или серной. В этом случае ослабление связи водорода в гидроксильной группе можно изобразить схемой
Характерным свойством карбоновых кислот является взаимодействие их со спиртами с образованием сложных эфиров (см. § 17.13).
Важное значение имеют кислоты: пальмитиновая C17H31COOH и стеариновая C17H35COOH —твердые вещества, а также жидкая непредельная олеиновая кислота C17H33COOH. Остатки этих одноосновных кислот входят в состав жиров и масел (см. § 17.14).
Общим способом получения карбоновых кислот является окисле-пне первичных спиртов и альдегидов.
Более детально рассмотрены свойства кислот на примере муравьиной и уксусной.
Муравьиная кислота
Муравьиная кислота НСООН —бесцветная жидкость с резким запахом, кипит при 101°С. Растворяется в воде в любых количествах. Вызывает ожоги на коже. Содержится в выделениях желез муравьев, а также в некоторых растениях (например, в листьях крапивы).
Химические свойства. По химическим свойствам муравьиная кислота наиболее реакционноспособная из всех карбоновых кислот. Это объясняется тем, что ее карбоксильная группа связана с водородом, а не с углеводородным радикалом. Благодаря присутствию в молекуле альдегидной группы муравьиная кислота обладает свойствами альдегида
т. е. проявляет восстановительные свойства (дает реакцию «серебряного зеркала»):
При нагревании она разлагается на оксид углерода (II) и воду:
Получение. Раньше муравьиную кислоту получали, вымачивая муравьев в воде с последующей перегонкой раствора. В настоящее время ее получают из оксида углерода (II) и гидроксида натрия:
Из образующейся соли действием серной кислоты вытесняют, а потом отгоняют муравьиную кислоту:
Ввиду легкой окисляемости муравьиной кислоты общие способы получения кислот для нее мало применимы.
Применение. Муравьиная кислота широко применяется в химической промышленности в качестве восстановителя при синтезе органических веществ, а также для получения щавелевой кислоты; в пищевой промышленности — в качестве дезинфицирующего и консервирующего средства; в текстильной промышленности — при крашении тканей; в медицине — как средство для растирания при ревматизме.
Уксусная кислота
Уксусная кислота при обычной температуре — бесцветная жидкость с резким характерным запахом. При температуре ниже +16,6°С она затвердевает в виде кристаллов, похожих на лед, вследствие чего получила название ледяной уксусной кислоты. Уксусная кислота растворяется в воде в любых количествах. 3—9%-ный водный раствор ее известен под названием уксуса, который применяется как приправа к пище. 70—80%-ная уксусная кислота называется уксусной эссенцией.
Химические свойства. По химическим свойствам уксусная кислота подобна минеральным кислотам. В водных растворах она диссоциирует на ионы:
Кислотный остаток СН3СОО — называется ацетат-ионом. Поскольку уксусная кислота относится к слабым электролитам, то ионов водорода и ацетат-ионов образуется мало.
Как и минеральные кислоты, уксусная кислота взаимодействует с основаниями, основными оксидами и солями, что используется для получения ее солей — ацетатов.
Получение. Современный синтетический способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получается из ацетилена но реакции М. Г. Кучерова (ацетилен получается из очень доступного сырья — метана):
Большое значение приобретает новый способ получения уксусной кислоты, основанный на окислении бутана:
В то время как процесс получения уксусной кислоты из метана является многостадийным (метан -> ацетилен -> уксусный альдегид -> уксусная кислота), ее получение окислением бутана сокращает число стадий, что дает большой экономический эффект.
Применение. Применение уксусной кислоты весьма разнообразно. В химической промышленности она используется для получения пластических масс, различных красителей, лекарственных веществ, искусственного волокна (ацетатного шелка), невоспламеняющейся кинопленки и т. д. В качестве протравы для крашения тканей применяются соли уксусной кислоты — алюминиевые, хромовые и железные. Соли уксусной кислоты используются также для борьбы с вредителями сельского хозяйства. Уксусная кислота применяется как приправа к пище, а также для консервирования овощей.
Сложные эфиры. Реакции этерификации и омыления
Получение сложных эфиров. При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры. Например, из уксусной кислоты и этилового спирта в присутствии катализатора (концентрированной серной или соляной кислоты) получают сложный эфир — этилацетат:
Общая формула сложных эфиров 
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации ( «этер» — эфир).
Реакции этерификации характерны не только для карбоновых, но и для минеральных кислот. Например, при взаимодействии этилового спирта с серной кислотой образуется сложный эфир — диэтилсульфат:
Из азотной кислоты и спирта образуется этилнитрат:
Номенклатура. Чаще всего названия сложных эфиров производят от названий кислот и спиртов, остатки которых входят в их состав, с добавлением слова эфир; их также образуют по типу названий солей. Например:
Свойства. Многие сложные эфиры карбоновых кислот — жидкости, мало растворимые в воде, но хорошо растворимые в спирте. Особое строение молекул сложных эфиров (у них нет, например, гидроксильных групп) приводит к отсутствию водородных связей, а значит, и к отсутствию ассоциированных молекул, характерных для спиртов и кислот. Поэтому сложные эфиры кипят при более низких температурах, чем соответствующие им кислоты.
Многие сложные эфиры обладают приятным фруктовым запахом. Так, муравьиноамиловый эфир обладает запахом вишни, муравьиноэтиловый — рома, уксусноамиловый — бананов, масляноэтиловый — абрикосов, маслянобутиловый — ананасов, изовалерианоэтиловый — запахом яблок.
Сложный эфир, взаимодействуя с водой, снова превращается в кислоту и спирт. Например:
Реакция взаимодействия сложного эфира с водой, приводящая к образованию спирта и кислоты, называется омылением или гидролизом. Она обратна реакции этерификации.
Очевидно, процесс этерификации обратимый:
и при наступлении химического равновесия в реагирующей смеси будут находиться как исходные, так и конечные вещества. Катализатор — ионы водорода (минеральные кислоты) — одинаково ускоряет прямую и обратную реакции (этерификации и гидролиза), т. е. ускоряет достижение равновесия. Чтобы сместить его в сторону образования эфира, исходные кислоту или спирт следует брать в избытке. Тот же результат будет достигнут, если удалять один из продуктов реакции из сферы взаимодействия: отгонять эфир или связывать воду водоотнимающими веществами. Ионы ОН — усиливают гидролиз сложных эфиров: равновесие смещается в сторону кислоты и спирта, и реакция становится практически необратимой, так как получающаяся карбоновая кислота с щелочью образует соль:
Взаимодействие сложных эфиров с водой — их важнейшее химическое свойство (простые эфиры гидролизу не подвергаются).
Применение. Многие сложные эфиры находят применение как хорошие растворители органических веществ. Их широко применяют для приготовления фруктовых эссенций. Некоторые сложные эфиры используются в медицине: изоамилнитрит ослабляет приступы при стенокардии, этилнитрит расширяет периферические кровеносные сосуда.
Жиры
Жиры являются сложными эфирами, образованными высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом — глицерином. Общее название таких соединений — триглицериды.
Природные жиры представляют собой не индивидуальное вещество, а смесь различных триглицеридов.
Образование одного из триглицеридов, например триглицерида стеариновой кислоты, можно изобразить уравнением
В состав молекул триглицеридов могут входить разнородные кислотные радикалы, что особенно характерно для природных жиров, однако остаток глицерина является составной частью всех жиров:
Все жиры легче вода и в ней нерастворимы. Они хорошо растворяются в бензине, эфире, тетрахлориде углерода, сероуглероде, дихлорэтане и других растворителях. Хорошо впитываются бумагой и кожей. Жиры содержатся во всех растениях и животных. Жидкие жиры обычно называются маслами. Твердые жиры (говяжий, бараний и др.) состоят главным образом из триглицеридов предельных (твердых) кислот, жидкие (подсолнечное масло и др.) — из триглицеридов непредельных (жидких) кислот.
Жидкие жиры превращаются в твердые путем реакции гидрогенизации. Водород присоединяется по месту разрыва двойной связи в углеводородных радикалах молекул жиров:
Реакция протекает при нагревании под давлением и в присутствии катализатора — мелко раздробленного никеля. Продукт гидрогенизации — твердый жир (искусственное сало), называется саломасом, идет на производства мыла, стеарина и глицерина. Маргарин — пищевой жир, состоит из смеси гидрогенизованных масел (подсолнечного, хлопкового и др.), животных жиров, молока и некоторых других веществ (соли, сахара, витаминов и др.).
Важное химическое свойство жиров, как и всех сложных эфиров,— способность подвергаться гидролизу (омылению). Гидролиз легко протекает при нагревании в присутствии катализаторов — кислот, щелочей, оксидов магния, кальция, цинка:
Реакция гидролиза жиров обратима. Однако при участии щелочей она доходит практически до конца — щелочи превращают образующиеся кислоты в соли и тем самым устраняют возможность взаимодействия кислот с глицерином (обратную реакцию).
Жиры — необходимая составная часть пищи. Они широко используются в промышленности (получение глицерина, жирных кислот, мыла).
Мыла и другие моющие средства
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
Отсюда реакция, обратная этерификации, получила название реакции омыления.
Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большой молекулярной массой.
Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21 атомов углерода,— хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде (см. § 13.9). Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов —солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле or 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья — растительных масел и жиров.
Углеводы
Углеводы — органические соединения, состав которых обычно выражается общей формулой
Известны также соединения, относящиеся к углеводам, состав которых не соответствует общей формуле, например сахар рамноза C6H12O5.
Углеводы являются очень распространенными природными соединениями, входят в состав растений и живых организмов. В растениях они образуются в результате фотосинтеза:
Содержание углеводов в растениях составляет до 80% массы сухого вещества, в организмах человека и животных — до 20%. Они играют важную роль в физиологических процессах. Пища человека состоит примерно на 70% из углеводов.
Углеводы обычно подразделяют на моносахариды, олигосахариды (продукты конденсации двух или нескольких молекул моносахаридов) и полисахариды. Среди олигосахаридов наибольшее значение имеют дисахариды (диозы) — продукты конденсации двух молекул моносахаридов.
Моносахариды и дисахариды
Глюкоза. Важнейшим из моносахаридов является глюкоза С6Н12О6, которую иначе называют виноградным сахаром. Это белое кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. Глюкоза содержится в растительных и живых организмах, в особенности велико ее содержание в виноградном соке (отсюда и название — виноградный сахар), в меде, а также в спелых фруктах и ягодах.
Строение глюкозы выведено на основе изучения ее химических свойств. Так, глюкоза проявляет свойства, присущие спиртам: образует с металлом алкоголяты (сахараты), сложный уксуснокислый эфир, содержащий пять кислотных остатков (по числу гидроксильных групп). Следовательно, глюкоза — многоатомный спирт. С аммиачным раствором оксида серебра она дает реакцию «серебряного зеркала», что указывает на присутствие альдегидной группы на конце углеродной цепи. Следовательно, глюкоза — альдегидоспирт, ее молекула может иметь строение
Однако не все свойства глюкозы согласуются с ее строением как альдегидоспирта. Так, глюкоза не дает некоторых реакций альдегидов. Один гидроксил из пяти характеризуется наибольшей реакционной способностью, и замещение в нем водорода на метальный радикал приводит к исчезновению альдегидных свойств вещества. Все это дало основание сделать вывод, что наряду с альдегидной формой существуют циклические формы молекул глюкозы (

Как видим, в циклических формах альдегидная группа отсутствует. Гидроксильная группа, стоящая у первого углеродного атома, наиболее реакционноспособная. Циклической формой углеводов объясняются их многие химические свойства.
В промышленном масштабе глюкозу получают гидролизом крахмала (в присутствии кислот). Освоено также ее производство из древесины (целлюлозы).
Глюкоза — ценное питательное вещество. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов. Реакцию окисления можно выразить суммарным уравнением:
Глюкоза применяется в медицине для приготовления лечебных препаратов, консервирования крови, внутривенного вливания и т. д. Она широко применяется в кондитерском производстве, в производстве зеркал и игрушек (серебрение). Ею пользуются при крашении и аппретировании тканей и кож.
Фруктоза. Фруктоза — изомер глюкозы, содержится вместе с глюкозой в сладких плодах и меде. Она слаще глюкозы и сахарозы (см. ниже).
Фруктоза является кетоноспиртом. Строение ее молекулы можно выразить формулой
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, так же как и глюкоза, не подвергается гидролизу.
Сахароза. Из группы дисахаридов наибольшее значение имеет сахароза, которая иначе называется свекловичным или тростниковым сахаром. Эмпирическая формула сахарозы C12H22O11.
Велико содержание сахарозы в сахарной свекле и в стеблях сахарного тростника. Она имеется также в соке березы, клена, во многих плодах и овощах.
Сахароза (обыкновенный сахар) — белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Важное химическое свойство сахарозы — способность подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Ионы водорода катализируют процесс гидролиза.
Сахароза не дает реакции «серебряного зеркала» и не обладает восстановительными свойствами. В этом ее отличие от глюкозы. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме; они соединены между собой через атом кислорода.
В Советском Союзе сахарозу получают из сахарной свеклы, содержащей до 20% сахарозы.
Полисахариды
Крахмал. Крахмал, а также целлюлоза (см. ниже) относятся к третьей группе углеводов — полисахаридам.
Молекулярная масса этого вещества точно не установлена, но известно, что она очень велика (порядка 100 000) и для разных образцов может быть различна. Поэтому формулу крахмала, как и других полисахаридов, изображают в виде (С6Н10О5)n. Для каждого полисахарида n имеет различные значения.
Крахмал представляет собой безвкусный белый порошок, нерастворимый в холодной воде. В горячей воде набухает, образуя клейстер.
Крахмал широко распространен в природе. Он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков, риса (до 86%), пшеницы (до 75%), кукурузы (до 72%), а также клубни картофеля (до 24%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной. Крахмал является одним из продуктов фотосинтеза.
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы.
При действии ферментов или при нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу. При этом сначала образуется растворимый крахмал, затем менее сложные вещества — декстрины. Конечным продуктом гидролиза является глюкоза. Суммарное уравнение реакции можно выразить так:
Гидролиз крахмала — его важное химическое свойство.
Крахмал не дает реакции «серебряного зеркала», однако ее дают продукты его гидролиза. Макромолекулы крахмала состоят из многих молекул циклической 
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Так химические свойства крахмала объясняются его строением.
Раствор йода окрашивает крахмал в синий цвет. При нагревании это окрашивание исчезает, при охлаждении вновь появляется. Раствор йода используется для обнаружения крахмала, а раствор крахмала (клейстер) — для обнаружения йода.
Применение крахмала разнообразно. Он является основным углеводом пищи человека — хлеба, круп, картофеля. В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве. Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый спирт. Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья. В медицине на основе крахмала готовятся мази, присыпки и т. п.
Целлюлоза. Целлюлоза, или клетчатка, — еще более распространенный углевод, чем крахмал. Из него состоят в основном стенки растительных клеток. В древесине содержится до 60% целлюлозы, в вате и фильтровальной бумаге — до 90%.
Чистая целлюлоза — белое твердое вещество, нерастворимое в воде и в обычных органических растворителях, но хорошо растворимое в аммиачном растворе гидроксида меди (II) (реактив Швейцера). Из этого раствора кислоты осаждают целлюлозу в виде волокон (гидратцеллюлоза).
Состав целлюлозы, так же как и крахмала, выражается формулой (С6Н10О5)n. Значение n в некоторых видах целлюлозы достигает 40 тыс., а молекулярная масса доходит до нескольких миллионов. Молекулы ее имеют линейное (неразветвленное) строение, вследствие чего целлюлоза легко образует волокна. Молекулы же крахмала имеют как линейную, так и разветвленную структуру. В этом основное отличие крахмала от целлюлозы.
Имеются различия и в строении этих веществ: макромолекулы крахмала состоят из остатков молекул 

Небольшие различия в строении молекул обусловливают значительные различия в свойствах полимеров; крахмал — продукт питания, целлюлоза для этой цели непригодна.
Целлюлоза также не дает реакции серебряного зеркала (нет альдегидной группы), но с кислотами вступает в реакции этерификации. Это дает основание рассматривать каждое звено C6Н10О6 как остаток глюкозы, содержащий три гидроксильные группы. Последние в формуле целлюлозы часто выделяют:
За счет гидроксильных групп целлюлоза может образовывать простые и сложные эфиры.
При взаимодействии целлюлозы с концентрированной азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства образуется сложный эфир — тринитрат целлюлозы:
Это — взрывчатое вещество, применяемое для изготовления порохов.
При обычной температуре целлюлоза взаимодействует лишь а концентрированными кислотами.
Подобно крахмалу, целлюлоза при нагревании с разбавленными кислотами подвергается гидролизу с образованием глюкозы:
Гидролиз целлюлозы, иначе называемый осахариванием,— очень важное свойство целлюлозы, он позволяет получить из древесных опилок и стружек глюкозу, а сбраживанием последней — этиловый спирт. Этиловый спирт, полученный из древесины, называется гидролизным.
На гидролизных заводах из 1 т древесины получают до 200 л этилового спирта, что позволяет заменить 1,5 т картофеля или 0,7 т зерна.
Сырая глюкоза, полученная из древесины, может служить кормом для скота.
Это только отдельные примеры применения целлюлозы. Целлюлоза в виде хлопка, льна и пеньки идет на изготовление тканей —хлопчатобумажных и льняных. Большие количества ее расходуются на производство бумаги. Дешевые сорта бумаги изготовляют из древесины хвойных пород, лучшие сорта — из льняного и хлопчатобумажного тряпья. Подвергая целлюлозу химической переработке, получают несколько видов искусственного шелка, пластмассы, кинопленку, бездымный порох, лаки и многое другое.
Кислородсодержащие органические соединения и их определение
До сих пор мы изучали органические вещества, образованные двумя элементами — углеродом и водородом. Известно много органических веществ, в состав которых наряду с этими элементами входит кислород. Это кислородсодержащие органические соединения. Из них рассмотрим, прежде всего, класс спиртов.
Спирты
Спиртами называются производные углеводородов, в молекулах которых атомы водорода замещены на одну или несколько гидроксильных групп-ОН. Общую формулу спиртов можно представить ROH, где R — углеводородный радикал. По числу гидроксильных групп в молекуле все спирты можно разделить на группы:
а) одноатомные, содержащие одну гидроксильную группу в молекуле: 

б) многоатомные, содержащие несколько гидроксильных групп. Многоатомные спирты, в свою очередь, делятся на двухатомные, трехатомные и т. д.: 

Предельные одноатомные спирты. Важнейшие представители этого класса — метанол 

Получение. В промышленности метанол получают из синтез-газа — смеси оксида углерода (II) с водородом:
Этанол 
Разработано несколько промышленных методов получения этанола. Наиболее важным является спиртовое брожение сахаристых веществ, например, глюкозы в присутствии различных ферментов (дрожжей). В результате образуется этиловый спирт и выделяется углекислый газ:
На современном производстве этанол получают каталитической гидратацией этилена при помощи водяного пара:
Физические свойства. Метанол (метиловый спирт) 

Этиловый спирт 
Химические свойства
1. Как и углеводороды, спирты горят в кислороде и на воздухе с образованием углекислого газа и воды, при этом выделяется большое количество тепла. Так, при горении этанола протекает следующая реакция:
2. При нагревании этанола в присутствии концентрированной серной кислоты образуется этилен:
Многоатомные спирты
Рис. 121. Модель молекулы этиленгликоля.
Этиленгликоль является простейшим представителем двухатомных спиртов. Если в молекуле этана 
Простейшим представителем трех атомных спиртов является глицерин. Формулу глицерина можно вывести из формулы пропана, в молекуле которого три атома водорода заменены гидроксильными группами (рис. 122):

Рис. 122. Модель молекулы глицерина
Физические свойства. Этиленгликоль — вязкая жидкость, сладкая на вкус, температура кипения которой 198°С. Этиленгликоль хорошо растворяется в воде и смешивается в любых соотношениях. При этом он сильно понижает температуру замерзания воды. Например, водный раствор, содержащий 60% гликоля, замерзает при -49°С. Это свойство этиленгликоля используется для приготовления антифризов, незамерзающих смесей для водяного охлаждения двигателей внутреннего сгорания. Этиленгликоль — очень ядовитое вещество.
Глицерин — бесцветная сиропообразная жидкость, сладкая на вкус. Для глицерина характерна хорошая растворимость в воде, он смешивается с водой в любых отношениях, кипит при 290 С.
Применение. Метиловый спирт применяют в производстве полимерных материалов, в качестве растворителя, добавки к автомобильному топливу и др. Этиловый спирт широко применяется в химической промышленности для производства синтетических каучуков, уксусной кислоты, красителей, пластмасс и др. Этиловый спирт применяют в медицине, парфюмерии, а также в пищевой промышленности.
С экологической точки зрения метанол и этанол рассматриваются как источники энергии в будущем, имеющие, в отличие от горючих ископаемых, возобновляемый характер. Эти спирты могут быть получены из растительного сырья.
Этиленгликоль используют для получения волокон (лавсана), как антифриз (незамерзающая жидкость), используемый в радиаторах автомобилей.
Глицерин применяют в парфюмерной и пищевой промышленности, для получения нитроглицерина и динамита, приготовления антифризов, а в медицине — для изготовления мазей, смягчающих кожу. В текстильной промышленности он применяется для придания тканям мягкости и эластичности. В медицине 1%-ный раствор и таблетки нитроглицерина служат в качестве средств, расширяющих кровеносные сосуды.
Спиртами называются производные углеводородов. в молекулах которых атомы водорода замещены на одну или несколько гидроксильных групп-ОН. По числу гидроксильных групп в молекуле все спирты делятся на одноатомные и многоатомные. С экологической точки зрения, метанол и этанол рассматриваются как источники энергии в будущем, так как эти спирты могут быть получены из растительного сырья.
Карбоновые кислоты
Карбоновые кислоты — производные углеводородов, в молекулах которых имеется группа атомов СООН — карбоксильная. Общую формулу карбоновых кислот можно представить: R-COOH, где R — углеводородный радикал. Простейшими представителями карбоновых кислот являются муравьиная НСООН и уксусная 
Рис. 123. Модели молекул карбоновых кислот
Физические свойства. Муравьиная кислота НСООН представляет собой легкокипящую 
карбоновых кислот. Она содержится в ядовитых железах муравьев, крапиве, еловой хвое, поте и моче.
Уксусная кислота 

Химические свойства. Для карбоновых кислот характерны те же свойства, что и для минеральных. Они взаимодействуют с металлами, стоящими в ряду активности до водорода, оксидами металлов, основаниями и солями. Во всех этих реакциях образуются соли карбоновых кислот. Соли муравьиной кислоты называются формиатами, уксусной — ацетатами. Химические свойства карбоновых кислот рассмотрим на примере уксусной кислоты.
1. Водные растворы уксусной кислоты диссоциируют с образованием ионов водорода и изменяют окраску индикаторов:
2. Взаимодействие с металлами:
3. Взаимодействие с основными оксидами:
4. Взаимодействие с основаниями:
5. Взаимодействие с солями более слабых кислот:
6. Взаимодействие со спиртами:
Применение. Дезинфицирующие свойства проявляет смесь этой кислоты и с перекисью водорода. В основном муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма; в фармацевтической промышленности, медицине. Она также используется при крашении тканей и бумаги. Уксусную кислоту применяют для получения пластмасс и искусственного волокна. Ацетат различных металлов используют для окрашивания тканей. Кроме того, раствор уксусной кислоты (уксус) широко применяют в пищевой промышленности и быту.
Натриевые и калиевые соли высших карбоновых кислот — основные составные части мыла.
Карбоновыми кислотами называют производные углеводородов, в молекулах которых имеется группа атомов СООН — карбоксильная. Для карбоновых кислот характерны те же свойства, что и для минеральных. Они взаимодействуют с металлами, стоящими в ряду активности до водорода, оксидами металлов, основаниями и солями. Во всех этих реакциях образуются соли карбоновых кислот.
Сложные эфиры и жиры
Сложные эфиры — функциональные производные карбоновых кислот, в которых гидроксильная группа замещена остатком спирта.
Общую формулу сложного эфира можно представить:
где R и 
Номенклатура. Названия сложных эфиров складываются от названий кислот и спиртов, остатки которых содержатся в их молекулах (рис. 124).
Рис. 124. Модели сложных эфиров
Нахождение в природе. Приятный аромат цветов, плодов и ягод обусловлен присутствием в них тех или иных сложных эфиров.
Получение. Самой распространенной реакцией получения сложных эфиров является реакция этерификации, в которой взаимодействуют карбоновая кислота и спирт. Реакция проводится в присутствии концентрированной серной кислоты, сама же реакция является обратимой:
Сложные эфиры широко применяют в качестве органических растворителей, добавок при производстве освежающих напитков, конфет и других пищевых продуктов, а также в парфюмерии.
К сложным эфирам относятся также животные жиры и растительные масла, но они значительно отличаются от других сложных эфиров по некоторым свойствам и их роли в биологических процессах.
Жиры — сложные эфиры, образованные глицерином и высшими карбоновыми кислотами, где 
В образовании жира могут принимать участие как одинаковые 

Жиры бывают твердые и жидкие (масло), животного и растительного происхождения (рис. 125). Животные жиры, как правило, твердые (но есть исключение — рыбий жир), а растительные — жидкие (однако кокосовое масло — твердое). Твердые жиры образованы преимущественно высшими предельными карбоновыми кислотами — стеариновой 


Рис. 125. Твердые и жидкие жиры
Жидкие жиры образованы главным образом высшими непредельными карбоновыми кислотами — олеиновой 




Жиры — важнейшая часть пищи человека. В организме каждого живого существа они подвергаются гидролизу, а продукты его используются для синтеза жиров, свойственных данному организму. Питательная ценность жиров выше, чем углеводов и белков. При окислении 1 г жира выделяется примерно 39 кДж энергии. Жиры в организме служат резервным питательным веществом, а также выполняют защитную и теплоизоляционную функции.
Кроме того, жиры применяются для получения глицерина, высших карбоновых кислот, мыла.
Сложные эфиры — функциональные производные карбоновых кислот, в которых гидроксильная гpуппa замешена остатком спирта. К сложным эфирам относятся также животные жиры и растительные масла. Жиры — сложные эфиры, образованные глицерином и высшими карбоновыми кислотами. Жиры в организме служат резервным питательным
веществом, а также выполняют защитную и теплоизоляционную функции.
Мыла и синтетические моющие средства
Моющее средство (лат. detergeо — «стираю«) — вещество или смесь, помогающее отмывать грязь. Наиболее распространены три вида смесей-детергентов: мыло, стиральный порошок и шампунь. К моющим средствам традиционно относят синтетические моющие средства (СМС) и мыто, а также средства, дополняющие их действие: отбеливатели, кондиционеры, соли для стирки, восстановители цвета, средства для удаления пятен. Основное назначение СМС — очистка предметов, поверхностей, изделий из ткани и нетканых материалов от загрязнений различной природы.
Синтетические моющие средства (детергенты) представляют собой многокомпонентные композиции и могут быть жидкими, пастообразными и порошкообразными. Первыми детергентами были мыла, полученные из встречающихся в природе веществ.
Мыла — натриевые и калиевые соли высших карбоновых кислот (в основном пальмитиновой, стеариновой и олеиновой). Мыла образуются при щелочном гидролизе жира, а также в реакциях высших карбоновых кислот с щелочами или карбонатами (гидрокарбонатами) калия и натрия:
Калиевые мыла, как правило, жидкие, а натриевые — твердые. Отметим, что мылами называются не только калиевые и натриевые соли высших карбоновых кислот, но и их соли с Са, Al, Со, Zn, Мn, не обладающие моющим свойством. Эти мыла используются для приготовления масляных красок, загустителей различных смазок (солидол) и пр.
В жесткой воде мыло с ионами 
Моющее действие мыла проявляется лишь в щелочной среде. Щелочи, содержащиеся в мыле, ослабляют прочность шерстяных и шелковых тканей, особенно при повышенной температуре, а также могут изменять окраску тканей. Кроме того, жировое сырье для мыл является дефицитным пищевым продуктом. В настоящее время СМС применяют при стирке текстильных изделий, мойке предметов быта, транспортных средств, оборудования. Кроме того, в промышленности они облегчают проведение технологических процессов при отбеливании и крашении тканей, меха и кожи. Все это обусловливает актуальность развития производства и применения синтетических моющих средств, которые обладают следующими преимуществами:
• Производство СМС основано на дешевой сырьевой базе — продуктах переработки нефти и газа.
• Многие СМС одинаково хорошо моют в мягкой, жесткой, а некоторые даже в морской воде.
• СМС в зависимости от их состава могут хорошо отмывать ткани не только в щелочной среде, но и в нейтральной или кислой.
• СМС проявляют моющее действие не только в горячей воде, но и в воде сравнительно низкой температуры, что очень важно при стирке изделий из химических волокон и т. д.
В свою очередь, синтетическим моющим средствам присущ и ряд недостатков: не всегда достаточное моющее действие; более низкая пеноустойчивость; трудная биоусвояемость; сухость кожи рук при стирке. Моющие средства в процессе их использования не подвергаются разрушению, поступая со сточными водами в водоемы, они могут оказать вредное действие на окружающую среду. Чтобы очистить сточные воды от синтетических моющих средств, их подвергают длительному биологическому и химическому разложению.
Первые СМС были созданы в Германии во времена Первой мировой войны в связи с большим дефицитом пищевых жиров, а после войны промышленность СМС стала бурно развиваться в США, Японии и ряде европейских стран. В нашей стране наибольшее количество предприятий по производству моющих и чистящих средств расположено в Туркестанской и Акмолинской областях.
Мыла — натриевые и калиевые соли высших карбоновых кислот. Синтетические моющие средства (детергенты) представляют собой многокомпонентные композиции и могут быть жидкими, пастообразными и порошкообразными. Моющие средства в процессе их использования не подвергаются разрушению, поступая со сточными водами в водоемы. Они могут оказать вредное действие на окружающую среду. Чтобы очистить сточные воды от синтетических моющих средств, их подвергают длительному биологическому и химическому разложению.
Углеводы
Углеводы широко распространены в природе и играют важную роль в жизни человека. Углеводы бывают трех основных типов: моносахариды, дисахариды и полисахариды.
Моносахариды — это углеводы, которые не гидролизуются с образованием более простых углеводов. Молекулы моносахаридов содержат 5 или 6 атомов углерода. Дисахариды (сахароза) состоят из остатков двух моносахаридов.
Полисахариды (крахмал и целлюлоза) образованы большим числом молекул моно-
сахаридов.
Простейшими и важными представителями моносахаридов являются глюкоза и фруктоза. Оба вещества имеют одинаковую молекулярную формулу
Глюкоза — бесцветное (белое) кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус, имеющее невысокую температуру плавления.
Глюкоза содержится почти во всех органах зеленых растений. Особенно много глюкозы в соке винограда и спелых фруктах, ягодах. Иногда глюкозу называют виноградным сахаром. Глюкоза вместе с фруктозой составляет основную часть меда.
В крови человека и животных постоянно содержится около 0,1% глюкозы (80—120 мг в 100 мл крови).
В природе глюкоза синтезируется в результате реакции фотосинтеза:
На производстве глюкозу в основном подают гидролизом крахмала в присутствии серной кислоты:
Глюкоза способна подвергаться брожению. Эти реакции протекают под действием особых биологических катализаторов белковой природы — ферментов. Из различных видов брожения отметим:
1. Спиртовое брожение:
2. Молочнокислое брожение:
В организме человека глюкоза подвергается окислению, а выделяющаяся в этом процессе энергия обеспечивает энергетические нужды организма:
Дисахариды. Наибольшее значение из дисахаридов имеет сахароза
Сахароза известна нам в виде обычного сахара. Она представляет собой бесцветные кристаллы сладкого вкуса, очень хорошо растворима в воде (рис. 126).
Рис. 126. Сахароза
Сахароза содержится в соке березы, клена, моркови, дыне. Особенно много ее в сахарной свекле и сахарном тростнике.
Важнейшее химическое свойство дисахаридов — способность подвергаться гидролизу. При гидролизе сахарозы в кислой среде или под воздействием ферментов образуются глюкоза и фруктоза:
Полисахариды. Крахмал 
Рис. 127. Крахмал в природе
Крахмал представляет собой белый порошок, нерастворимый в воде. В горячей воде он набухает и образует коллоидный раствор — клейстер.
Крахмал сравнительно легко подвергается гидролизу:
Характерной реакцией крахмала является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба. Так определяют крахмал в пищевых продуктах .
Молекулярная формула целлюлозы 
Целлюлоза, или клетчатка, входит в состав растений, образуя в них оболочки клеток, отсюда происходит и ее название (от лат. cellula — “клетчатка”). Целлюлоза придает растениям необходимую прочность и эластичность.
Волокна хлопка и льна содержат до 98% целлюлозы, в древесине она составляет около 50% (рис. 128).
Рис. 128. Целлюлоза: а) древесина; б) хлопок
Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами.
Целлюлоза — волокнистое вещество, не растворимое ни в воде, ни в обычных органических растворителях.
Из повседневной жизни известно, что целлюлоза хорошо горит. При нагревании древесины без доступа воздуха происходит разложение целлюлозы и образуется древесный уголь, метан, метанол. Одно из наиболее характерных свойств целлюлозы — способность в присутствии кислот подвергаться гидролизу с образованием глюкозы:
Применение. Большая часть калорий, поступающих в организм с пищей, содержится в составе углеводов. Глюкоза как ценное, легкоусвояемое питательное вещество находит применение в качестве укрепляющего лечебного средства. Широко применяют глюкозу в кондитерской и текстильной промышленности, в производстве зеркал и аскорбиновой кислоты.
Сахарозу в основном используют в качестве продукта питания и кондитерской промышленности.
Крахмал — одно из важнейших питательных веществ. Он используется не только как продукт питания, но также применяется при производстве глюкозы, этилового спирта, лимонной кислоты и др. Как составная часть древесины, целлюлоза используется в качестве топлива, в строительстве; из нее готовят разного рода столярные изделия. Большие количества целлюлозы расходуются на производство бумаги, этилового спирта, из нее получают ткани. Из эфиров целлюлозы производят кинопленки, искусственные волокна. Углеводы можно использовать для выработки жидкого топлива — этанола, который получают из низкосортной древесины, соломы или другого растительного сырья, содержащего целлюлозу и крахмал.
Развитием сахарной отрасли в нашей стране занимается “Сахарная корпорация». которая была создана в 2009 г. Она объединяет 6 сахарных заводов, а именно Тара зек ий, Меркенский, Бурундайский, Коксуй ский, Ескельдинский. Алакольский. Главной производственной деятельностью компании является выпуск сахарного песка и рафинада. На сегодняшний день только по одному заводу она имеет производственную мощность 800 т в сутки и является монополистом на рынке сахара в Республике Казахстан. Предприятие также планирует стать лидером по поставке сахара во всей Центральной Азии.
Углеводы широко распространены в природе и играют важную роль в жизни человека. Углеводы бывают трех основных типов: моносахариды, дисахариды и полисахариды. Простейшими и важными представителями моносахаридов являются глюкоза и фруктоза. Наибольшее значение из дисахаридов имеет сахароза. Полисахариды (крахмал и целлюлоза) образованы большим числом молекул моносахаридов. Углеводы широко применяются в различных отраслях.
Азотсодержащие соединения. Аминокислоты. Белки
Аминокислотами называют азотсодержащие органические соединения, в молекулах которых содержатся аминогруппы — 
Рис. 129. Модели молекул аминокислот
Они широко распространены в природе, где обнаружено около 150 различных аминокислот. Аминокислоты можно получать при расщеплении белков или из карбоновых кислот, вводя в них аминогруппы.
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. Значение аминокислот исключительно велико, так как они входят в состав молекул белков, играющих важнейшую роль в жизненных процессах.
Белки — это высокомолекулярные природные соединения (биополимеры), макромолекулы которых состоят из остатков 
Образование пептидной связи происходит в результате взаимодействия карбоксила одной аминокислоты с аминогруппой другой:
Группу атомов —СО—NH— называют пептидной, или амидной группой, а связь между атомами углерода и азота — пептидной или амидной связью. Синтезируемые высокомолекулярные соединения называют полипептидами. В состав белков в основном входят остатки 20 аминокислот, 10 из которых (заменимые АМК) могут синтезироваться в организме человека, остальные 10 должны поступать вместе с пищей (незаменимые АМК).
Число аминокислотных остатков, входящих в молекулы отдельных белков, весьма различно: в инсулине их 51, в миоглобине — около 140, поэтому и молекулярная масса белков колеблется от 10000 до нескольких миллионов. Так, например, относительная молекулярная масса белка, входящего в состав куриного яйца, равна 36 000.
В состав белков входят углерод, водород, кислород и азот. Большинство белков содержит, кроме того, серу, а иногда еще фосфор, железо и некоторые элементы. Белки имеют сложную структуру.
Существуют твердые и жидкие белки, растворимые и не растворимые в воде.
Белки не имеют температуры плавления и кипения, так как большинство из них при нагревании сворачиваются. При высокой температуре все белки сгорают. При действии таких реагентов, как соли тяжелых металлов 

Сильное нагревание приводит к более глубокому разложению молекулы белка и образованию летучих, специфических пахнущих веществ (запах горелой шерсти), что используется для распознавания натуральных шерстяных тканей.
В природе белки выполняют все важнейшие функции в обеспечении жизнедеятельности живых организмов. Например, катализаторы белковой природы — ферменты — регулируют протекание биохимических процессов. Существуют белки, которые обеспечивают превращение химической энергии пищи в механическую. Белки, необходимые человеку, содержатся в составе животных белков, находящихся в молоке, мясе, яйцах, рыбе. В сутки человек должен потреблять такое количество пищи, которое дает 1500—2000 килокалорий.
Некоторые белки, не имеющие пищевого значения, используются в технике. К ним относятся, например, белки шелка, шерсти, кожи и др.
Аминокислотами называют азотсодержащие органические соединения, в молекулах которых содержатся аминогруппы — 

В природе белки выполняют все важнейшие функции в обеспечении жизнедеятельности живых организмов. При действии агрессивных сред разрушение структуры белка и изменение его природных свойств называется денатурацией белка.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Кислородсодержащие органические вещества
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный видеоурок создан специально для самостоятельного изучения темы «Кислородсодержащие органические вещества». В ходе этого занятия вы сможете узнать о новом виде органических веществ, содержащих в своем составе углерод, водород и кислород. Учитель расскажет о свойствах и составе кислородосодержащих органических веществ.
http://natalibrilenova.ru/kislorodsoderzhaschie-organicheskie-soedineniya/
http://interneturok.ru/lesson/chemistry/9-klass/organicheskie-veschestva/kislorodsoderzhaschie-organicheskie-veschestva